改良左側maze Ⅲ型術治療風濕性和退行性二尖瓣病變合并房顫的比較研究
馬杰 趙曙光 張文立 高偉年 閆芳 陳子英 孫涌泉 崔紅占
二尖瓣病變病因多種多樣,以往在發展中國家風濕性病變最常見,而在發達國家則以老年退行性并比那為主[1,2]。隨著人口老齡化和瓣膜病疾病譜的遷移,我國流行病學最新研究顯示,雖然風濕性仍是二尖瓣狹窄(mitral stenosis,MS)的主要病因(83.6%),退行性病變已成為聯合瓣膜病(31.1%)和單純二尖瓣反流(mitral regurgitation,MR)的第一病因(29.7%)[3,4]。二者不同的病理原因對左側房、室結構造成了不同的影響,慢性風濕性二尖瓣(rheumatic mitral,RM)病變常伴有左室容積的減少及舒張功能下降,而慢性退行性二尖瓣(degeneratice mitral,DM)病變常伴有嚴重左室擴大及心室收縮儲備下降[5]。二者均可合并房顫,房顫治療的效果與原發二尖瓣病理是否相關有待進一步探討[6]。在伴有房顫的二尖瓣疾病患者,能否在二尖瓣手術時同期完成房顫治療至關重要,迷宮手術是目前外科解決房顫問題的主要方法,無論迷宮Ⅳ型或改良迷宮Ⅲ型手術均已被證實是治療房顫的有效手段。恢復竇性心律是迷宮手術的首要目標,但是迷宮術后竇性心律患者的心房并非一定具有收縮功能,對于部分行生物瓣膜置換的患者而言,如果心房收縮功能未恢復,華法林等抗凝藥物的停用可能會誘發心房內血栓形成,進而出現血栓栓塞等風險[7]。本研究以竇性心律恢復率及左房功能恢復作為整體指標加以評判,采用改良左側maze Ⅲ型(Simplified left maze type Ⅲ,SLM Ⅲ)手術對兩種不同二尖瓣病理類型合并的房顫加以治療。評價這一術式對不同二尖瓣病理改變造成的房顫的近期療效、差異及安全性。
1 資料與方法
1.1 一般資料 按入組與排除標準篩選出符合條件的2014年1月至2019年7月患者45例,其中男18例,女27例;年齡36~73歲,平均年齡(58.7±8.4)歲。該組患者術前病史:腦梗死病史7例,合并左心房血栓5例,合并高血壓病11例,合并糖尿病9例,合并冠心病3例,合并三尖瓣病變15例。選出RM病變合并房顫患者24例,同期隨機選取21例DM病變合并房顫患者,2組均在術中二尖瓣置換或成形手術同時實施了SLM Ⅲ型手術,所有患者經醫院倫理委員會批準并簽署患者知情同意書。依據24 h動態心電圖確診心房顫動。以7d作為陣發性心房顫動與持續性房顫的分界線,持續時間超過1年者定義為慢性持續性房顫。超聲心動圖檢測判斷MS與MR程度、左心室舒張末期內徑(LVEDD)、左心室收縮末期內徑(LVESD)、左心房內徑(LAD)、左心室射血分數(LVEF)。冠狀動脈造影排除冠心病。2組年齡、性別比、心功能Ⅲ+Ⅳ級構成比較,差異有統計學意義(P<0.05),其他指標比較,差異無統計學意義(P>0.05)。見表1。
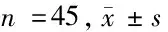
表1 2組基線資料比較
1.2 納入與排除標準
1.2.1 納入標準:①風濕性二尖瓣病變與退行性二尖瓣膜病變患者同期行SLM Ⅲ型手術;②合并陣發性或慢性持續性房顫;③伴有或不伴有主動脈及三尖瓣病變。
1.2.2 排除標準:①合并先天心心臟畸形或左向右分流畸形;②合并嚴重的冠心病,需同期CABG治療;③合并感染心內膜炎或二次手術;④嚴重心衰LVEF<30%或存在重度肺動脈高壓(≥70 mm Hg)。
1.3 SLM Ⅲ型手術方法 常規靜吸復合麻醉及雙腔氣管插管。采用胸正中切口。淺低溫(32℃~34℃)下上下腔及升主動脈插管建立體外循環。主動脈根部冷血順行灌注心肌保護(20 min/次)。游離上下腔靜脈心包返折及房間溝,上下腔及主肺動脈后方經橫竇套帶便于牽拉顯露。SLM Ⅲ型手術線路如下:房間溝后方左房側壁橫行切口,上至上腔靜脈后方,下至下腔靜脈后方(線路1)。延續線路1在二尖瓣峽部距瓣環2.5 cm處做杯狀切口至左心耳部(線路2)。紗布包裹向右上牽拉心臟暴露切斷左心耳及mashall韌帶,(線路3)。牽拉套帶經橫竇內做左房頂至上腔靜脈后方切口(線路4)。于各線路交匯處用3-0prolene線褥式固定,解剖位置對齊。完成左房大部環形隔離,線路2至二尖瓣環之間的峽部采用單極射頻消融(線路5)。按照3→2→1→4的順序應用3-0 prolene連續縫合各切口,均勻縫合、拉緊縫線以防切口滲血。術畢常規于右心室表面安置心臟起搏導線。見圖1。
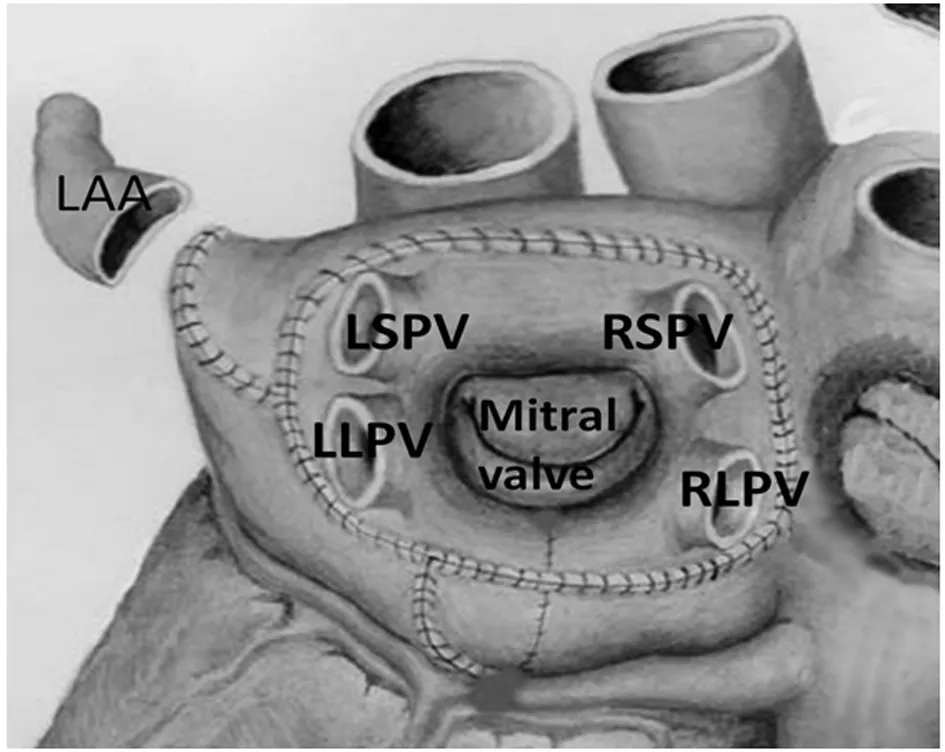
圖1 SLM Ⅲ型手術示意圖
1.4 術后處理 術后行常規重癥監護、持續性心律監測,根據心律情況行心室起搏,給予呼吸機輔助及血管活性藥物及膠體等支持治療,重點記錄心律變化。所有患者術后均口服或微量泵靜脈泵入胺碘酮 300~600 mg/d,進食后改口服200 mg,1~3 次/d,口服3個月,竇性心律或心率<60 次/min時,酌情減量或停用胺碘酮;如出現結性心律或嚴重心律過緩時啟用臨時起搏器起搏,恢復竇性心律后停用,對于植入二尖瓣生物瓣或采用瓣膜修復成型的患者,口服華法林抗凝6個月;對于機械瓣置換的患者,終身服用華法林抗凝治療,抗凝標準為INR 2.0~2.5。
1.5 觀察指標 比較2組患者術前一般臨床指標,觀測術中主動脈阻斷時間、體外循環(CPB)時間、心臟復跳及重癥監測心律情況、24 h心包縱隔引流量、二次止血等并發癥、呼吸機輔助時間,ICU停留時間,臨時起搏情況、胺碘酮應用情況、總住院時間等指標。出院時和術后1、3、6個月隨訪時行24 h動態心電圖監測和超聲心動圖檢查。超聲心動圖采用經胸二維和多普勒超聲檢查,探頭為1~5 MHz,測量心臟房室經線,二尖瓣人工瓣膜啟閉狀況,心臟射血分數,并利用多普勒脈沖采集二尖瓣A峰值,進一步判斷左心房收縮狀況(A峰值>10 cm/s)。術后房顫復發的定義為任何持續超過30 s的心房顫動或快速房性心律失常。
2 結果
2.1 圍術期手術相關指標比較 術中統計SLM Ⅲ型手術平均耗時42.6 min,RM組與DM組比較,DM組CPB時間和主動脈阻斷時間較RM組均明顯增加,差異有統計學意義(P<0.001)。術后24 h引流液量、人工呼吸機輔助時間、ICU 監護時間、臨時起搏及胺碘酮應用比例、并發癥發生率差異無統計學意義(P>0.05)。見表2。
2.2 2組患者術后竇性心律恢復情況比較 竇性心律恢復率:術中心臟復跳后RM組為83.3%,出院時為79.1%,6個月隨訪為70.8%。DM組心臟復跳為 85.7%,出院時為85.7%,6個月隨訪為71.4%。2組術后各期竇性心律恢復率差異無統計學意義(P>0.05)。心臟復跳未恢復竇性心律的患者中RM組陣發性房顫1例,結性心律3例,DM組陣發性房顫2例,結性心律1例。在院期間RM組有1例由竇性心律轉為陣發性房顫心律,6個月隨訪時RM組有復發房顫2例,DM組復發房顫3例,2組間竇性心律恢復率差異無統計學意義(P>0.05)。見圖2,表3。

圖2 2組竇性心律恢復影響的生存曲線
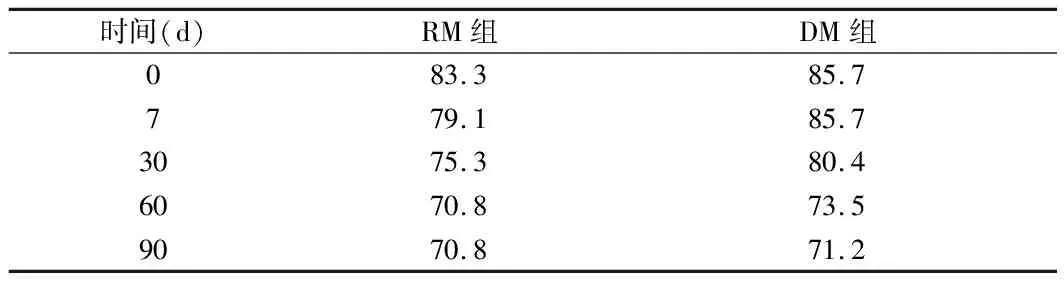
表3 2組患者術后竇性心律恢復率 %
2.3 2組患者左心房收縮功能恢復比較 超聲心動圖顯示2組患者行迷宮術后24 h內均未出現A峰,房顫轉復后左心房機械功能出現“頓抑”,考慮與手術切割損傷較重有關。術后3 d,RM組僅1例患者,DM組僅2例患者左房恢復收縮功能,2組患者出院時左心房功能恢復均差,在隨診期間2組患者左心房收縮功能逐步恢復,術后3個月時,2組患者竇性心律與左心房收縮功能共存的一致性仍較差(kappa=0.347,P<0.001),DM組與RM組患者左心房功能恢復率差異無統計學意義(P>0.05)。見圖3,表4。
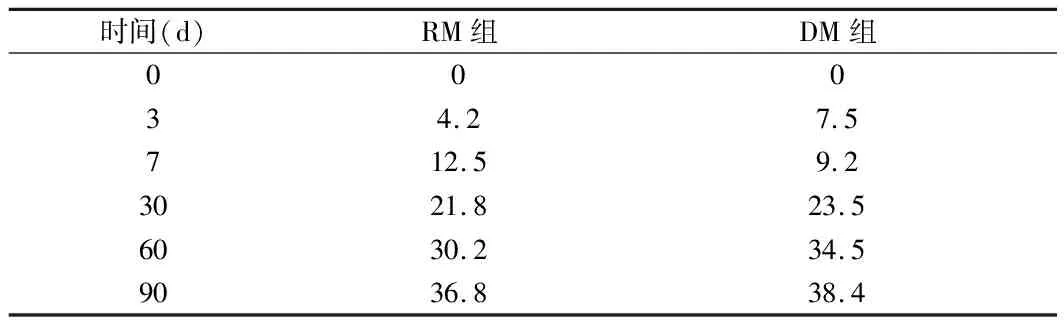
表4 2組患者術后左心房功能恢復率 %
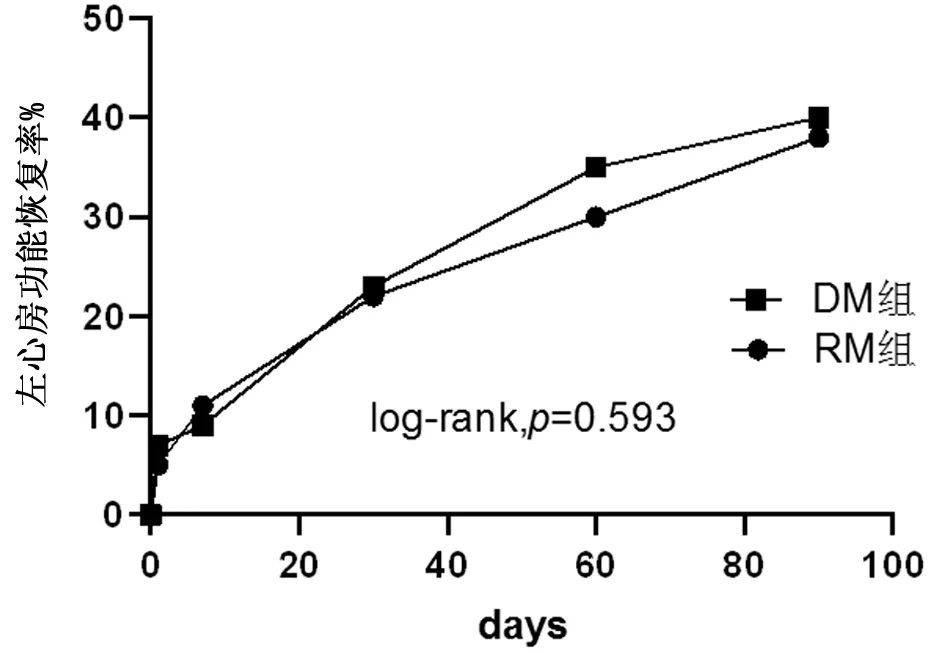
圖3 2組左心房功能恢復影響的生存曲線
3 討論
風濕性病變是反復的風濕性炎癥導致瓣膜增厚、鈣化、交界黏連,從而導致瓣膜狹窄,RM病變不僅可引起壓力-容量超負荷相關的心房結構改變,風濕性病變亦可引發心房肌纖維化[8]。此外RM病變的細胞內改變如心肌細胞的肥大、全身炎性反應以及心房壁的增厚與鈣化而導致的心房病理改變較DM病變為重[9]。已知心房顫動是發生晚期死亡、致殘和腦卒中的獨立危險因素[10],但僅有38%的風濕性瓣膜病合并心房顫動患者在接受心臟手術的同時接受心房顫動手術治療[11]。DM關閉不全的發病率在中國逐年增加,其中有30%~50%的患者伴發心房顫動[12],采用“切割”技術的改良迷宮Ⅲ型手術在風濕性房顫治療上的策略是否可以用于指導退行性瓣膜疾病患者的臨床決策?兩種具有不同病理生理的結構性心臟病相關的房顫的維持機制是否一致?這些問題需要加以探討。
RM組與DM組術前基線資料對比顯示,這2個群體的人口統計學特征截然不同。但此差異并不排除由于樣本過少所致。RM病變以狹窄為主,而DM以關閉不全為主,不同的病理生理進而造成了2組患者左心室內徑指標(LVEDD、LVESD)差異明顯,平均LAD風濕性較退行病變組略有增大。值得注意的接受手術的2組患者NYHA功能惡化等級差異明顯(P<0.01),接受手術的RM病患者NYHA心功能評級中Ⅲ+Ⅳ級占87.5%,而DM病變患者僅占52.4%,退行性瓣膜疾病的臨床癥狀出現晚于風濕性瓣膜疾病,研究共識認為在退行性二尖瓣關閉不全患者中,有癥狀的患者的二尖瓣術后病死率很高;而無癥狀者二尖瓣成形術后存活率與正常人群的存活率相同,因此無癥狀患者更應早期進行外科干預[13]。
通常認為對于以二尖瓣病變為基礎的房顫,多合并左房的擴大及心房肌電生理的重構,房顫維持最關鍵的折返性徑路多存在于左肺靜脈及左心房后壁[14]。鑒于此本研究采用SLM Ⅲ型手術來代替復雜的cox maze Ⅲ及COXMAZEⅣ型手術,本研究SLM Ⅲ術中耗時42.6 min,主動脈阻斷時間及CPB時間相應延長,研究發現DM組較SM組在體外循環時間和主動脈阻斷時間明顯增加(有統計學意義),主動脈阻斷時間平均延長31 min,CPB時間平均延長27 min,主要源于DM組二尖瓣成形手術耗時較長,然而在良好的體外循環轉流和確實的心肌保護下,這一事件對患者術后并發癥、呼吸機輔助時間、ICU 停留時間、24 h心包縱隔引流量、總住院時間等圍術期指標均無明顯差異。
RM組和DM組術后竇性心律恢復率均超過80%,療效相當。在出院時及術后6個月隨訪發現,RM組及DM組均有房顫復發患者,術后6個月,RM組竇性恢復率可高達70.8%。而DM組為71.4%。雖然RM與DM組2組術前基線資料差異明顯,然而在應用SLM Ⅲ手術治療房顫的療效并無差別,初步推斷SLM Ⅲ手術療效與疾病病理類型并無相關。分析SLM Ⅲ手術失敗案例發現,13例術后房顫患者平均LAD內徑為64.73 mm,32例術后竇性心律患者平均LAD為48.91 mm,2組患者LAD差異有統計學意義(P<0.01),因此本研究視左房內徑大小為SLM Ⅲ術后復發的一個危險因素[15]。進一步分析發現,SLM Ⅲ術后房顫患者三尖瓣成形率達84.6%(11∶13),而術后維持竇性患者三尖瓣成形率12.5%(4∶32),追溯患者超聲資料發現,SLM Ⅲ術后房顫患者多合并右心房增大,考慮二尖瓣病變隨著疾病的病程發展,由單純左心房擴大受損發展為雙側心房增大,進而右心房心肌電生理的重構形成右心房折返性徑路而參與房性心律失常的形成,因此對于該類患者行單純的左側心房隔離SLM Ⅲ型手術已不能完全阻斷房顫的發生[16]。因此SLM Ⅲ型手術在手術適應證和患者選擇方面需嚴格把關。RM組和DM組術后及隨訪期間,左心房收縮功能均不佳,這可能與心房壁肌肉重構過程有關,迷宮術后左心房收縮功能為一個動態提高的過程,隨著時間的延長,竇性心律和左心房收縮共存的一致性才較好[17,18]。
總之,RM和DM病變具有截然不同的臨床基線資料,而2組采用SLM Ⅲ型手術的房顫竇性恢復率并無差異,左心房大小是瓣膜性房顫患者手術失敗及術后復發的獨立危險因素,在嚴格把握適應證的前提下,SLM Ⅲ型手術是治療RM和DM病變合并心房顫動的安全、經濟且有效的方法。

