半程腎動脈阻斷在腹腔鏡腎部分切除術中的應用
孫 巍,劉建民,郭園園,楊小淮,李立強,高五岳,劉貝貝
腎癌是泌尿系統(tǒng)常見的惡性腫瘤之一,占成人惡性腫瘤的2%~3%[1-2]。腹腔鏡下腎部分切除術(laparoscopy partial nephrectomy,LPN)因具有創(chuàng)傷小且保留腎單位的優(yōu)勢,已被推薦為T1期腎癌的主要治療方式[3]。目前,大部分醫(yī)院仍在腎臟血流阻斷的前提下完成腫瘤切除與殘腎處理,包括創(chuàng)面縫合止血、集合系統(tǒng)修補和殘余腎成形等。由于熱缺血時間(warm ischemia time,WIT)是影響術后殘腎功能的關鍵因素,因此,如何縮短WIT從而保護LPN術后殘腎功能是泌尿外科醫(yī)生關注的問題之一。本研究通過探討半程腎動脈阻斷技術在LPN中的安全性及術后腎功能的改變,從手術技巧層面為減少WIT和保護腎功能提供新的思路和方法。
1 資料與方法
1.1 一般資料 回顧性分析2016年7月至2019年7月于蚌埠醫(yī)學院第一附屬醫(yī)院泌尿外科行后腹腔鏡腎部分切除術的T1期腎癌病人94例。根據腎動脈阻斷時程不同分為半程腎動脈阻斷組(A組)32例和全程腎動脈阻斷組(B組)62例。根據腫瘤分期不同,A組分為T1a期病人(A1組)21例和T1b期病人(A2)11例,B組分為T1a期病人(B1組)43例和T1b期病人(B2組)19例。納入標準:(1)單側單發(fā)腫瘤,術后病理證實為T1N0M0期腎癌;(2)術前未行放化療治療;(3)病人病歷資料完整,術后接受長期隨訪。排除標準:(1)有淋巴結轉移或遠處轉移者;(2)慢性腎病史;(3)凝血機制異常;(4)孤立腎腎腫瘤病人;(5)既往有腎臟手術、結締組織病以及影響腎功能的高血壓、糖尿病者。
1.2 手術方法 手術均由同一治療組醫(yī)生經腹膜后途徑完成。全麻后,常規(guī)留置導尿,健側臥位固定,墊高腰部。手術方式為后腹膜入路,三孔法實施。游離出腎動脈和腫瘤,保持視野清晰,辨識腫瘤和正常腎組織分界,靜脈推注肌酐1.0 g后使用腔鏡動脈阻斷夾阻斷腎動脈,記錄阻斷開始時間。吸引器配合暴露視野,距腫瘤假包膜0.5~1.0 cm處以剪刀銳性切除腫瘤。創(chuàng)面雙極電凝止血后,深部創(chuàng)面采用3-0可吸收線倒刺線連續(xù)貫穿縫合。重點縫合腎臟創(chuàng)面血管斷端與集合系統(tǒng)破損,自創(chuàng)面一端逐漸縫合至創(chuàng)面底部,然后縫合至另一端。每針均拉緊縫線,確保不留腔隙。深層創(chuàng)面最后一針縫線穿出腎包膜以Hem-o-lock鉗夾收緊固定。淺層創(chuàng)面以2-0可吸收縫倒刺線連續(xù)縫合,適當收緊每一針后穿出正常腎組織包膜后,線尾拉緊并用一枚Hem-o-lock鉗夾固定。縫合過程中內層縫合結束時,腎臟深層創(chuàng)面主要血管與集合系統(tǒng)已經關閉,試行原位松動腎臟動脈阻斷夾,觀察創(chuàng)面無活動性出血即移除腎動脈阻斷,即為A組“半程腎動脈阻斷”。內層縫合完成后,并不解除腎動脈阻斷,于外層縫合完成后解除阻斷為B組“全程腎動脈阻斷”。
1.3 觀察指標 記錄2組病人年齡、體質量指數(BMI)、性別、腫瘤分期、部位、R.E.N.A.L.評分等一般資料和手術時間、出血量、WIT、漏尿等圍手術期指標,以及觀察3個月后腎萎縮、患側腎小球濾過率(eGFR)降低遠期并發(fā)癥指標。
1.4 統(tǒng)計學方法 采用t檢驗、χ2檢驗和Fisher′s確切概率法。
2 結果
2.1 不同阻斷時程和腫瘤分期病人一般資料比較 94例病人手術均獲成功,A組病人解除腎動脈阻斷后無再次或反復阻斷情況發(fā)生。所有肉眼血尿均在術后24~72 h內消失,無嚴重經尿道不可控活動性出血。A組和B組、A1和B1組、A2和B2組病人相比,性別、年齡、BMI、腫瘤大小、分期、位置以及R.E.N.A.L.評分等一般資料差異均無統(tǒng)計學意義(P>0.05)(見表1)。
2.2 2種阻斷方式病人圍手術期及遠期并發(fā)癥指標比較 A組病人WIT短于B組病人,eGFR下降值低于B組(P<0.01)。但病人手術時間、術中出血量、術后住院時間等圍手術期指標在2組差異無統(tǒng)計學意義(P>0.05)(見表2)。
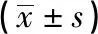
表2 2種阻斷方式病人圍手術期及遠期并發(fā)癥指標比較
2.3 2種阻斷方式在T1a、T1b病人中的比較 為了證實2種阻斷方式在不同分期病人中的應用價值,分別將A組和B組病人根據分期不同分為A1和A2,B1和B2組。病人WIT A1組短于B1組、A2組短于B2組(P<0.01)。但在手術時間、術中出血量、血尿、漏尿、腎萎縮等指標差異無統(tǒng)計學意義(P>0.05)(見表3)。
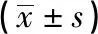
表3 2種阻斷方式在T1a病人中的應用比較
3 討論
臨床上晚期腎癌三聯征“腰痛、腫塊、消瘦”由于體檢的普及明顯減少。更多的早期小體積腎臟腫塊被檢出,尤其以T1期腫瘤常見。由于這些腫瘤具有分期早、體積小、轉移潛能低和增長速度慢的特點,醫(yī)患均不滿足于施行傳統(tǒng)的腎癌根治性手術,治愈疾病的同時希望可以保留器官及其功能。LPN在保留臟器的同時可以有效降低患慢性腎臟疾病的風險[4]。LPN與傳統(tǒng)根治術在T1期有相同的腫瘤控制效果[5-7],已成為治療T1期腎癌的金標準[8],腹腔鏡技術的發(fā)展至今已有20余年,首例經腹LPN由WINFIELD等[9]于1993年報道[9],1年后GILL等[10]報道了首例經腹膜后LPN,并在世界范圍內得到了廣泛推廣,由于其對病人手術創(chuàng)傷小、術后恢復快及縮短住院時間等明顯優(yōu)點,且術后腎功能恢復程度及腫瘤控制指標如:復發(fā)和/或遠處轉移率差異無統(tǒng)計學意義,使其在臨床中得到了廣泛的應用[11-13]。
與根治術不同,LPN術由腫瘤切除與殘腎縫合兩部分組成[14-15]。現階段LPN主流方法[16]是在腎動脈阻斷后行腫瘤切除和殘腎處理:包括創(chuàng)面縫合止血、殘存腎成形和集合系統(tǒng)修補。阻斷時間即腎WIT是影響術后腎功能與遠期并發(fā)癥的關鍵因素之一。多項研究[17-18]表明,WIT是術后腎功能受損、腎臟萎縮的關鍵影響因素,傳統(tǒng)理念認為WIT超過半小時將會對腎臟產生不可逆損傷。缺血期內腎細胞有氧代謝發(fā)生障礙,細胞內電解質紊亂和酸性產物增加,細胞水腫、壞死,釋放大量炎性趨化因子。阻斷結束后這些趨化因子活化并聚集中性粒細胞,釋放氧自由基,進一步損傷腎臟。但THOMPSON等研究發(fā)現熱缺血每分鐘的延長都會加重腎臟損傷的程度[19]。為縮短WIT,研究者嘗試不阻斷腎動脈的情況下進行瘤體切除和腎臟創(chuàng)面縫合,實現腎臟的零缺血,避免熱缺血損傷,但術中出血量、手術時間、術后并發(fā)癥均明顯增加[20]。2008年,NGUYEN等[21]嘗試一種半阻斷技術,證實其可顯著減少50%以上的WIT,且并未明顯增加手術時間與并發(fā)癥。相比改進縫合方式以縮短WIT,此方法在深層創(chuàng)面縫合完成后即解除腎動脈阻斷的思維顯然是開創(chuàng)性的。阻斷之目的是減少創(chuàng)面出血以利縫合操作,故當牢靠的內層縫合可保障腎臟創(chuàng)面無活動性出血,阻斷即失去了意義。因此半程阻斷在技術上完全可行,又顯著縮短腎血流阻斷的時間。
本研究發(fā)現,兩種阻斷方式在T1a期腫瘤僅WIT的差異有統(tǒng)計學意義,而在手術時間、出血量和術后并發(fā)癥等方面并無明顯差異。考慮原因可能與此期瘤體較小,多數腫瘤位置相對表淺,瘤體切除無需損傷集合系統(tǒng),創(chuàng)面易于縫合止血等因素相關。T1b期腫瘤中,半程阻斷技術優(yōu)先關閉集合系統(tǒng),第一層縫合腎髓質時已經縫合集合系統(tǒng)和創(chuàng)面斷端血管,解除阻斷并不會大量出血影響縫合,縮短WIT,保護腎功能。我們的經驗是內層創(chuàng)面按順序縫合好血管斷端和集合系統(tǒng)破損處,如對內層縫合止血難以確定是否確切,可以在內層縫合完畢后原位解除腎動脈阻斷進行觀察,如無活動性出血即可解除阻斷,否則,迅速恢復阻斷進行出血點再次縫合。切忌盲目移除阻斷夾,以免造成大出血導致操作困難,甚至危及病人生命。同時應盡可能地縫合好內層,避免阻斷、恢復反復進行,加重缺血再灌注損傷。
綜上所述,在T1期腎腫瘤中,半程腎動脈阻斷技術在LPN中的應用可縮短腎臟WIT、減少腎功能下降和術后腎萎縮等并發(fā)癥,在T1b期優(yōu)勢更為明顯,具有良好的安全性與實用性,具有臨床推廣意義。

