NAA、IAA與魚肉蛋白酶解物對小球藻生長和抗氧化能力的影響
趙子續(xù) 張寶龍 曲 木 唐子鵬 翟勝利
天津現(xiàn)代晨輝科技集團(tuán)有限公司/天津市水族動物功能性飼料企業(yè)重點實驗室,天津301800
植物激素又稱植物內(nèi)源激素,指植物體內(nèi)產(chǎn)生的一些微量并能調(diào)節(jié)自身生理活動過程的小分子有機(jī)化合物,共分為生長素、乙烯、脫落酸、赤霉素、細(xì)胞分裂素和油菜素甾醇六類。其中,生長素是第1個被發(fā)現(xiàn)的植物激素,吲哚乙酸(IAA)為其重要的化學(xué)物質(zhì),具有促進(jìn)植物生長的作用。而作為生長素類似物的萘乙酸(NAA)在植物生長過程中具有重要的調(diào)節(jié)作用,二者在農(nóng)業(yè)生產(chǎn)上應(yīng)用廣泛。陳穎等[1]研究表明,植物激素對螺旋藻的生長和代謝產(chǎn)物的合成有明顯的促進(jìn)作用。
在水產(chǎn)養(yǎng)殖中,一些低值魚類被簡單地加工成經(jīng)濟(jì)效益極低的飼料魚粉,由于加工和回收手段的落后導(dǎo)致營養(yǎng)物質(zhì)大量流失,產(chǎn)品使用價值較低。因此,提高低值魚類的利用價值具有重要的研究意義。酶解法具有操作方便、對營養(yǎng)物質(zhì)破壞小等優(yōu)點,被廣泛應(yīng)用于動物蛋白的回收。何建君等[2]研究表明,魚蛋白經(jīng)酶降解后,功能和品質(zhì)得到了顯著提高。
小球藻(Chlorella vulgaris)隸屬于綠藻門,小球藻屬,是一種單細(xì)胞淡水藻類,具有生長速度快、易于培養(yǎng)、營養(yǎng)豐富等優(yōu)點。在水產(chǎn)養(yǎng)殖中,常作為輪蟲、橈足類等強(qiáng)化培育餌料,也可作為魚類的開口餌料,具有很高的應(yīng)用價值。羅川等[3]研究表明,在小球藻培養(yǎng)基中添加2 種植物激素,小球藻生長及脂質(zhì)合成影響顯著。葉林超等[4]研究表明,動物蛋白酶解物與氮、磷的組合能顯著提高小球藻的生物量,促進(jìn)葉綠素和藻體蛋白質(zhì)的合成。而研究植物激素和動物蛋白酶解物相結(jié)合對小球藻的影響卻鮮有報道。本試驗中研究了2 種植物激素(NAA、IAA)和動物蛋白酶解物之間的不同組合對小球藻生長和生理生化的影響,旨在為植物激素和動物蛋白酶解物在藻類生長的研究提供方法,為小球藻的深入研究和大規(guī)模生產(chǎn)提供理論依據(jù)。
1 材料與方法
1.1 試驗材料
藻種來源:中國科學(xué)院水生生物研究所購買藻種(普通小球藻FACHB-1227),在天津現(xiàn)代晨輝科技集團(tuán)有限公司研發(fā)中心實驗室擴(kuò)培至30 L 以試驗備用,測得其吸光度為0.640。
以BG11 培養(yǎng)基[5]為小球藻基礎(chǔ)培養(yǎng)基,其營養(yǎng)鹽成分主要由NaNO3、K2HPO4和MgSO4·7H2O 等組成。各營養(yǎng)鹽的添加量及A5 組成見表1和表2,調(diào)節(jié)其pH 為7.5~8.0,測得其吸光度為0.011。
1.2 試驗方法
1)蛋白酶解物的制取。取適量經(jīng)絞碎的新鮮魚肉,1∶1 加水充分?jǐn)嚢瑁?00∶1 添加枯草桿菌酶,一定溫度下水浴酶解3 h 后,90 ℃滅酶15 min,水浴冷卻,5 000 r/min 離心10 min,取上清液[6]。
2)試驗設(shè)計。本試驗以NAA、IAA 和蛋白酶解物為影響因素,進(jìn)行三因素三水平正交試驗[7],研究不同濃度(0.5、2.0、3.5 mg/L)NAA、IAA 和(0.05、0.20、0.35 mL/L)蛋白酶解物對小球藻生長及營養(yǎng)含量的影響;比較不同添加劑的不同添加量對小球藻生長的誘導(dǎo)效果。小球藻藻種與添加相應(yīng)植物激素和蛋白酶解物的BG11 培養(yǎng)基按1∶3 的比例擴(kuò)培,測得初始小球藻吸光度為0.145±0.006。正交試驗因素水平見表3。
3)培養(yǎng)條件。試驗采用混養(yǎng)模式,將培養(yǎng)瓶置于光照培養(yǎng)箱培養(yǎng),光照3 000~4 000 lx,光暗周期為12 h∶12 h,溫度25~30 ℃,每組設(shè)置3 個平行[8],培養(yǎng)周期為10 d。

表1 小球藻BG11 培養(yǎng)基組成

表2 A5 試劑的組成
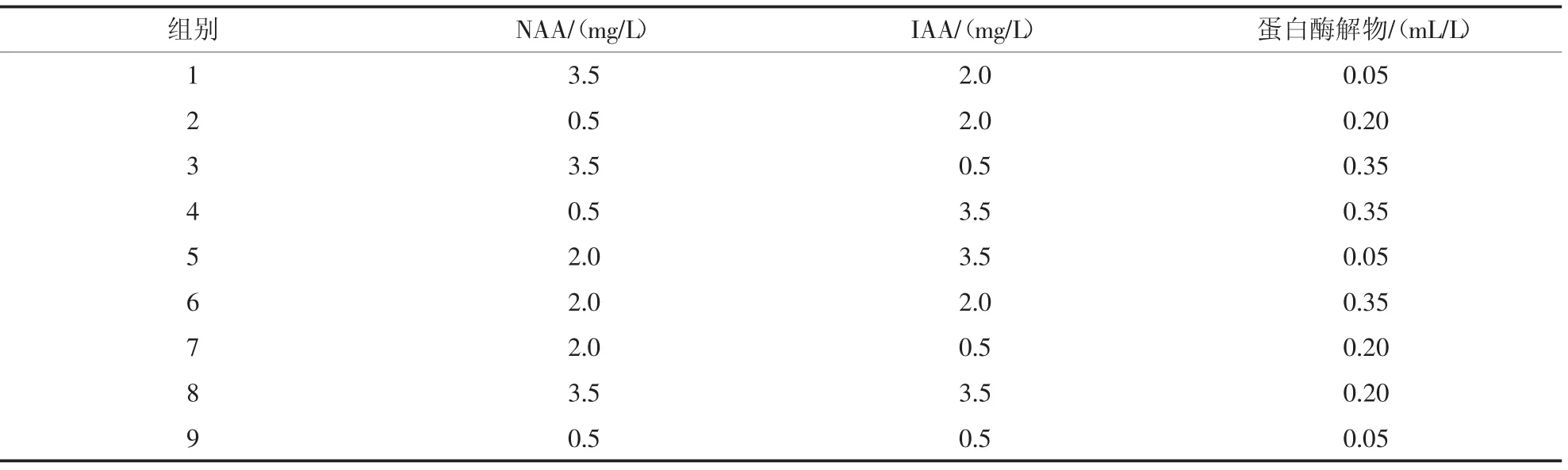
表3 NAA、IAA 與蛋白酶解物組合的正交試驗設(shè)計
4)試驗測定。
①生長指標(biāo)測定
A.吸光度:試驗開始時,采用分光光度計于波長680 nm 測定不同植物激素添加量的小球藻液的吸光度值,并在培養(yǎng)期間每天測1 次吸光度,測定小球藻的繁殖速度。
B.細(xì)胞密度:采用0.1 mL 計數(shù)框計數(shù),取稀釋后的小球藻液0.1 mL 于浮游植物計數(shù)框,在生物顯微鏡(400~600 倍)下,選取5 個視野觀察計數(shù);每個水樣計數(shù)2 次,取其平均值,把計數(shù)所得結(jié)果換算為原來水樣中藻類的數(shù)量時,用下式計算:
N=1000×10×20 n×A
式中:
N——1 L 原水樣中浮游植物數(shù)量(個/L);
n——計數(shù)所得每次計數(shù)框藻類的平均數(shù)量;
A——稀釋倍數(shù)。
C.比生長速率(μ)[9]:μ=(lnNt-lnN0)/T
式中,Nt 和N0分別為經(jīng)過T 天后細(xì)胞密度和初始細(xì)胞密度。
②生化指標(biāo)測定。
試驗周期結(jié)束以后,準(zhǔn)確稱取小球藻組織濕重,按重量(g)∶體積(mL)=1∶4 的比例,加入4 倍體積的PBS 緩沖液,冰水浴條件下勻漿,3 500 r/min,離心10 min,取上清液稀釋成相應(yīng)的濃度用于生化指標(biāo)的測定。蛋白質(zhì)定量、過氧化氫酶(CAT)、丙二醛(MDA)、超氧化物歧化酶(SOD)均采用試劑盒測定,購于南京建成生物工程研究所。
5)數(shù)據(jù)分析。采用Excel 對數(shù)據(jù)進(jìn)行分析,試驗數(shù)據(jù)以“平均值±標(biāo)準(zhǔn)差(mean±SD)”表示。采用SPSS 18.0 統(tǒng)計分析軟件進(jìn)行單因素方差分析,若差異性顯著(P<0.05)則進(jìn)行Duncan’s 多重比較分析。
2 結(jié)果與分析
2.1 對小球藻生長指標(biāo)的影響
1)對小球藻吸光度的影響。植物激素與動物蛋白酶解物的不同組合對小球藻生長的影響從圖1可知,在試驗周期內(nèi),小球藻培養(yǎng)基中添加相應(yīng)的不同植物激素和蛋白酶解物,小球藻吸光度的變化范圍為0.673~0.821。各組之間小球藻吸光度差異顯著(P<0.05)。4 組(NAA 0.5 mg/L、IAA 3.5 mg/L、蛋白酶解物0.35 mg/L)和6 組(NAA 2.0 mg/L、IAA 2.0 mg/L、蛋白酶解物0.35 mg/L)小球藻的吸光度較高,分別為0.821±0.010 和0.802±0.009,且2 組之間小球藻吸光度無顯著性差異(P>0.05)。9 組(NAA 0.5 mg/L、IAA 0.5 mg/L、蛋白酶解物0.05 mg/L)小球藻的吸光度較低,為0.673±0.011,9 組比4 組降低了18.03%。基于小球藻吸光度的評價,4 組和6組小球藻的生長狀況較好。
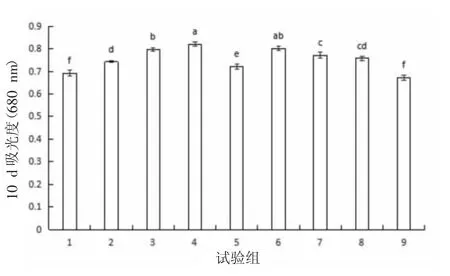
圖1 植物激素與動物蛋白酶解物的不同組合對小球藻比生長速率的影響
2)對小球藻比生長速率的影響。植物激素與動物蛋白酶解物的不同組合對小球藻比生長速率的影響如圖2所示,在試驗周期內(nèi),小球藻培養(yǎng)基中添加相應(yīng)的不同植物激素和蛋白酶解物,小球藻比生長速率的變化范圍為0.153~0.173/d。各組之間小球藻比生長速率差異顯著(P<0.05)。4 組(NAA 0.5 mg/L、IAA 3.5 mg/L、蛋白酶解物0.35 mg/L)和6 組(NAA 2.0 mg/L、IAA 2.0 mg/L、蛋白酶解物0.35 mg/L)小球藻的比生長速率較高,分別為0.173/d 和0.171/d,且2 組之間小球藻比生長速率無顯著性差異(P>0.05)。9 組(NAA 0.5 mg/L、IAA 0.5 mg/L、蛋白酶解物0.05 mg/L)小球藻的比生長速率較低,為0.153/d,9 組比4 組降低了11.56%。基于小球藻比生長速率的評價,4 組和6 組小球藻的生長速率較快。
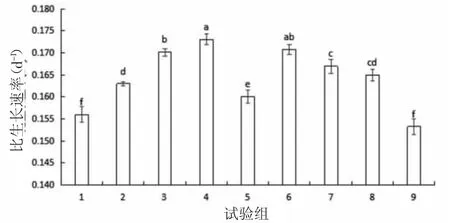
圖2 植物激素與動物蛋白酶解物的不同組合對小球藻生長的影響
2.2 植物激素與蛋白酶解物對小球藻生化指標(biāo)影響的正交分析
1)植物激素與蛋白酶解物對小球藻總蛋白濃度的正交分析。由表4正交分析結(jié)果可知,3 因素對小球藻總蛋白濃度的影響有顯著性差異(P<0.05)。3個因素的極差表現(xiàn)為蛋白酶解物>IAA>NAA,說明3 種因素對小球藻總蛋白濃度的影響大小依次為蛋白酶解物>IAA>NAA。從各因素不同水平間的差異來看,不同NAA 濃度下總蛋白濃度的大小為A3(3.5 mg/L)>A2(2.0 mg/L)>A1(0.5 mg/L);不同IAA濃度下總蛋白濃度的大小為B3(3.5 mg/L)>B2(2.0 mg/L)>B1(0.5 mg/L);不同蛋白酶解物下總蛋白濃度的大小為C3(0.35 mL/L)>C2(0.20 mL/L)>C1(0.05 mL/L)。說明各因素的水平差異會對小球藻總蛋白濃度造成影響。
從各處理間的比較來看,小球藻總蛋白濃度較高的為8 組(A3B3C2)和4 組(A1B3C3),分別為147.33±3.59 μg/mL 和143.11±4.78 μg/mL,小球藻總蛋白濃度最低的為9 組(A1B1C1),為110.97±4.70 μg/mL。9 組比8 組和4 組分別降低了24.70%、22.46%。說明各因素不同水平的不同組合對小球藻總蛋白濃度有較大影響。從各因素的最優(yōu)水平來看,小球藻總蛋白濃度的最優(yōu)組合為A3B3C3,即NAA 濃度為3.5 mg/L、IAA 濃度為3.5 mg/L、蛋白酶解物0.35 mL/L。
2)植物激素與蛋白酶解物對小球藻總SOD 活力的正交分析。由表5正交分析結(jié)果可知,3 因素對小球藻總SOD 活力的影響有顯著性差異(P<0.05)。3個因素的極差表現(xiàn)為蛋白酶解物>IAA>NAA,說明3 種因素對小球藻總SOD 活力的影響大小依次為蛋白酶解物>IAA>NAA。從各因素不同水平間的差異來看,不同NAA 濃度下總SOD 活力的大小為A3(3.5 mg/L)>A2(2.0 mg/L)>A1(0.5 mg/L);不同IAA 濃度下總SOD 活力的大小為B3(3.5 mg/L)>B1(0.5 mg/L)>B2(2.0 mg/L);不同蛋白酶解物下總SOD 活力的大小為C3(0.35 mL/L)>C2(0.20 mL/L)>C1(0.05 mL/L)。說明各因素的水平差異會對小球藻總SOD 活力造成影響。
從各處理間的比較來看,小球藻總SOD 活力較高的為4 組(A1B3C3)和8 組(A3B3C2),分別為86.75±3.14 U/mg 和86.53±2.28 U/mg,小球藻總SOD 活力最低的為9 組(A1B1C1),為63.66±1.83 U/mg。9 組比4 組和8 組分別降低了26.62%和26.43%。說明各因素不同水平的不同組合對小球藻總SOD 活力有較大影響。從各因素的最優(yōu)水平來看,小球藻總SOD 活力的最優(yōu)組合為A3B3C3,即NAA 濃度為3.5 mg/L、IAA 濃度為3.5 mg/L、蛋白酶解物0.35 mL/L。
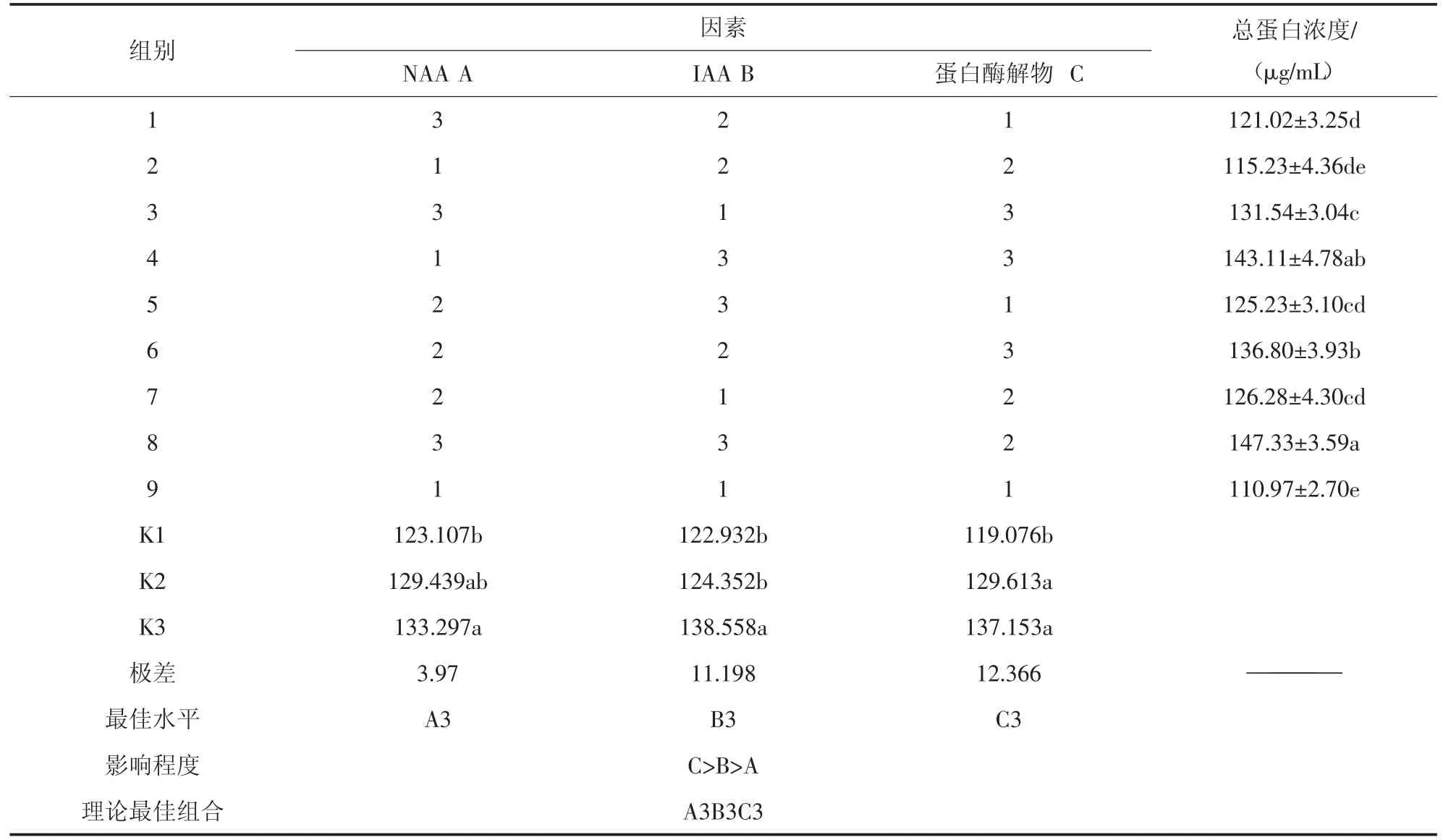
表4 小球藻總蛋白濃度正交試驗結(jié)果
3)植物激素與蛋白酶解物對小球藻CAT 活力的正交分析。由表6正交分析結(jié)果可知,3 因素對小球藻CAT 活力的影響有顯著性差異(P<0.05)。3 個因素的極差表現(xiàn)為蛋白酶解物>IAA>NAA,說明3 種因素對小球藻CAT 活力的影響濃度下CAT 活力的大小為A3(3.5 mg/L)>A2(2.0 mg/L)>A1(0.5 mg/L);不同IAA 濃度下CAT 活力的大小為B3(3.5 mg/L)>B2(2.0 mg/L)>B1(0.5 mg/L);不同蛋白酶解物下CAT 活力的大小為C3(0.35 mL/L)>C2(0.20 mL/L)>C1(0.05 mL/L)。說明各因素的水平差異會對小球藻CAT 活力造成影響。
從各處理間的比較來看,小球藻CAT 活力較高的為8 組(A3B3C2)和4 組(A1B3C3),分別為5.86±0.07 U/mg 和5.25 ±0.10 U/mg,小球藻CAT 活力最低的為9 組(A1B1C1),為3.32±0.08 U/mg。9 組比8組和4 組分別降低了43.34%、36.76%,說明各因素不同水平的不同組合對小球藻CAT 活力有較大影響。從各因素的最優(yōu)水平來看,小球藻CAT 活力的最優(yōu)組合為A3B3C3,即NAA 濃度為3.5 mg/L、IAA濃度為3.5 mg/L、蛋白酶解物0.35 mL/L。
4)植物激素與蛋白酶解物對小球藻MDA 含量的正交分析。由表7正交分析結(jié)果可知,3 因素對小球藻MDA 含量的影響有顯著性差異(P<0.05)。3 個因素的極差表現(xiàn)為蛋白酶解物>IAA>NAA,說明3種因素對小球藻MDA 含量的影響大小依次為蛋白酶解物>IAA>NAA。從各因素不同水平間的差異來看,不同NAA 濃度下MDA 含量的大小為A3(3.5 mg/L)>A2(2.0 mg/L)>A1(0.5 mg/L);不同IAA 濃度下MDA 含量的大小為B3(3.5 mg/L)>B2(2.0 mg/L)>B1(0.5 mg/L);不同蛋白酶解物下MDA 含量的大小為C3(0.35 mL/L)>C2(0.20 mL/L)>C1(0.05 mL/L)。說明各因素的水平差異會對小球藻MDA 含量造成影響。
從各處理間的比較來看,小球藻MDA 含量較低的為4 組(A1B3C3)和8 組(A3B3C2),分別為0.69±0.04 nmol/mg 和0.74±0.03 nmol/mg,小球藻MDA 含量最高的為9 組(A1B1C1),為1.07±0.07 nmol/mg。9 組比4 組和8 組分別升高了35.51%和30.84%,說明各因素不同水平的不同組合對小球藻MDA 含量有較大影響。從各因素的最優(yōu)水平來看,小球藻MDA 含量的最優(yōu)組合為A3B3C3,即NAA濃度為3.5 mg/L、IAA 濃度為3.5 mg/L、蛋白酶解物0.35 mL/L。
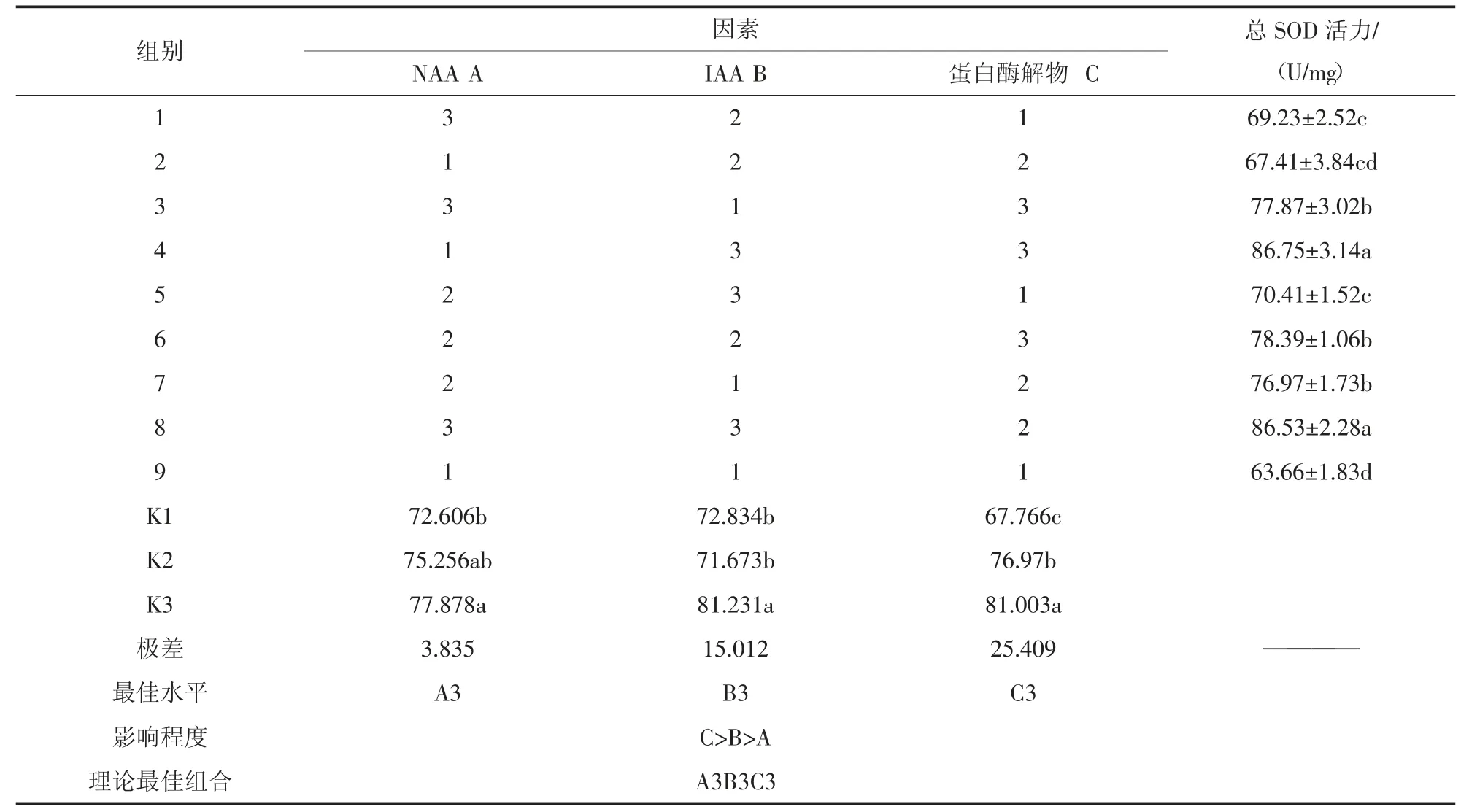
表5 小球藻總SOD 活力正交試驗結(jié)果
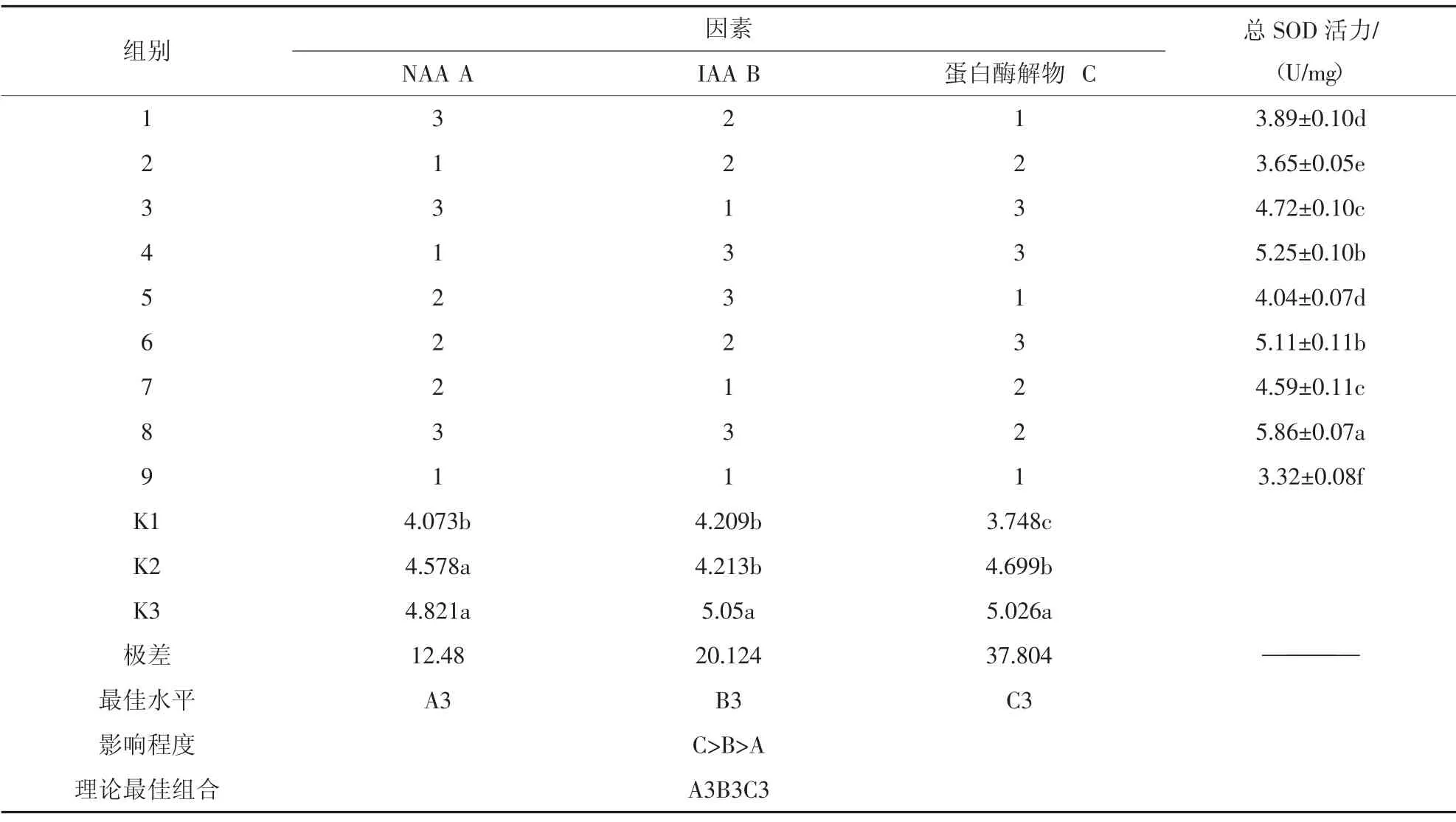
表6 小球藻總CAT 活力正交試驗結(jié)果
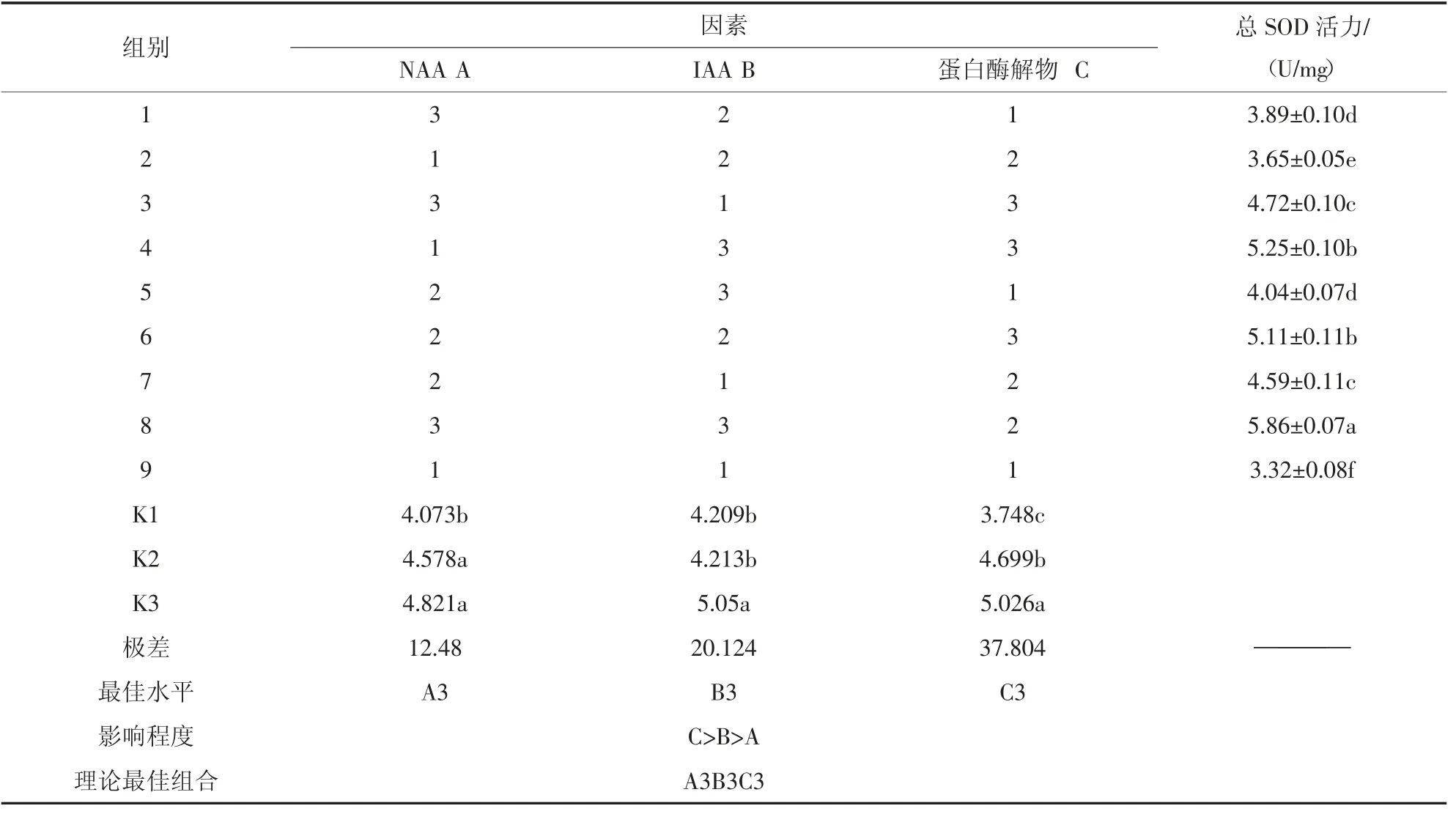
表7 小球藻MDA 含量正交試驗結(jié)果
3 討 論
3.1 植物激素、蛋白酶解物對小球藻生長的影響
植物激素在促進(jìn)植物生長、提高生物量等方面作用顯著[10-11]。對植物體的生長發(fā)育有多方面的影響,是植物生存所必需的內(nèi)生激素,至今還未發(fā)現(xiàn)有離開生長素而獨立存在的突變體[12]。天然提取激素吲哚-3-乙酸(IAA)和人工合成類似激素1-萘乙酸(NAA)在農(nóng)業(yè)生產(chǎn)中是較為成熟的2 種植物激素[13]。有研究表明,生長素在微藻中的作用與植物相似,在藻類培養(yǎng)基中添加適量濃度的IAA 不僅促進(jìn)部分單細(xì)胞藻類的生長,還對促進(jìn)細(xì)胞分裂,提高藻類生物量有顯著影響[14-16]。此外,也有利用人工合成類似物NAA 來誘導(dǎo)藻類產(chǎn)生更多生長素從而促進(jìn)其生長[17]。動物蛋白酶解物主要是一些小分子肽,飼料中添加一些小分子肽有助于礦物質(zhì)的利用率,促進(jìn)體內(nèi)蛋白質(zhì)的合成[18]。葉林超[19]研究氮、磷源與蛋白酶解物的營養(yǎng)組合對小球藻增殖機(jī)理和縊蟶生長影響,表明添加N 50 mg/L、P 4 mg/L、蛋白酶解物12 mL/L 能顯著促進(jìn)小球藻的生長。羅川等[3]研究表明1~2 mg/L 的IAA 和0.05~2 mg/L 的NAA表現(xiàn)為促進(jìn)小球藻生長,而高濃度(5 mg/L)表現(xiàn)為抑制生長。試驗結(jié)果表明,4 組(NAA 0.5 mg/L、IAA 3.5 mg/L、蛋白酶解物0.35 mL/L) 和6 組(NAA 2.0 mg/L、IAA 2.0 mg/L、蛋白酶解物0.35 mL/L)小球藻的生長狀況及生長速率較快,與葉林超[19]和羅川等[3]的研究結(jié)果相似。
3.2 植物激素、蛋白酶解物對小球藻生化指標(biāo)的影響
小球藻所含粗蛋白含量可達(dá)50%以上,必需氨基酸比例平衡,是作為蛋白質(zhì)補(bǔ)充飼料的理想選擇[20]。SOD、CAT 均為抗氧化酶,是機(jī)體清除活性氧保護(hù)細(xì)胞免受氧化損傷的重要屏障[21]。MDA 的高低間接反映了機(jī)體細(xì)胞免受自由基攻擊的嚴(yán)重程度。本試驗結(jié)果表明,小球藻培養(yǎng)基添加植物激素和蛋白酶解物對小球藻的生化指標(biāo)影響差異顯著(P<0.05)。4 組A1B3C3 和8 組A3B3C2 的酶活力較高且能降低MDA 的含量。
4 結(jié) 論
試驗表明,NAA、IAA 和蛋白酶解物存在一定的互作效應(yīng),能有效地提高小球藻的生長狀況和生長速率。基于小球藻的吸光度和比生長速率評價,4 組(NAA 0.5 mg/L、IAA 3.5 mg/L、蛋白酶解物0.35 mL/L)和6 組(NAA 2.0 mg/L、IAA 2.0 mg/L、蛋白酶解物0.35 mL/L)小球藻的生長狀況和生長速率優(yōu)于其他7 組。
正交試驗結(jié)果表明,3 因素對小球藻生化指標(biāo)的影響有顯著性差異(P<0.05),對小球藻生化指標(biāo)的影響大小均為蛋白酶解物>IAA>NAA。從各處理間的比較來看,小球藻較高的酶活力和較低的MDA含量均為8 組A3B3C2 和4 組A1B3C3,9 組A1B1C1 酶活力較低且MDA 含量較高。從各因素的最優(yōu)水平來看,小球藻生化指標(biāo)的最優(yōu)組合為A3B3C3,即NAA 濃度為3.5 mg/L、IAA 濃度為3.5 mg/L、蛋白酶解物0.35 mL/L。在實際生產(chǎn)中,為了促進(jìn)小球藻的生長和營養(yǎng)物質(zhì)的積累,要考慮最優(yōu)的組合及適宜濃度的添加量。由于本試驗設(shè)計的植物激素和蛋白酶解物的添加量梯度較小,對于植物激素和蛋白酶解物對小球藻生長的最優(yōu)化還有待進(jìn)一步研究。

