內鏡黏膜下剝離術治療盲腸側向發育型腫瘤的療效分析
孫 穎,張經文,宮愛霞
(大連醫科大學附屬第一醫院 消化內鏡科,遼寧 大連 116011)
盲腸側向發育型腫瘤(laterally spreading tumors, LSTs)為直徑10 mm以上的、呈側向擴展而非垂直生長的一類表淺型病變[1]。LSTs與結腸癌的發生密切相關,因此LSTs的早期治療尤為重要。由于盲腸特殊結構及LSTs的特殊形態,傳統的EMR(endoscopic mucosal resection)即內鏡下黏膜剝離切除術,難以完整的一次性切除病變,且病變的殘留和復發率較高。本研究擬探討內鏡黏膜下剝離術(endoscopic submucosal dissection,ESD)對于盲腸側向發育型腫瘤(LSTs)的臨床療效。
1 資料與方法
1.1 一般資料
收集大連醫科大學附屬第一醫院2016年12月至2019年12月應用ESD治療的41例盲腸側向發育型腫瘤患者(符合工藤進英1998年總結的LST病變定義[1])的臨床資料,其中男性17例,女性24例,平均年齡(63.9±11)歲。術前腸鏡檢查明確病變范圍,除外JNET分型為3型[2]病例,行腹部CT檢查除外遠處淋巴結轉移,其他排除標準:(1)合并嚴重心肺等器質性疾病而無法耐受手術者;(2)合并嚴重凝血功能障礙者;(3)抬舉征陰性者。所有患者均于術前簽署特殊治療同意書,并明確術中及術后可能出現的風險及并發癥。
1.2 手術操作
采用的內鏡為CF-Q260J(日本Olympus公司),相關附件有注射針、Dual刀、IT刀、熱活檢鉗、透明帽等(均是日本Olympus公司產品)。電切設備為ERBE高頻電刀VIO200D (德國ERBE公司)。附沖水裝置及CO2氣泵。黏膜下注射液為玻璃酸鈉、美藍、注射用血凝酶、生理鹽水混合液。清潔腸道準備,完善心電圖、血常規、凝血功能、CT等檢查。對于服用抗凝藥物的患者,需專科醫師評估風險,并酌情停藥。首先明確病變邊界,對于邊界不清的病變表面噴灑靛胭脂染色或可用窄帶成像技術(narrow band imaging, NBI)確定病變范圍,便于進行下一步操作。于病變邊界處行黏膜下注射,至病變充分隆起,用dual刀于距病變0.5 cm處切開至黏膜下層,并逐漸剝離至病變黏膜完全脫落(ESD)。手術過程中對所見血管及出血應用熱活檢鉗電凝止血,病變剝離后熱活檢鉗處理創面預防術后出血。對于術中可見穿孔應用鈦夾夾閉,若創面電凝較重可考慮完全夾閉創面,以預防遲發性穿孔。切除標本展開固定,測量大小,福爾馬林浸泡后送病理檢查。
1.3 術后處理及隨訪
手術當日禁食水,并適當應用止血藥物及抗生素。密切觀察患者胸腹部體征。術后3、6、12個月進行內鏡復查,若無復發,此后每年復查1次腸鏡。
1.4 觀察指標
對患者的性別、年齡、病變直徑、JNET分型、病理結果、完整切除率、完全切除率、術后遲發性出血、術后遲發性穿孔等指標進行統計分析。完整切除率指病灶被整塊切除并且水平及垂直切緣均未見腺瘤或者腫瘤組織殘留的比例。完全切除率指病灶被一次性整塊切除的比例。
1.5 統計學方法
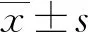
2 結 果
2.1 內鏡治療結果
41例患者病變平均直徑(1.91±0.83)cm,完整切除率100%,完全切除率95.1%(39/41),2例未完全切除的病例均為病理回報剝離病變邊緣受累,向家屬交代病情后均選擇隨診觀察,至今未復發。術中發生穿孔3例(7.3%),予金屬夾成功夾閉,穿孔和未穿孔患者在年齡、病灶大小上比較無明顯差異(P>0.05);術中急性出血2例(4.8%),予熱活檢鉗成功止血,出血和未出血患者在年齡、病灶大小上比較,無明顯差異(P>0.05);術后未見遲發性出血、穿孔發生。術后平均隨訪13.6個月,無復發。
2.2 術后病理結果
術后病理結果Type 1型中,77.8%(7/9)病灶被診斷為鋸齒狀腺瘤,22.2%(2/9)病灶被診斷為增生性息肉。Type 2A 型中,71.4%(20/28)病灶被診斷為低級別上皮內瘤變,28.6%(8/28)病灶被診斷為高級別上皮內瘤變。Type 2B 型中,100%(4/4)病理為高級別上皮內瘤變。見表1。
3 討 論
隨著消化內鏡技術的發展,ESD可一次性完整剝離病變組織,降低病變局部殘留率和復發率,且術后能獲得完整的組織標本,成為治療結腸側向發育型腫瘤治療的重要手段[3]。徐美東等[4]采用ESD 治療早期結直腸腫瘤的整塊切除率為88.0%~98.3%,完全切除率為89.0%~92.0%。本研究與上述報道基本一致。
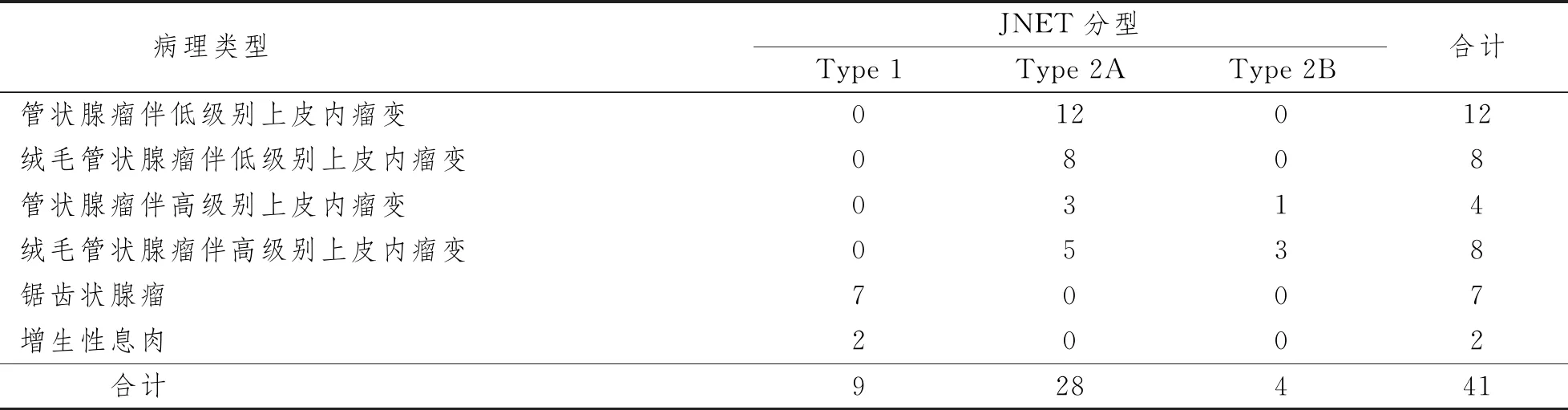
表1 JNET 分型內鏡下診斷與病理診斷的結果
通常ESD術后要依據術后病理判斷手術療效,當垂直切緣陽性時,需追加外科手術。因此術前判斷病變浸潤深度、范圍以及有無淋巴結轉移是治療的關鍵。目前判斷病變范圍主要借助于美蘭噴灑和電子染色內鏡,浸潤深度主要依據病變形態、NBI下腺管開口分型、超聲內鏡等,但以上指標受操作者水平影響。有研究表明非顆粒型中偽凹陷型LSTs和顆粒型中的混合結節型更易發生深層次浸潤,但顆粒型和非顆粒型LSTs之間無統計學意義[5]。工藤分型中V型開口有助于判斷浸潤深度,重度不規則Va型和Vn型癌浸潤深度超過1 000 μm[6],不適合進行ESD治療。超聲內鏡有助于判斷病變浸潤層次,但超聲顯示的浸潤層次往往更深于病變實際的浸潤層次,其敏感性為90%,特異性僅為14.3%[7]。目前沒有一種檢查方法能夠準確判斷出淋巴結轉移,僅能通過增強CT和MRI來判斷結直腸癌有無遠處轉移。本研究術前檢查行腹部CT除外遠處轉移,通過JNET分型除外JNET 3型[8],即黏膜下深層浸潤病例,術中應用美蘭確定病變范圍,所得結果與上述報道基本一致。
ESD的最嚴重并發癥是遲發性出血,通常因為發現較晚,治療不能及時進行,大量積血影響內鏡下處理,嚴重者可發生失血性休克。國內外研究報道其發生率為1.4%~9.6%[9],大多數遲發性出血在ESD術后5天內[10]。有報道稱回盲部較結腸其他部位更易發生遲發性出血[11],與盲腸腸壁較薄有關,進行ESD切除過程中更易受到電凝損傷,傷及黏膜下層的脈管系統;Buddingh等[11]研究發現未被完全再吸收或滅活的膽汁和消化酶進入盲腸后,能夠破壞創面,引起遲發性出血;亦有報道稱ESD術后遲發性出血與病灶浸潤深度有關[12]。本研究中41例病變均未發生遲發性出血,可能與病變均局限于黏膜內以及術前控制患者血壓、停用抗凝藥物有關,但遲發性出血與多種因素有關,需進一步統計分析。
ESD的另一個并發癥是穿孔。因回盲部腸壁較薄,剝離過程中更易發生穿孔。國內有文獻報道ESD治療LST的穿孔發生率約2.9%~14.5%,本組穿孔率為7.3%,符合國內文獻報道。本研究中出現的3例穿孔均發生在ESD治療開展的早期,與患者的年齡、病變大小無統計學差異(P>0.05),隨著ESD技術的提高穿孔也未再發生。另外,于黏膜下注射足夠厚的水墊,充分暴露黏膜下層,也有助于預防穿孔的發生。隨著內鏡下縫合技術的進步,較小的穿孔均可以選擇鈦夾夾閉,較大穿孔可以應用尼龍繩聯合鈦夾進行荷包縫合。本研究中3例穿孔均為術中發生,且較小,予鈦夾夾閉后,預后良好。
ESD需要操作者有豐富的經驗,嚴格掌握適應證、進行有效的術前評估,術中采取積極的方法降低并發癥的發生,以改善患者預后。總之,ESD是治療盲腸側向發育型腫瘤一種安全可行的方法。

