二甲雙胍對去卵巢大鼠骨質疏松癥的影響及機制研究
蘇姍 楊蕓瑞 李紅利 王麗婷 甄東戶*
1.蘭州大學第一臨床醫學院,甘肅 蘭州 730000 2.蘭州大學第一醫院內分泌科,甘肅 蘭州 730000
二甲雙胍(metformin, MF)被廣泛應用于2型糖尿病、代謝綜合征、非酒精性脂肪肝病等以胰島素抵抗為主的疾病的治療[1]。隨著對MF進一步深入研究,研究者發現MF除具有降糖作用外,還可促進骨髓間充質干細胞(bone marrow mesenchymal stem cells,BMSCs)向成骨細胞分化,增加成骨細胞數目,促進骨形成,此外MF通過激活鈣調蛋白激酶和轉化生長因子活化激酶,抑制RANKL的表達以及破骨細胞的分化,從而發揮骨保護作用[2-3]。但其作用機制錯綜復雜,目前MF對骨代謝影響的具體機制仍未完全明確。因此本研究以去卵巢大鼠模擬骨質疏松癥,以雌二醇為對照,觀察MF對去卵巢大鼠骨密度及骨礦含量的影響,并從細胞和分子水平探討MF可能的骨保護機制,為臨床上預防和治療骨質疏松癥提供新思路。
1 材料與方法
1.1 實驗動物
3月齡SPF級雌性健康SD大鼠60只,體重200~300 g,適應性喂養1周。
1.2 方法
1.2.1去卵巢大鼠模型的建立及骨密度和骨礦含量的測定:60只3月齡雌性健康SD大鼠被隨機均分4組:假手術(SHAM)組、去卵巢(OVX)組、去卵巢+二甲雙胍(OVX+MF)組和去卵巢+雌二醇(OVX+E2)組。OVX組、OVX+MF組和OVX+E2組行雙側卵巢摘除建立骨質疏松模型,SHAM組僅切除雙側卵巢旁等量脂肪。術后1周起OVX+MF組按100 mg/(kg·d)灌胃MF,OVX+E2組按0.1 mg/(kg·d)灌胃17-β雌二醇,其它各組灌胃等量蒸餾水,按體重變化調整藥量,連續給藥60 d后通過引頸法處死大鼠。分離各組大鼠脛骨,用雙能X線骨密度儀(DEXA,prodigy型,美國GE LUNAR公司)測定右側脛骨骨密度和骨礦含量。
1.2.2大鼠BMSCs的分離、培養:無菌條件下分離4組大鼠雙側股骨和脛骨,在含有抗生素的α-MEM溶液中浸泡10 min后沖洗骨髓腔,800 r/min離心細胞懸液,5 min后用普通培養液重新接種。接種后第3天,用PBS(pH 7.2~7.4)緩慢沖洗掉未貼壁的細胞,培養基每周更換2次,細胞基本鋪滿瓶底時,用0.25 %胰酶消化,以1∶2進行傳代培養。選取生長較好的第3、4代細胞行后續實驗。
1.2.3誘導各組大鼠BMSCs向成骨細胞分化:各組大鼠傳代細胞以5.0×104個/孔密度接種于24孔板,用基礎成骨誘導培養基培養15~21 d后,收集細胞行下一步實驗。
1.2.4細胞增殖功能測定和細胞熒光染色:將各組細胞以1.0×104個/孔密度接種在96孔板,成骨誘導液培養6 d后,用MTT法測定細胞活性及增殖能力;培養結束后用PBS沖洗細胞,室溫下用鈣黃綠色素AM熒光探針培養細胞10 min。
1.2.5堿性磷酸酶活性測定:將各組細胞以5×105個/孔密度接種于6孔板,成骨誘導液培養7 d,用PBS清洗細胞層,溶解于0.5 mL的0.1 % Triton X-100中,使用Bradford法測定細胞提取物蛋白含量。
1.2.6礦化結節形成和鈣含量的測定:將各組細胞以5×105個/孔密度接種于6孔板,培養28 d后,PBS洗兩次并用95 %乙醇原位固定,1 %茜素紅染色,鏡下計數鈣化結節數目。鈣含量測定方法參照文獻[4]。
1.2.7RNA提取以及Real-time PCR測定:將各組細胞以5×105個/孔密度接種于6孔板,成骨誘導液培養21 d后,熒光定量實時PCR測定成骨細胞表面基因: collagen type I、OC、OPG、RANKL、IL-6, GAPDH 作為看家基因(引物序列見表1)。反應結束后用雙CT法進行PCR相對定量計算。
1.3 統計分析
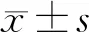
2 結果
2.1 二甲雙胍對去卵巢大鼠骨密度和骨礦含量的影響
與SHAM組比較,OVX組的骨密度和骨礦含量顯著降低,OVX+MF組與OVX+E2組的骨礦含量低于SHAM組(P均<0.05),而骨密度與SHAM組無顯著差異(P>0.05);OVX+MF組與OVX+E2組的骨密度和骨礦含量均顯著高于OVX組,且OVX+E2組高于OVX+MF組(P<0.05)。見圖1。

表1 引物序列Table 1 Primers Sequence
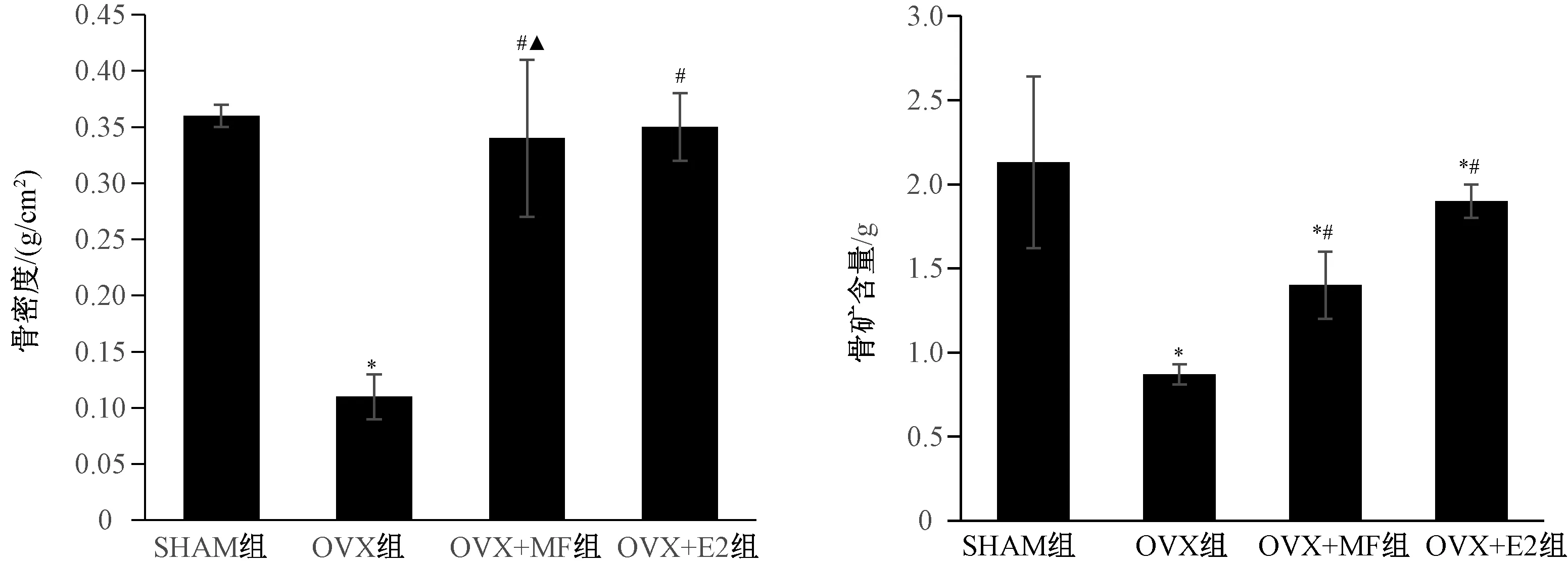
圖1 各組大鼠骨密度和骨礦含量注:與SHAM組比較,*P<0.05;與OVX組比較,#P<0.05;與OVX+E2組比較,▲P<0.05。Fig.1 Bone mineral density and bone mineral content of rats in each group
2.2 大鼠BMSCs誘導分化為成骨細胞的形態學觀察
倒置相差顯微鏡下,大鼠BMSCs經差速貼壁后于2~3 h內貼附于培養瓶底(圖2 A),接種3 d后細胞呈現不同形態并向外伸展出生長突,部分細胞借突起相互連接(圖2B);隨后生長突相互連接融合成片(圖2C),成骨細胞持續重疊生長,10~12 d后出現散在的致密團塊,中央區域逐漸變暗,透光不佳,最終形成結節(圖2D)。
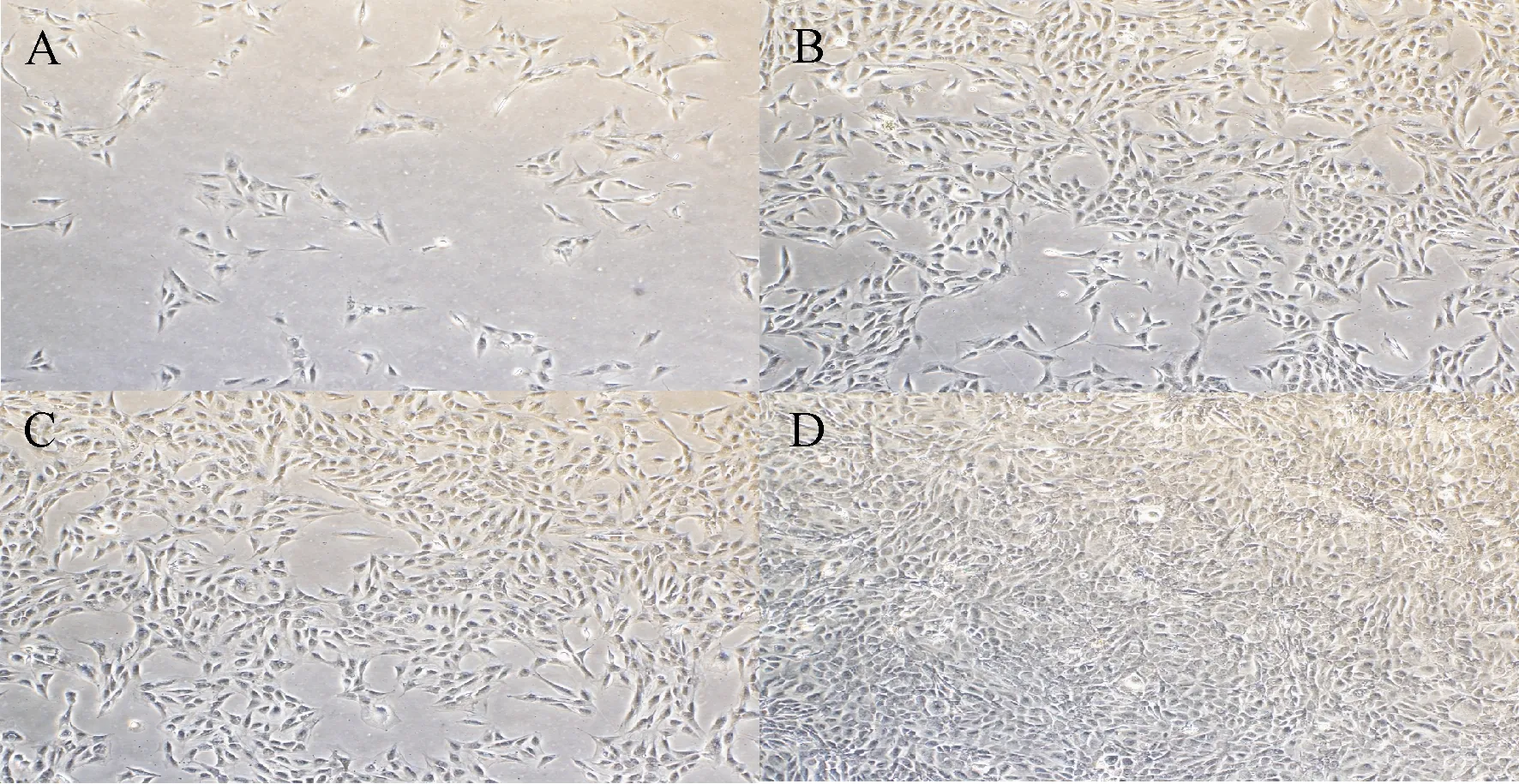
圖2 大鼠BMSCs誘導分化為成骨細胞的形態(×100) A:細胞培養后1 d;B:細胞接種后3 d;C:細胞接種后5 d;D:細胞接種后12 d。Fig.2 Morphological differentiation of rat BMSCs into osteoblasts (×100) A:1 day after cell culture; B:3 days after cell inoculation; C:5 days after cell inoculation; D:12 days after cell inoculation.
2.3 大鼠BMSCs在誘導培養基中的生長曲線
接種后1~3 d內,傳代大鼠BMSCs細胞增殖緩慢,隨后細胞增殖速度逐漸增快,第6天達到頂峰,此后逐漸減慢(圖3)。
圖3 大鼠BMSCs的生長曲線Fig.3 The growth curve of rats BMSCs
2.4 大鼠BMSCs誘導分化為成骨細胞后礦化結節的形成
在礦化誘導液的培養下,大鼠BMSCs分化為成骨細胞并呈重疊生長,逐漸形成大小不一的結節,隨著膠原沉積和基質礦化,最終形成密度不均透光性差的礦化結節(圖4)。
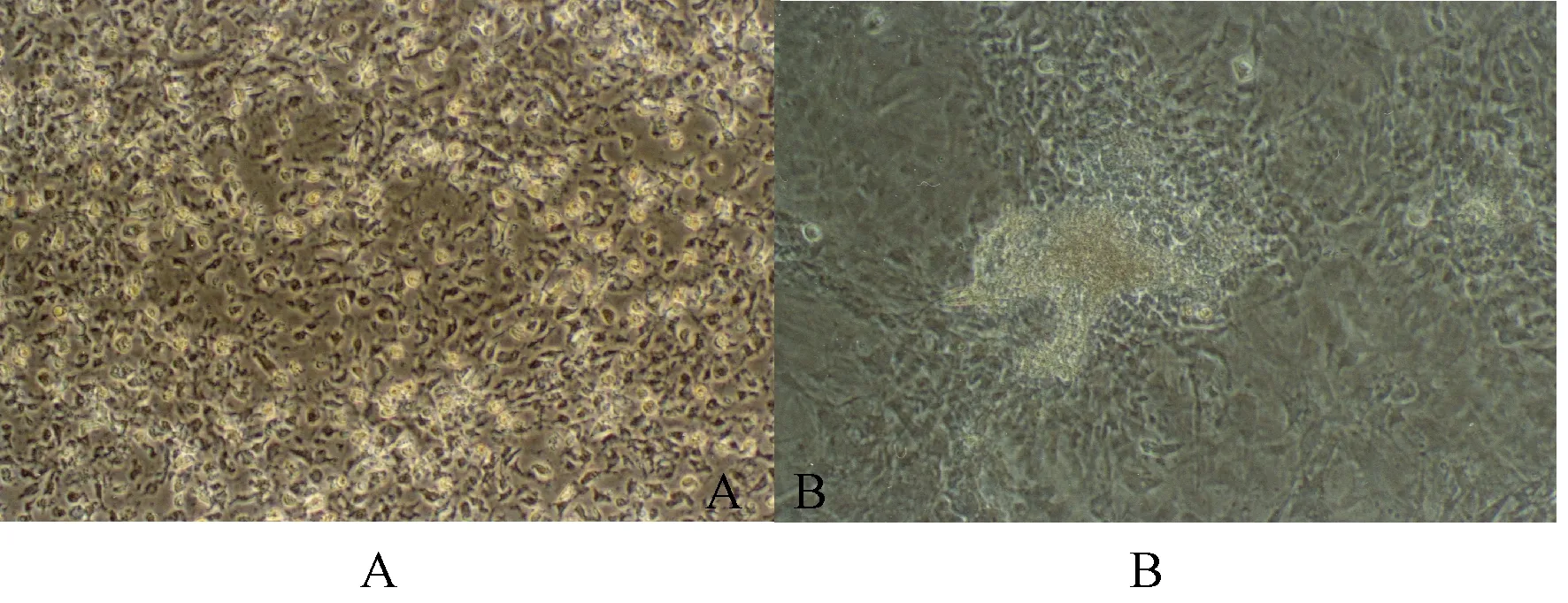
圖4 礦化結節形成的鑒定 A:骨細胞鈣化中(誘導后14 d);B:骨細胞鈣化形成(誘導后28 d)。Fig.4 Identification of mineralized nodule formation A: osteoblasts are calcifying (14 days after induction); B: osteocyte calcification is formed (28 days after induction).
2.5 各組大鼠BMSCs分化為成骨細胞后細胞增殖能力、ALP活性與鈣沉積量的變化
與SHAM組比較,OVX組成骨細胞增殖能力、ALP活性明顯被抑制,鈣沉積量明顯減少(P<0.05);與OVX組比較,在給予MF和雌二醇干預后顯著增強了大鼠成骨細胞增殖能力和ALP活性,鈣沉積量顯著增加(P<0.05);且OVX+E2組成骨細胞增殖能力、ALP活性、鈣沉積量高于OVX+MF組(P<0.05)。見圖5。
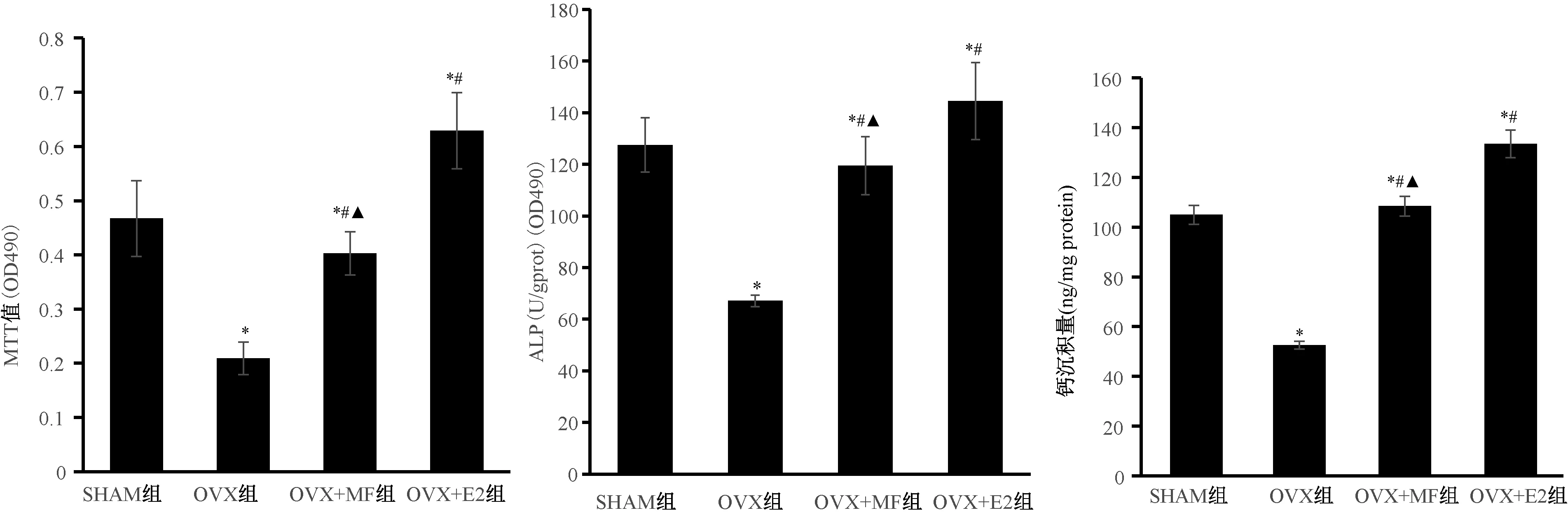
圖5 大鼠成骨細胞的增殖能力、ALP活性及鈣沉積量的變化注:與SHAM組比較,*P<0.05;與OVX組比較,#P<0.05;與OVX+E2組比較,▲P<0.05。Fig.5 Changes in cell proliferation, ALP activity and calcium deposition in osteoblasts of rats
2.6 各組大鼠BMSCs的形態變化
細胞培養3 d后各組均呈現出成骨細胞的典型形態:多邊形、三角形和梭形(綠色細胞)。在圖6B(OVX組)中可看到明顯增多的呈現紅色熒光的死亡細胞,而在圖6 A(SHAM組)中幾乎看不到死亡細胞;與圖6B(OVX組)比較,圖6C(OVX+E2組)與圖6D (OVX+MF組)中死亡細胞數目減少,細胞呈現融合趨勢。
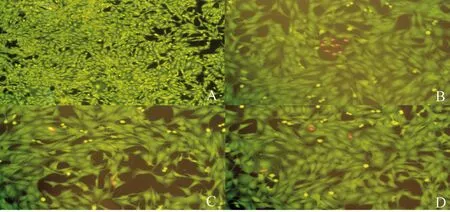
圖6 熒光染色大鼠的BMSCs A:SHAM組;B:OVX組;C:OVX+E2組;D:OVX+MF組。Fig.6 Fluorescent staining of BMSCs A: SHAM group; B: OVX group; C: OVX+E2 group; D: OVX+MF group.
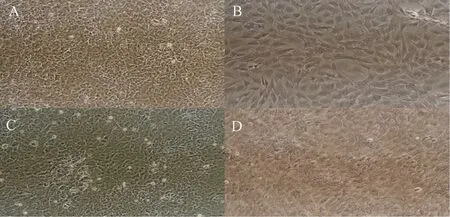
圖7 鏡下成骨細胞礦化結節的形成 A:SHAM組;B:OVX組;C:OVX+E2組;D:OVX+MF組。Fig.7 The formation of mineralized osteoblasts nodules under the microscope A: SHAM group; B: OVX group; C: OVX+E2 group; D: OVX+MF group.
2.7 各組大鼠成骨細胞礦化結節的形成
在礦化誘導液培養21 d后,鏡下觀察,圖7 A(SHAM組)成骨細胞多層重疊生長并隨著膠原和鈣鹽沉積,形成數量較多的礦化結節;而在圖7B(OVX組)成骨細胞鈣化明顯受到抑制,細胞沒有顯著融合,未見顯著的礦化結節;但在圖7C(OVX+E2組)與圖7D(OVX+MF組)中,成骨細胞重疊生長逐漸形成礦化結節,結節數量較多,周圍有較多鈣鹽沉積。
2.8 各組大鼠成骨細胞的基因表達變化
與SHAM組比較,OVX組中collagen type I、OC、OPG mRNA表達水平顯著降低,RANKL、IL-6 mRNA表達顯著增強,而OVX+MF組collagen type I、OC、OPG、RANKL、IL-6mRNA的表達水平均高于SHAM組(P<0.05);與OVX組相比,OVX+E2組、OVX+MF組明顯增加了collagen type I、OC、OPG mRNA的表達水平,并抑制了RANKL,IL-6mRNA的表達(P<0.05);與OVX+E2組比較,OVX+MF組collagen type I、OC、OPG mRNA表達水平低于OVX+E2組,且RANKL、IL-6mRNA的表達高于OVX+E2組(P<0.05)。見圖8。
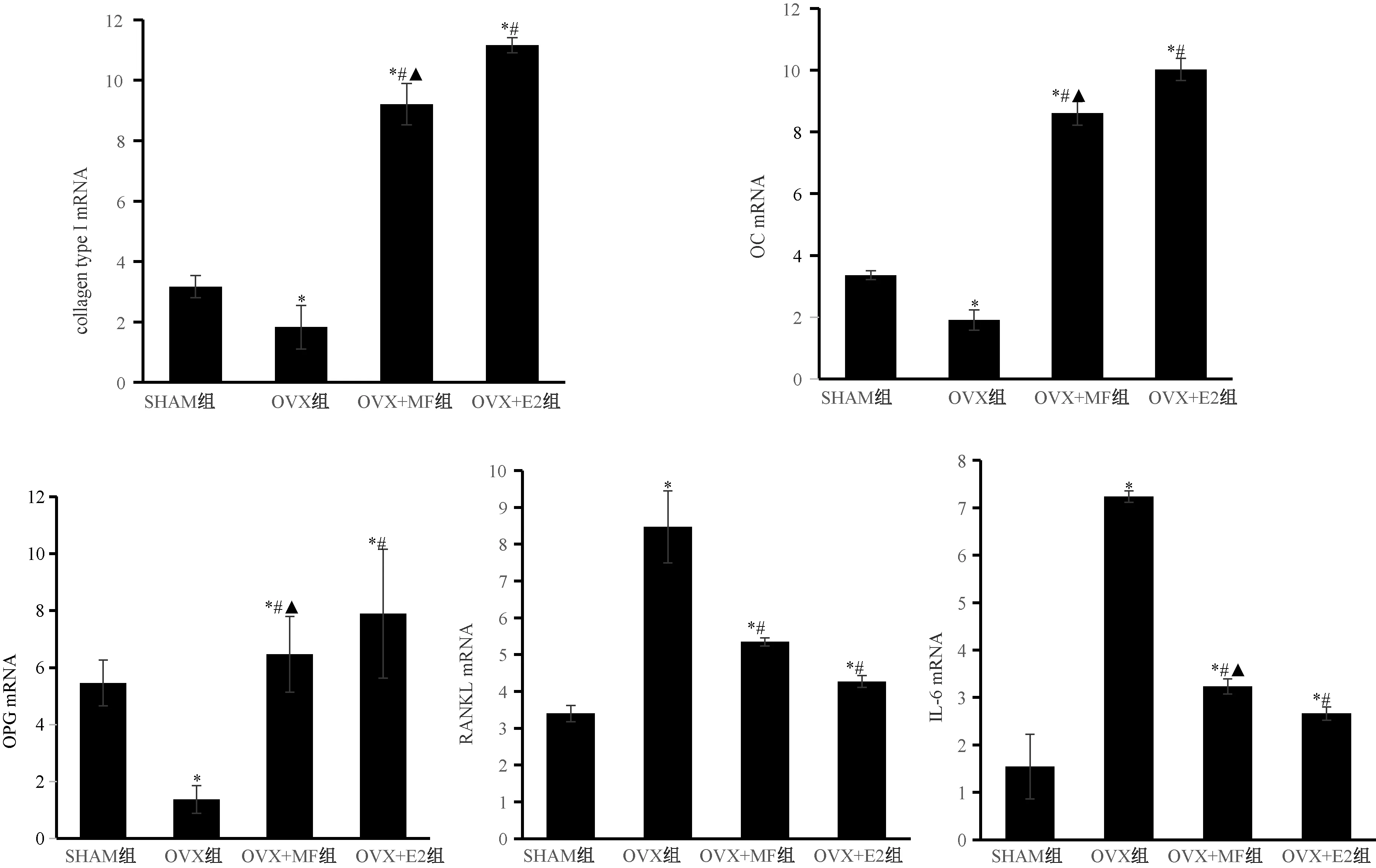
圖8 各組大鼠成骨細胞的基因表達注:與SHAM組比較,*P<0.05;與OVX組比較,#P<0.05;與OVX+E2組比較,▲P<0.05。Fig.8 Gene expression of osteoblasts in each group
3 討論
MF是2型糖尿病患者的首選用藥,可通過多種機制影響骨代謝:一方面通過AMPK-mTORC2和AKT-mTORC1信號軸調節SIRT6和OCT4的表達,促進成骨前細胞的增殖和分化[5];另一方面通過AMPK/Runx2/Cbfa1通路誘使大鼠脛骨BMSCs向成骨細胞分化,刺激礦化結節的形成[6];此外還能減少晚期糖基化終末產物的產生,逆轉和改善高糖對成骨細胞功能的損傷[7]。臨床研究[8]發現MF可降低糖尿病患者骨折發生風險,本研究以去卵巢大鼠模擬骨質疏松癥,以雌二醇為對照進一步探究MF抗骨質疏松的作用機制。
OPG/RANKL/RANK通路是影響骨代謝最主要的途徑[9]。骨吸收因子刺激成骨細胞膜表達RANKL分子,后者與破骨細胞膜上的RANK結合后,誘導破骨細胞膜上腫瘤壞死因子受體相關因子與RANK的胞內區結合并激活下游多種細胞內信號傳導通路,上調促骨吸收因子的表達,促進破骨細胞分化成熟,增強骨吸收活性[10]。而由成骨細胞生成的OPG可競爭性與RANKL結合,阻止這些信號轉導途徑,負性調節破骨細胞的生成[11]。雌激素缺乏會使OPG/RANKL比例失調,破骨細胞活性增強,誘使發生骨質疏松[12]。本研究中,去卵巢大鼠BMSCs向成骨細胞的分化受到抑制,collagen type I、OC、OPG mRNA表達明顯受到抑制,而RANKL、IL-6 mRNA表達水平明顯增加,給予雌二醇干預后,去卵巢大鼠的collagen type I、OC、OPG mRNA表達顯著增強,而RANKL、IL-6mRNA表達明顯減弱,由此導致其骨密度以及骨礦含量也顯著增加,雌二醇顯著逆轉了去卵巢大鼠的骨質疏松;用MF干預去卵巢大鼠BMSCs后,collagen type I、OC、OPG mRNA表達顯著增強,RANKL、IL-6 mRNA表達明顯減弱,且MF對collagen type I、OC、OPG mRNA的表達表現出強于正常對照組的特性,提示MF通過OPG/RANKL/RANK通路增加成骨細胞活性,抑制破骨細胞分化,發揮骨保護作用,尤其在增強成骨細胞活性方面有優勢。體外培養SD大鼠的BMSCs并給予100 μmol/L MF孵育21 d后發現,BMSCs中促成骨基因表達增加而促成脂基因表達減少,且MF顯著促進礦化結節的沉積,阻斷胞質脂滴的形成,提示MF可誘使BMSCs成骨分化而抑制其脂向分化[13]。在本研究中亦發現MF可進一步誘導去卵巢大鼠BMSCs向成骨細胞分化,顯著增強ALP活性和成骨細胞的鈣化能力,并增加其骨密度和骨礦含量,雖然MF的作用弱于雌二醇,但仍能有效改善去卵巢大鼠骨質疏松的狀態。
本研究的不足之處在于未進行MF不同劑量的對比,不能排除劑量對研究結果的影響;此外,MF對骨代謝影響可能與動物的種系、年齡、體重以及體內激素水平和炎癥狀態等有關,因此仍需要大量的基礎和臨床研究進一步證實MF對骨代謝的影響。
總之,本研究結果表明,MF不僅增加了去卵巢大鼠的骨密度和骨礦物含量,增強了成骨細胞增殖和鈣化能力以及ALP活性,還可經由OPG/RANKL/RANK途徑誘導BMSCs向成骨細胞分化,阻礙破骨細胞的成熟。盡管MF的抗骨質疏松作用遜于雌二醇,但其在促進成骨細胞基因表達活性方面有優勢,MF潛在的骨保護作用可能會改善糖尿病所引起的骨質疏松癥。

