芍藥苷促進小鼠成骨分化抗骨質疏松作用的實驗研究
楊立宇 郭然 牟帥 張一奇 楊禮慶 付勤
中國醫科大學附屬盛京醫院骨科,遼寧 沈陽 110003
骨質疏松癥(osteoporosis,OP)作為影響廣大老齡患者尤其是絕經后人群的重要疾病之一,已經愈發得到現代醫學的關注。骨質疏松癥是以鈣含量減低、骨微結構遭到破壞、骨骼強度、韌性衰減為特點,最終導致骨骼質量下降,發生脆性骨折的全身骨代謝疾病[1-2]。目前臨床上抗骨質疏松治療主要以抗骨吸收藥物為代表,如雙膦酸鹽類、降鈣素類,這類藥物雖可顯著減緩骨密度下降的程度,但是用藥同時抑制骨形成活動,用藥后脆性骨折再發率仍較高,存在下頜骨壞死等弊端[3]。而現有的一些促進骨形成藥物亦存在著潛在的致癌風險[4]。相比之下,傳統中醫藥則具備溫和安全、雙向調控等優點,愈發引起現代醫學研究的關注。
芍藥苷(paeoniflorin,Pa)作為傳統中藥白芍總苷的主要成分之一,在中醫傳統處方中起著抗炎、利尿的作用[5]。目前研究發現芍藥苷除了以上功能作用之外,還具備抗氧化、免疫調節、抗腫瘤等作用[6-7]。在骨質疏松治療方面,有研究[8]表明芍藥苷可以抑制NF-κB信號通路來降低破骨細胞的分化功能、緩解類風濕關節炎患者骨丟失的癥狀[9-10]。但是芍藥苷對成骨分化的作用影響仍缺乏相關實驗研究,本研究的目的是探討芍藥苷對成骨細胞成骨分化的干預作用,并觀察其對骨質疏松小鼠模型的治療效果。
1 材料和方法
1.1 材料
1.1.1實驗動物:8周齡C57BL/6小鼠24只(北京華阜康生物科技公司,中國)。隨機將小鼠分為三組,假手術組(Sham組)、骨質疏松模型組(OVX組)、芍藥苷干預組(OVX+Pa組)。給予Sham組僅開腹后便縫合腹膜,而OVX與OVX+Pa組則行雙側卵巢摘除術。術后一周開始各組對應干預,OVX+Pa組每日進行芍藥苷(50 mg/kg)腹腔注射,而Sham組與OVX組則給予等體積鹽水注射,干預12周后取材。
1.1.2實驗細胞:采用小鼠成骨前體細胞系MC3T3-E1(來源于中國科學院上海研究院細胞庫)。
1.1.3實驗藥物:芍藥苷(Sigma-Aldrich,美國)。
1.1.4實驗試劑:α-MEM培養基、胰酶-EDTA、進口胎牛血清、PBS溶液(Biological Industries,以色列);OPG、RANKL抗體(萬類試劑,中國);Runx2抗體(Abcam,美國);β-actin抗體、堿性磷酸酶染色試劑盒、堿性磷酸酶測定試劑盒(碧云天,中國);免疫組化二抗(中杉金橋,中國);抗原修復液(博士德生物科技,中國);DAB染色試劑盒(邁新生物,中國);HE染色液、茜素紅染色液(索萊寶,中國)。EDTA脫鈣液、引物(上海生工,中國);熒光定量PCR試劑盒(Takara,日本)。
1.2 實驗方法
1.2.1細胞培養:將MC3T3-E1細胞接種于α-MEM培養基中,其中含10 %的胎牛血清、100 U/mL青霉素和100 μg/mL的鏈霉素。孵箱培養條件設定為溫度37 ℃、氣體條件為5 % CO2,每48 h進行換液,添加不同濃度的芍藥苷進行干預。
1.2.2CCK-8細胞增殖實驗:將MC3T3-E1細胞在96孔板中以5 000 cell/mm2的密度鋪板,每個實驗組設置5個復孔,每孔中培養基的體積為100 μL。24 h后,加入不同濃度的芍藥苷干預血清,48 h后,每個復孔加入90 μL含血清培養基之外,再加入10 μL CCK-8檢測液,37 ℃孵箱內進行孵育2 h,酶標儀(美國Biotek)在450 nm處測量吸光度值。
1.2.3ALP活性、染色實驗:將MC3T3-E1細胞鋪設于6孔板中,分別向每孔中加入3 mL藥物干預血清,對照組則加入相同濃度的成骨誘導劑(Vitamin C 50 μg/mL、Dexamethasone 100 mmol/L和β-sodium glycerophosphate 10 mmol/L的混合液), 每48 h換液一次,連續培養一周。采用150 μL的Ripa裂解液裂解細胞,離心后收集上清液作為樣品。96孔板中加入50 μL底物、30 μL緩沖液和20 μL樣品,總體積共100 μL。充分混勻后,37 ℃溫育15 min,酶標儀測吸光度值。ALP染色則吸除原有培養基,PBS輕柔清洗孔底細胞2~3遍,4 %多聚甲醛室溫下固定10 min,洗滌后加入300 μL顯色液。室溫避光孵育2 h后,PBS輕柔洗滌,光學顯微鏡(Elipse Ci-L)(日本Nikon公司)觀察并照相。
1.2.4茜素紅染色實驗:6孔板中,每孔加入不同濃度的芍藥苷干預血清和相同濃度的成骨誘導劑,培養2周,每48 h換液一次。染色步驟同ALP染色,確認染色良好后,進行光鏡下觀察并照相。緊接著進行半定量檢測,每孔加入1 mL 10 %十六烷基吡啶,輕微振蕩洗脫染料后,吸取200 μL上清液加入96孔板中,每組3個復孔,采用酶標儀540 nm測吸光度值,與標準曲線對應出相對濃度。
1.2.5實時熒光定量PCR(RT-PCR):提取總RNA后進行純度以及濃度檢測。確認無誤后采用試劑盒進行反轉錄,合成cDNA。于95 ℃預變性15 min,同溫度下變性20 s,于58 ℃退火30 s,在72 ℃下延伸30 s,如此反復擴增40個循環。采用熒光定量PCR儀(7500 fast,美國)進行檢測,采用β-actin作為內參進行定量分析,每組設3個平行復孔,引物序列見表1。
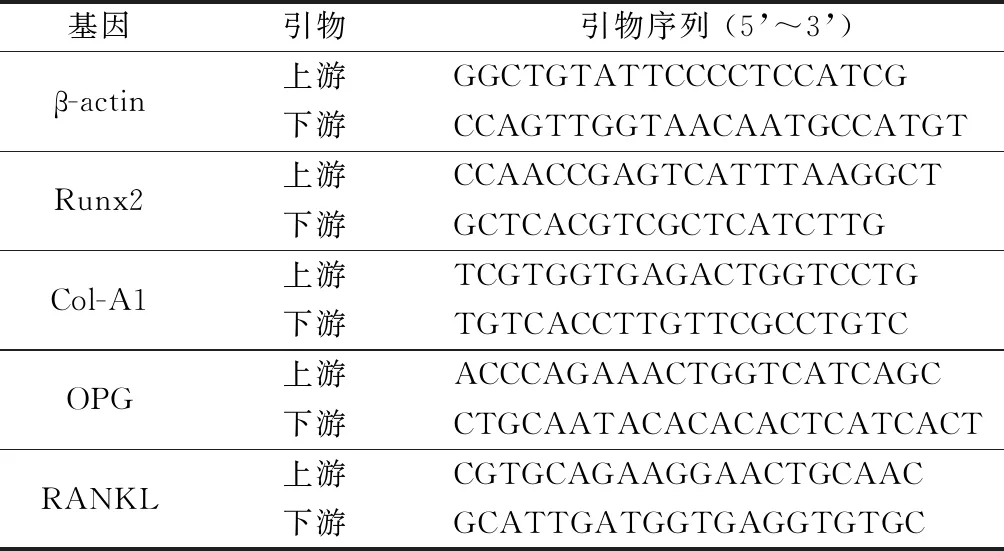
表1 引物序列Table 1 Primers for quantitative real time PCR
1.2.6Western blot檢測:取不同濃度芍藥苷干預72 h的細胞,Ripa裂解液冰上裂解15 min,提取細胞總蛋白,BCA法測定蛋白濃度。根據蛋白樣品濃度,用蛋白上樣緩沖液稀釋每組蛋白樣品至3 μg/μL,在電泳孔道中,每組加入10 μL,而后冰水浴中轉膜至PVDF膜上,5 %的脫脂牛奶封閉,一抗溶液中4 ℃孵育過夜。次日室溫條件下二抗溶液中孵育2 h。輕柔加入顯影劑,采用化學發光成像系統(C300,美國Azure)使蛋白條帶顯影,應用Image J軟件對蛋白條帶進行密度分析。
1.2.7HE染色和免疫組織化學檢測:應用石蠟切片機(Microm HM 340E,美國)對標本進行3 μm厚度切片。二甲苯脫蠟后,不同濃度乙醇褪去二甲苯。蘇木素染色、自來水返藍后伊紅染色,蒸餾水洗去附著的染色液。顯微鏡下觀察顏色結構良好后,脫水,二甲苯透明封片。光學顯微鏡下觀察干骺端附近骨小梁厚度以及結構。免疫組織化學染色步驟:脫蠟后采用抗原修復液覆蓋標本區域37 ℃孵育30 min,而后室溫下阻斷內源性過氧化物酶,一抗抗體4 ℃孵育過夜。室溫下二抗孵育30 min,與鏈霉素過氧化物酶室溫孵育20 min。滴加新鮮配制的DAB顯色液,蘇木素復染,自來水返藍,脫水封片。應用Image-Pro Plus軟件進行統計分析。
1.2.8micro-CT分析:頸椎脫位法后取小鼠左側脛骨,4 %多聚甲醛固定72 h,采用micro-CT(Cheetah EVO,YXLON,德國)進行掃描,掃描厚度為6~7 μm,源電壓80 kV,源電流35 μA,曝光時間選擇為720 ms。采用系統自帶的分析軟件對獲取圖像進行定量分析,主要參數有骨小梁數量(Tb.N)、骨小梁寬度(Tb.Th)、骨小梁間隔(Tb.Sp)以及骨小梁體積(BV)和掃描組織體積(TV)。
1.3 統計學處理
結果數據采用SPSS 17.0軟件進行統計計算,全部計量數據以均數±標準差(SD)表示,各組間比較采用t檢驗方式,以P<0.05認為差異具有統計學意義。
2 結果
2.1 不同濃度芍藥苷對體外MC3T3-E1細胞活力的影響
與對照組相比,芍藥苷對體外MC3T3-E1細胞活力無明顯影響(P>0.05),見圖1。
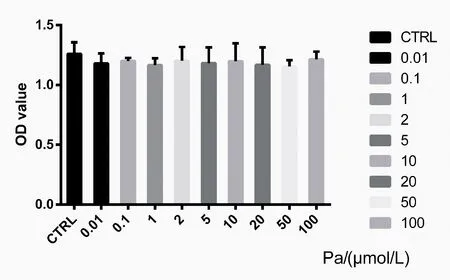
圖1 芍藥苷對MC3T3-E1細胞活力的影響Fig.1 Effect of paeoniflorin on the viability of MC3T3-E1 cells
2.2 芍藥苷促進體外MC3T3-E1細胞的成骨分化
中、高劑量芍藥苷能夠明顯提升MC3T3-E1細胞ALP的表達,且高劑量干預組(20 μmol/L)效果顯著(P<0.01)。成骨分化誘導劑干預14 d后,高劑量組鈣結節的數量與密度明顯高于對照組,結果顯示給予芍藥苷干預能夠明顯促進MC3T3-E1細胞的礦化能力(P<0.01)。見圖2。
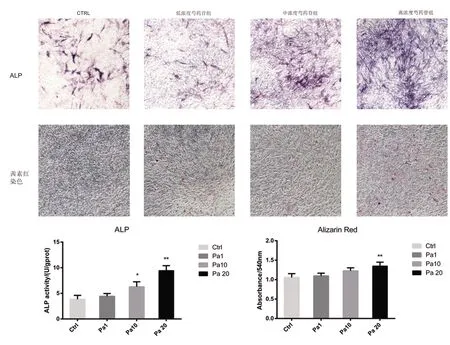
圖2 芍藥苷對MC3T3-E1成骨分化能力的影響(光鏡下100倍放大)注:*P<0.05;**P<0.01。Fig.2 Effect of paeoniflorin on osteogenic differentiation of MC3T3-E1(Scale bar: 100× magnification)
2.3 芍藥苷對體外MC3T3-E1細胞的成骨分化基因的影響
中、高劑量芍藥苷干預組顯著提升了成骨分化基因OPG、Runx2以及Colα1的mRNA表達(P<0.05),降低了破骨分化相關基因RANKL的mRNA表達(P<0.05),差異有統計學意義,見圖3。
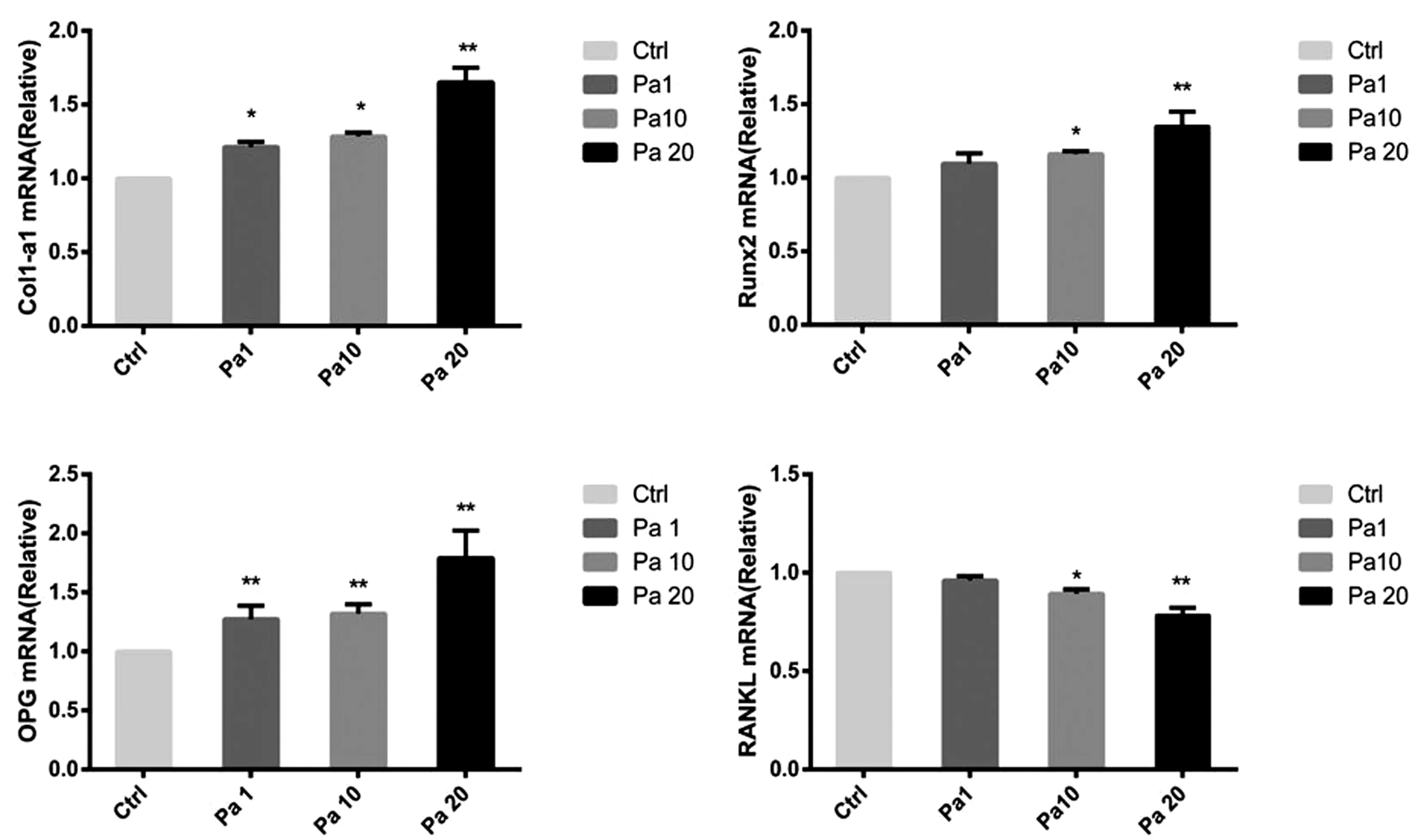
圖3 芍藥苷對MC3T3-E1細胞成骨分化相關基因的影響注:*P<0.05;**P<0.01。Fig.3 Effects of paeoniflorin on genes related to osteogenic differentiation of MC3T3-E1 cells
2.4 不同濃度芍藥苷干預后相關蛋白表達情況
高劑量芍藥苷干預組能夠顯著提升MC3T3-E1成骨分化蛋白OPG、Runx2蛋白的表達(P<0.01),降低破骨分化蛋白RANKL蛋白的分泌(P<0.01),見圖4。這一結果與RT-PCR結果相符合。
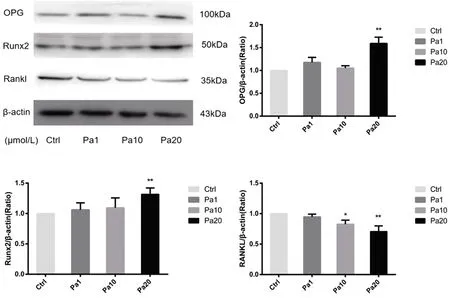
圖4 芍藥苷干預后成骨分化相關蛋白表達情況注:*P<0.05;**P<0.01。Fig.4 Expression of osteogenic differentiation related proteins after paeoniflorin intervention
2.5 HE染色和免疫組織化學分析結果
與Sham組相比,OVX組骨小梁間隔明顯增大,骨小梁變得細短而且排列稀疏;OVX+Pa組較OVX組骨小梁數量以及厚度有所增加。免疫組織化學結果顯示,Sham組中Runx2蛋白主要分布于骨小梁的表面成骨細胞內以及干骺端附近的骨細胞陷窩中,而OVX組表達較少,OVX+Pa組有所恢復。半定量分析顯示,OVX組與OVX+Pa組較Sham組Runx2蛋白表達均顯著下降(P<0.01),但芍藥苷組下降程度更少,與OVX組比較芍藥苷明顯提升骨質疏松小鼠體內的Runx2蛋白表達(P<0.01)。見圖5。
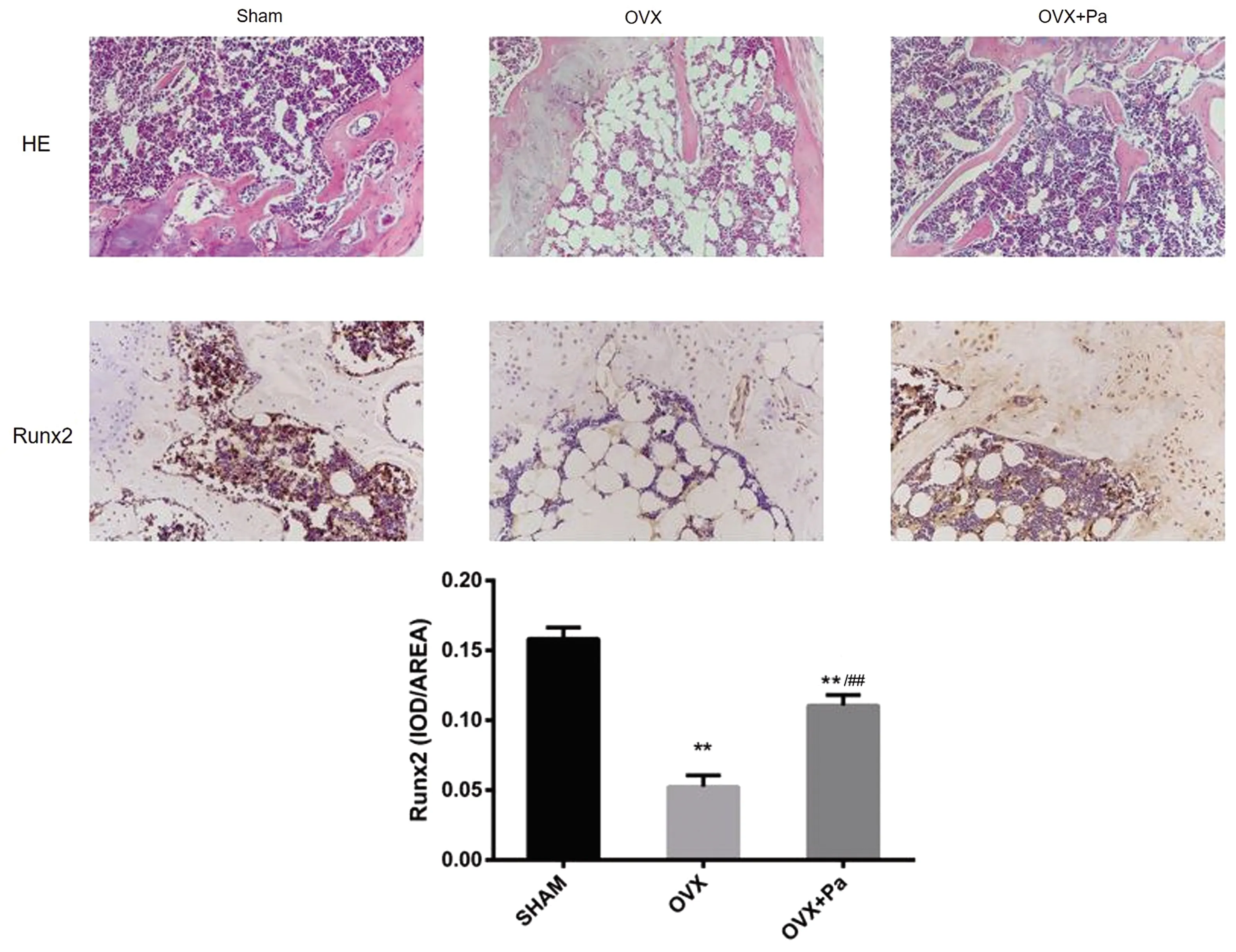
圖5 小鼠股骨遠端干骺端附近骨小梁HE染色以及Runx2蛋白免疫組織化學染色情況(光鏡下200倍放大)注:與Sham組比較,**P<0.01;與OVX組比較,##P<0.01。Fig.5 HE staining of trabecular bone near metaphyseal of distal femur and immunohistochemical staining of Runx2 protein(Scale bar: 200× magnification)
2.6 芍藥苷對小鼠骨微結構的影響
與Sham組相比,OVX組在BV/TV(骨小梁體積比)、Tb.N(骨小梁數量)、Tb.Th(骨小梁厚度)都顯著下降(P<0.01),而Tb.Sp(骨小梁間隔)顯著加寬(P<0.01)。而OVX+Pa組,Tb.Sp、Tb.Th未見明顯差異(P>0.05),BV/TV以及Tb.N較Sham組下降明顯(P<0.01);同時OVX+Pa組與OVX組相比較,顯著提升了BV/TV(骨小梁體積比)、Tb.N(骨小梁數量)和Tb.Th(骨小梁厚度),有效降低了Tb.Sp(骨小梁間隔)(P<0.01)。見圖6。
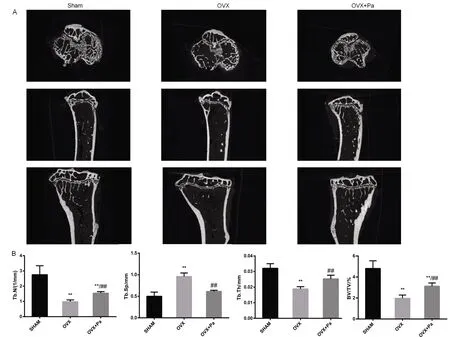
圖6 Sham組、OVX組和OVX+Pa組脛骨近端干骺端micro-CT分析 A:各組典型的micro-CT影像;B:各組Tb.N、Tb.Sp、Tb.Th、BV/TV的統計學分析結果。注:與Sham組比較,**P<0.01;與OVX組比較,##P<0.01。各組n=8。Fig.6 Micro-CT analysis of proximal tibial metaphyseal in the Sham group, OVX group and OVX+Pa group A:Typical micro-CT images of each group; B:Statistical analysis results of Tb.N, Tb.Sp, Tb.Th and BV/TV in each group.
3 討論
骨形成與骨吸收活動失衡,是骨質疏松癥發生發展的重要原因。成骨細胞構造骨組織形成活動,而破骨細胞拆解鈣離子以及膠原組織形成骨吸收活動[11]。成骨分化活動主要是由成骨細胞前體細胞的增殖與分化來調節[12],而Runx2和Osterix這兩種轉化因子起到重要促進的作用,表現為骨基質蛋白的分泌增加,堿性磷酸酶(ALP)、I型膠原纖維表達量(Colα1)升高(如圖3),這些微觀的改變進一步促進骨組織鈣鹽的沉積以及骨小梁的形成[13]。成骨分化通常分為兩個階段,在早期階段堿性磷酸酶作為關鍵標志物起到作用,可以促進相關成骨分化基因Colα1、OPN(骨橋蛋白)的表達;而在成骨分化的晚期階段特點是骨細胞外基質的形成,表現為鈣鹽沉積在骨小梁網狀結構中[14-15]。本研究表明芍藥苷可以有效地促進堿性磷酸酶以及成骨分化因子的分泌,進一步增強成骨細胞的礦化活動(見圖2~圖4),說明芍藥苷在成骨分化的早期以及晚期均起到了促進作用。
破骨細胞分化的進程受到了成骨細胞所分泌的兩種重要因子-骨保護素(OPG)以及核因子κB受體活化因子配體(RANKL)的影響。核因子κB受體活化因子配體(RANKL)通過與核因子κB受體活化因子(RANK)受體結合激活并調節破骨細胞分化的進程[16]。而成骨細胞分泌的OPG可以阻止RANKL與RANK的結合,從而達到抑制破骨細胞增殖分化的作用。故OPG與RANKL表達比在觀察骨吸收與骨形成活動時是一個重要的指標[17],通常在骨質疏松癥發生發展時,即骨吸收增強、骨形成減弱時,這一比例大大降低;而治療的目的是增強骨形成,降低骨吸收,提高OPG與RANKL這一比值。通過本研究發現,芍藥苷可以提高MC3T3-E1細胞OPG的mRNA與蛋白的表達,并減少RANKL的表達(見圖3、圖4),改善并提高了OPG/RANKL的比值關系,在促進成骨分化的基礎上一定程度地抑制了破骨細胞的分化。
為了進一步驗證芍藥苷的抗骨質疏松作用,本次研究進行了骨質疏松模型小鼠體內驗證。卵巢摘除模型小鼠是作為模擬原發性骨質疏松最為可靠的模型之一[18],能夠最大程度的反映絕經后女性有關的臨床與生理變化,有研究[19]表明,當卵巢摘除后低雌激素水平改變了骨細胞外的微環境,打破了既有的骨吸收/骨形成平衡,增加了骨轉換的程度,即增加破骨分化以及成骨細胞凋亡。筆者通過骨組織切片和組織免疫化學發現,芍藥苷可以改善骨小梁的厚度,增加干骺端附近Runx2蛋白的表達(見圖5),說明芍藥苷不但在體外實驗中可以促進成骨細胞的分化,同樣在體內實驗中得到了確認。為了進一步定量、微觀分析,筆者進行了micro-CT檢測。結果顯示,芍藥苷增加了檢測區域內的骨小梁數量,厚度,并降低骨小梁之間的間隙(見圖6)。
既有的研究已表明芍藥苷可以通過抑制骨吸收活動達到抗骨質疏松的作用[8],本研究則通過體內與體外實驗進一步說明芍藥苷具有雙向調節作用,在抑制骨吸收的同時,直接作用于成骨細胞增加骨形成活動,進一步證明了芍藥苷的抗骨質疏松作用。而最新的相關文章[11]表明,NF-κB信號通路起到了關鍵作用,芍藥苷可通過抑制NF-κB信號通路減少破骨細胞的分化,而當使用TNF-α干預成骨細胞上調NF-κB信號通路時,成骨分化活動受到明顯抑制,給予芍藥苷可以緩解NF-κB信號通路的抑制作用。說明NF-κB信號通路可能是芍藥苷的重要作用信號通路,其抗骨質疏松的具體作用靶點以及分子機制,需要進一步的深入研究。

