纖維二糖差向異構酶的研究與應用概述
徐錚,諸亞鋒
(南京工業大學 食品與輕工學院,江蘇 南京,211816)
差向異構體是指一對旋光異構體中只有一個手性碳的構型不同,如D-葡萄糖和D-甘露糖,而執行差向異構反應的酶即為差向異構酶(epimerase)[1]。纖維二糖差向異構酶(cellobiose 2-epimerase,CE酶,EC 5.1.3.11)可以有效催化多個底物,如催化纖維二糖產生4-O-β-D-吡喃葡萄糖基-D-甘露糖和4-O-β-D-吡喃葡萄糖基-D-果糖,或催化D-葡萄糖為D-甘露糖和D-果糖,或催化乳糖為乳果糖和依匹乳糖[2]。其中,產物乳果糖(lactulose)其濃縮液形式可作為治療便秘和肝性腦病的非處方藥物[3-7],也可以作為腸道益生元促進結腸中的雙歧桿菌和乳酸菌生長,同時抑制沙門氏菌和梭菌等有害菌繁殖[8-11],具有實際應用價值。乳果糖的工業化生產長期以來依靠化學催化法,即通過強堿性的試劑如氫氧化物、硼酸、偏鋁酸鈉等催化乳糖來實現異構化[12-15],其存在的問題包括轉化率低(如使用氫氧化物催化,轉化率一般不超過30%)、產生污染、色素和副產物多和產品下游分離困難(如使用硼酸和偏鋁酸鈉,除硼或除鋁則較為困難)等問題[16]。比較而言,生物法制備技術更具有優勢。早期發現,β-半乳糖苷酶通過轉糖苷作用可以催化乳糖和D-果糖產生乳果糖,但轉化率較低,不具備產業化前景[17]。近年來發現CE酶可作為生物法制備乳果糖的工業酶,具有高效、反應條件溫和、無污染等優點,已得到了業內的廣泛關注。
1 常溫型CE酶的研究
常溫型CE酶的催化溫度較低,一般在30~50 ℃,已報道的酶源包括Ruminococcusalbus、Bacteroidesfragilis、Cellulosilyticumlentocellum、Dyadobacterfermentans、Dysgonomonasgadei、Flavobacteriumjohnsoniae、Pedobacterheparinus、Eubacteriumcellulosolvens、Saccharophagusdegradans等[18-23],這類CE酶催化乳糖的產物只有依匹乳糖(表1)。由于依匹乳糖尚沒有商業用途,因此針對這類酶的開發停留在實驗室階段。KREWINKEL等[22]嘗試使用常溫型CE酶(C.lentocellum和D.gadei來源)催化牛奶超濾液中的乳糖來產生依匹乳糖,催化形式為固定化酶膜反應器EMR,低溫(8 ℃)反應,催化28 h后轉化率達29.9%。SABURI等[24]利用R.albusNE1來源的CE酶催化乳糖獲得依匹乳糖,催化完成后經過4個步驟成功純化獲得了純度91.1%的依匹乳糖,包括:(1)濃縮結晶法去除大部分乳糖;(2)β-半乳糖苷酶水解剩余乳糖;(3)酵母發酵去除水解產生的單糖;(4)Na-型陽離子交換樹脂純化出依匹乳糖,4個步驟獲得依匹乳糖的總收率為42.5%。以上研究表明,利用常溫型CE酶制備依匹乳糖的工藝路線已經建立,而針對依匹乳糖性質的研究又表明其具有一定的益生元功效[25-27]。因此,依匹乳糖在未來也可能被開發為一種腸道益生元而為人類健康做出貢獻。
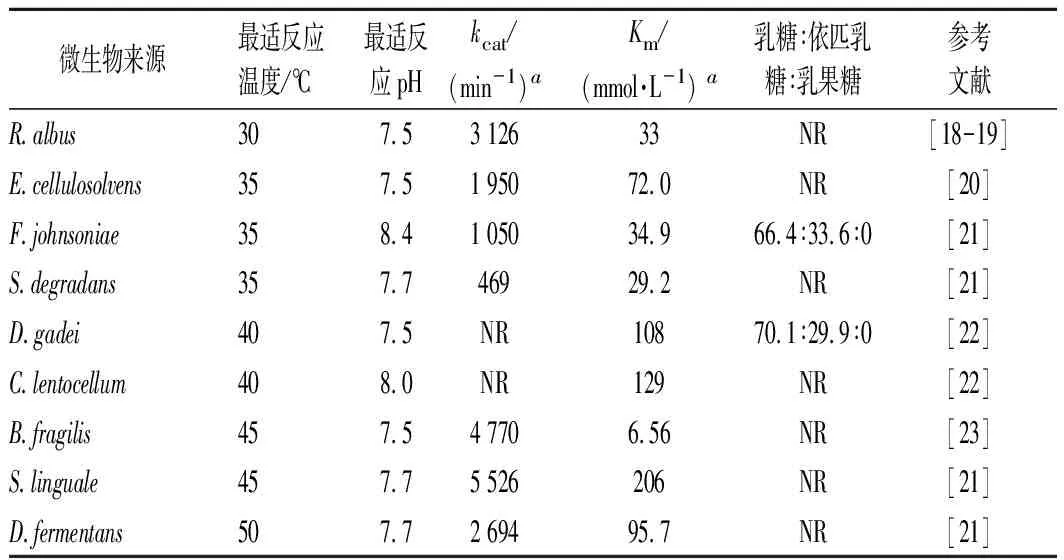
表1 部分常溫型CE酶的性質比較Table 1 Comparison of the properties of mesophilic CE enzymes
2 嗜熱型CE酶的研究
嗜熱型CE酶的催化溫度較高,一般在60~85 ℃;已報道的酶源有Caldicellulosiruptorsaccharolyticus、Caldicellulosiruptorobsidiansis、Dictyoglomusturgidum、Dictyoglomusthermophilum、Rhodothermusmarinus、Thermoanaerobacteriumsaccharolyticum等幾例[28-37],主要來自于熱解纖維素果汁桿菌屬、網團菌屬、嗜熱厭氧桿菌屬等(表2)。C.saccharolyticusCE酶簡稱CSCE,該酶是最早被發現的嗜熱型CE酶。PARK等[28]首先發現CSCE可以催化單糖反應,如催化D-葡萄糖產生D-甘露糖以及D-果糖;KIM[29]研究發現CSCE對乳糖的催化效率較高,并且生成了醛酮糖異構化產物乳果糖和差向異構化產物依匹乳糖,這是首次發現β-半乳糖苷酶以外的酶源可以生成乳果糖,而且擁有較高的效率。純酶酶活力為30 U/mg,僅催化2 h對質量濃度700 g/L乳糖的轉化率就達到58%;乳果糖質量濃度為408 g/L,生產強度可達204 g/(L·h),即4.9 kg/(L·d)。如此高的效率表明CE酶已具備商業化應用的潛力,然而該反應會同時產生一定量的副產物依匹乳糖,需要在產品下游分離過程中去除。例如CSCE可以產生15%的依匹乳糖,質量為濃度107 g/L,生產強度54 g/(L·h)[29]。進一步研究發現在催化體系中加入硼酸可以降低依匹乳糖含量,原因是硼酸與乳果糖形成絡合物致其脫離反應體系,加速反應平衡向乳果糖生成方向移動,部分依匹乳糖也會轉化為乳果糖[33]。然而硼酸的加入量相對較大才能取得顯著效果,在下游分離步驟中去除硼的難度大,因此經濟性仍有待考察。KIM等[31]挖掘了D.turgidum來源的CE酶(DTCE),該酶最適催化溫度70 ℃,最適pH 7.0,催化乳糖產物中依匹乳糖占比12.8%,乳果糖占比54.3%。在70 ℃下的活性半衰期為55 h,kcat為89.4 min-1,Km為79.6 mmol/L,kcat/Km為1.12 L/(mmol·min)。CHEN等[32]研究了C.obsidiansis來源的CE酶(COCE),該酶最適催化溫度70 ℃,最適pH 7.5,催化乳糖產物中依匹乳糖占比11%,乳果糖占比54%,其依匹乳糖含量在已報道文獻中較低,具有一定的優勢。XIAO等[34]通過數據庫篩選和計算機模擬分析選擇了D.hermophilum來源CE酶(Dith-CE)并進行研究,結果表明Dith-CE的最適催化溫度85 ℃,最適pH 7.0,在70 ℃下的活性半衰期為99 h,體現了很強的熱穩定性。對已挖掘的嗜熱型CE酶,研究者進行了催化工藝的開發,其中全細胞催化是一種較為便捷的方法。WANG等[38]利用乙醇透性化的重組大腸桿菌BL21(DE3)細胞催化生產乳果糖,細胞表達有CSCE基因。反應體系經優化后設為:催化溫度80 ℃,pH 7.5,酶用量12.5 U/mL,底物質量濃度600 g/L。乳果糖最高轉化率為65.1%,產物質量濃度390.59 g/L,研究還表明反應體系中加入磷酸鹽可以降低依匹乳糖的含量。
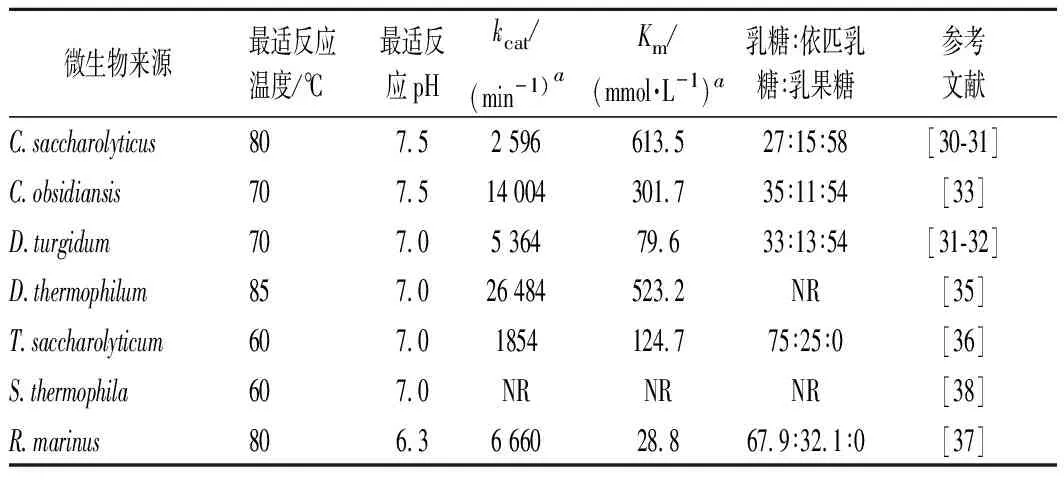
表2 部分嗜熱型CE酶的性質比較Table 2 Comparison of properties of thermophilic CE enzymes
除以上產乳果糖為主的嗜熱型CE酶外,R.marinus、Spirochaetathermophila和T.saccharolyticum等來源CE酶也具有較高的催化溫度,但產物僅發現依匹乳糖[35-37]。因此,這類嗜熱酶催化乳糖后只發生了差向異構化反應,而不具有醛酮糖異構活性,其機理尚未可知。OJIMA等[36]研究了R.marinus來源CE酶(RMCE),該酶最適反應溫度80 ℃,最適pH 6.3。該酶對底物乳糖的催化效率高于纖維二糖,分別為3.85和2.97 L/(mmol·s)。PARK等[37]表征了S.thermophila來源CE酶(STCE),該酶最適反應溫度60 ℃,最適pH 7.0,在60 ℃的活性半衰期為124 h,催化乳糖后可產生依匹乳糖。CHEN等[35]報道了T.saccharolyticum來源CE酶(Thsa-CE),該酶的最適反應溫度60 ℃,最適pH 7.0,純酶對乳糖的比酶活力為13.5 U/mg。催化200 mmol/L乳糖4 h可產生50 mmol/L依匹乳糖。有趣的是,嗜熱型CE酶還可以催化D-葡萄糖來獲取D-甘露糖,同時產生副產物D-果糖。顯然,這表明嗜熱型CE酶對單糖也同時具有差向異構和醛酮糖異構2種活性。PARK等[28]發現CSCE酶催化500 g/LD-葡萄糖后,可獲得75 g/L的D-甘露糖與47.5 g/L的D-果糖。近期研究表明D-甘露糖具有較高的抗癌活性[40],因此其具備一定的商業價值,利用嗜熱型CE酶生產D-甘露糖的工藝還需要更多的基礎研究。
3 CE酶的結構生物學研究
解析酶的結構對于正確理解酶的催化機理,掌握其結構改造規律至關重要。許多工業酶的晶體結構獲得了解析,而具有相似性的不同來源酶結構也可以實現以分子模建為手段的計算機輔助分析。CE酶的首個晶體結構由FUJIWARA等[40]完成解析(分辨率2.6 ?,圖1),是來源于R.albus的CE酶(RACE),該酶是單亞基酶,實測分子質量43.1 kDa。其總體結構為(α/α)6,即在內部含有6個α螺旋,外部為6個與之反向平行排列的α螺旋,形狀接近正六邊形;酶的直徑55 ?,厚度40 ?,且其中的一側具有較多的loop狀結構(圖1中綠色部分),因此具有很大的柔性,活性中心口袋即位于此側。FUJIWARA等[41]也解析了嗜熱型CE酶的RMCE的晶體結構,其中包含多個酶-小分子配體的復合物結構,如依匹乳糖(產物)、纖維二糖醇(底物類似物)、葡萄糖基甘露糖(底物類似物)等。通過復合物晶體結構分析發現RMCE屬于烯二醇中間體催化機制,推測其催化纖維二糖的過程如下:在反應開始時,通過H390作為廣義酸或堿來打開葡萄糖基糖環(底物為乳糖時同樣打開葡萄糖基糖環);開環后再由H390殘基奪取糖鏈中C-2位的質子形成烯二醇中間體(C1-C2間形成雙鍵),然后再由H259提供質子使得中間體發生轉化形成開環的產物,最終再經過閉環反應成為終產物;H200也起到了穩定反應中間體的作用[41]。相比較而言,RACE中組氨酸同樣是催化殘基:H243和H374扮演了廣義酸堿催化劑的角色,H184也被發現對催化起到關鍵作用。因此CE酶的底物催化過程主要是由3個組氨酸殘基配合完成的,組氨酸的不同質子化狀態使得反應能夠以可逆的方式進行[40]。進一步對常溫型和嗜熱型CE酶在序列上進行了比較(圖2,包括RaCE、DgCE、FjCE、EcCE、CoCE、CsCE、DtCE、RmCE),結果表明2種類型的CE酶在序列特征上并沒有顯著差異。FUJIWARA等[41]認為嗜熱型CE酶RMCE在高溫下較為穩定是因為酶內部具有較強的疏水相互作用,而且在表面具有較強的親水相互作用;這分別是因為RMCE具有很高比例的脯氨酸以及精氨酸所致。
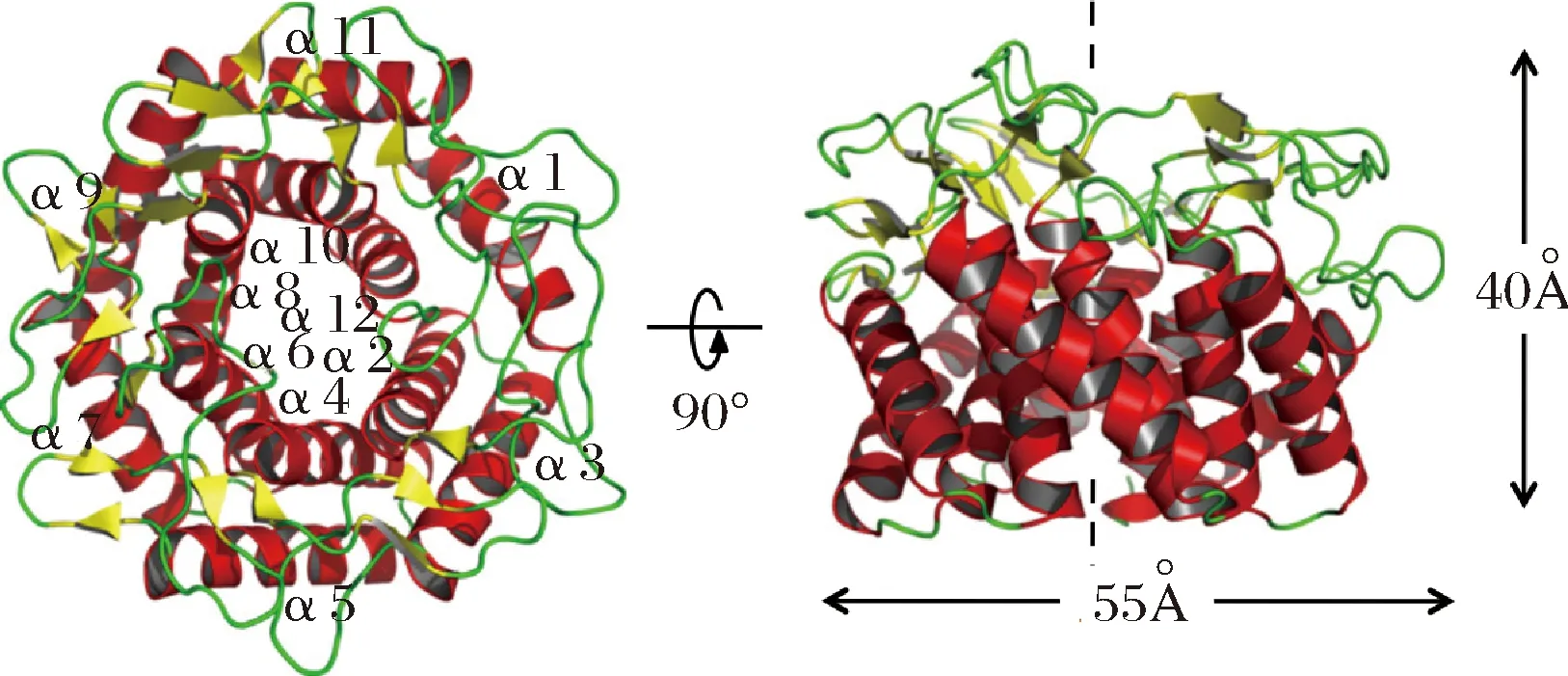
圖1 RACE的晶體結構Fig.1 Crystal structure of RACE

圖2 常溫型和嗜熱型CE酶的一級序列比較Fig.2 Amino acid sequence analysis among mesophilic and thermophilic CE enzymes
4 CE酶的改造研究
蛋白質工程改造是提升野生型酶性能的有效手段,可通過基于高通量篩選的定向進化或酶結構分析的理性設計方法。已發表文獻針對CE酶的改造研究主要集中在提升酶活力、改善熱穩定性和降低副產物比例等幾個方面,對酶活性中心的重要殘基功能進行了預測與驗證,結果如表3所示。SHEN等[42]對CSCE酶進行了定向進化改造,利用顯色法測定酶活力的步驟作為篩子,篩選到了突變體“G4-C5”。該突變體即五點突變體R5M/A12S/I52V/F231L/K328I,具有3倍于野生型酶的比酶活力(30 U/mg),證明定向進化可以有效提升CE酶的活性。ITO等[43]分析了RACE(該酶以依匹乳糖為催化產物)的重要氨基酸殘基,結果表明無論底物是纖維二糖還是乳糖,R52、H243、E246、W249、W304、E308和H374殘基都是催化必需殘基,F114和W303也對催化有重要貢獻。PARK等[44]分析CSCE酶活性中心與甘露糖基團C-2位的作用情況,選擇Y114和N184兩個殘基位點進行飽和突變研究,結果表明在所得突變體中,Y114E催化200 g/L乳糖生產乳果糖的轉化率為43.5%(產物濃度質量86.9 g/L),盡管轉化率不高但依匹乳糖的質量濃度僅為4.6 g/L(轉化率2.3%),這可能是因為突變體喪失了大部分的差向異構化能力。針對熱穩定性的突變研究也有報道,SHEN等[45]發現雙位點突變E161D/N365P在高溫下的活性半衰期提高了4倍,最適反應溫度也從80 ℃提高到87.5 ℃,對底物乳糖的催化效率kcat/Km上升了29%。
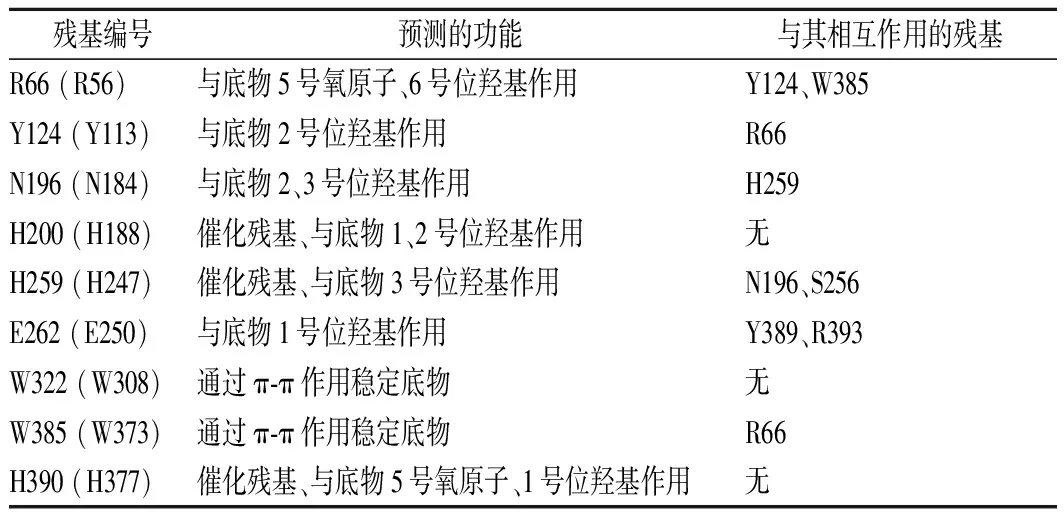
表3 CE酶的分子改造研究結果Table 3 Results of protein engineering on CE enzymes
5 CE酶的固定化研究
固定化酶一般具有遠高于游離酶的活性半衰期,因此可以批次使用來實現成本的大幅下降;而且將固定化酶填充于反應器中可以方便操作,提升效率。固定化方法一般有吸附法、包埋法、交聯法和共價結合法等,常使用商業化樹脂、多孔玻璃珠、海藻酸鈉、卡拉膠和聚丙烯酰胺等材料作為固定化載體[46]。針對CE酶,已報道文獻主要通過商業化樹脂或非常規方法進行固定化。如WANG等[47]利用商業化的陶氏公司DuoliteTMA568樹脂固定化CSCE酶,這種樹脂屬于弱陰離子型,功能基團為-N-(R)2,顆粒大小為150~600 μm。由于CE酶的等電點一般偏酸性,因此在中性條件下帶負電可與陰離子樹脂結合,并進一步使用戊二醛進行交聯。該固定化酶在50 ℃下孵育12 h并未發現活性損失,表現出良好的穩定性。重復使用15個批次以后,固定化酶保留了90%的活性。在催化過程中,固定化酶并未表現出低于游離酶的反應速率,在催化約4 h后反應進入化學平衡狀態,最終獲得58.3%的轉化率,乳果糖質量濃度350 g/L。除常見載體外,微生物孢子也可以作為固定化CE酶的材料,GU等[48]將枯草芽孢桿菌孢子作為載體,利用孢子吸附CSCE酶,1011個孢子的吸附量可達1.47 mg。在4 h內催化乳糖可以獲得395 g/L的乳果糖,該固定化酶體系使用8次后可以保留70%的酶活力。WU等[49]利用枯草芽孢桿菌表達系統分泌式表達CSCE酶,并將其固定化于EMR膜反應器,該固定化酶系統具有較好的催化效率及穩定性,以乳清中的乳糖作為底物,經過催化后轉化率達到58.5%,并能夠批次重復使用10次。以上結果表明CE酶的固定化可以獲得良好的效果,但使用批次與商業化的固定化酶相比還有差距,需要進一步的優化研究。
6 不同宿主對CE酶的表達研究
由于大腸桿菌產內毒素而且易感染噬菌體,因此用于生產醫藥產品或食品會帶來一系列問題;開發食品級表達宿主具有重要的學術和經濟價值,常見的此類宿主包括枯草芽孢桿菌、畢赤酵母、釀酒酵母、解脂耶氏酵母和乳酸菌等。除了安全性問題以外,開發胞外分泌型表達系統對工業酶的應用極為重要;這是因為胞內酶需要破胞過程才能夠更好的實現催化,而破胞后胞內可溶性物質(蛋白質、核酸、脂類等)逸出會污染催化產物,其去除過程費時費力。逸出的蛋白質會加重反應過程中的美拉德反應,給產品下游分離帶來困難。常見的分泌型表達系統包括酵母、絲狀真菌和枯草芽孢桿菌等,其中絲狀真菌的操作難度較大,而酵母和枯草芽孢桿菌具有很大的潛力,針對這類底盤微生物系統的表達研究將是助力CE酶應用的關鍵問題。其中,韓亮等[50]將CSCE基因在畢赤酵母中表達,獲得了有活性的發酵液,誘導144 h后的發酵液上清液酶活力達到0.42 U/mL。對重組酶純化后發現酶學性質并沒有顯著變化,證明畢赤酵母系統既可以實現分泌表達又能夠保留CE酶的活性。王鑫淼等[51]將嗜熱網球菌(D.thermophilum)來源的CE酶基因通過pBSuL3載體轉化枯草芽孢桿菌并獲得表達,搖瓶最高酶活力達到12.3 U/mL,進一步在3 L發酵罐中獲得了56 U/mL的胞內酶活力,比搖瓶提高了8倍。在此基礎上添加20 U/mL的酶液催化400 g/L的乳糖能夠獲得51%的轉化率,由此證明枯草芽孢桿菌也是適用于CE酶表達的微生物宿主。
7 展望
CE酶作為近幾年來才受到系統性研究的工業酶,已經展現出了規模化應用的潛質。隨著我國對環保事業的重視,污染較大的化學法工藝將被逐漸淘汰,利用酶法制備乳果糖的技術進展迅速,有望在不遠的將來成為乳果糖的主要制備方法。CE酶具有易表達、穩定性好、催化機理清晰等優勢,但也存在酶活力仍不夠高,野生型酶易產生副產物依匹乳糖等缺點。因此仍然需要更深入的研究,尤其是廣泛挖掘不同來源的CE酶,從中篩選出催化活力更高的酶源。CE酶具有較為獨特的催化特性,如常溫型CE酶在長時間催化后也可以產生乳果糖,其中的機制尚未有充分的解釋;而不產乳果糖的CE酶與高產乳果糖的酶源在一級序列上存在不低的相似度,因此活性口袋中殘基位點的區別造成了這種差異,還需要深入的研究。異構酶在工業酶中的成功實例相對較少,其中最知名的是葡萄糖異構酶(glucose isomerase,GI酶)制備果葡糖漿的工藝。根據這項工藝的經驗,以固定化酶形式進行催化是非常必要的,主要原因在于異構酶的酶活力在工業酶中并不突出,一般低于水解酶或氧化還原酶等,因此酶的用量較大。制備成固定化酶后可以實現多批次使用,如GI酶固定化后最高可獲得數百天的活性半衰期,這對于異構酶工藝的制酶成本控制極為重要[52]。總之,CE酶作為新興的工業酶,已展現出了巨大的應用潛力,相信該領域的科學研究將為乳果糖等產品的生物法技術提供堅實的理論基礎,在不遠的將來通過CE酶制備的乳果糖產品能夠為醫藥與食品行業做出貢獻。

