熒光定量PCR方法分析鮮雞蛋貯藏過程蛋殼表面優勢菌的變化
石一,武頌文,李文涓,袁璐,李焱,張浩帆,馬國柱,劉東立*
1(陜西省疾病預防控制中心,陜西 西安,710054)2(西安醫學院,陜西 西安,710021)3(西安交通大學醫學部,陜西 西安,710061)4(西安市疾病預防控制中心,陜西 西安,710054)5(咸陽市疾病預防控制中心,陜西 咸陽,712000)
雞蛋隨著貯存時間的延長,其新鮮度下降,營養成分也會丟失[1]。國內外學者圍繞雞蛋品質積極探索主要是針對哈氏單位、質量損失率、蛋黃系數和微生物含量等指標[2-4]。傳統微生物計數的方法可以從整體上反映雞蛋的衛生學情況,但很難反映出某種微生物具體的數量,不同培養基的選擇往往也會帶來一定程度的偏差[5],操作復雜,時效性較慢。近年來越來越多的研究者通過分子生物學方法鑒定微生物的種類和變化情況,如變性梯度凝膠電泳(denaturing gradient gel electrophoresis, DGGE)、16S~23S rRNA擴增片段長度多態性(amplified fragment length polymorphism, AFLP)和單鏈構象多態性(single strand conformation polymorphism, SSCP)等[6-8]。雖然這些技術方法具有免培養、快速等特點,但是不能對微生物的數量進行絕對定量。
熒光定量PCR技術最大的特點就是可以準確定量樣品中微生物的含量,SHI等[9]利用熒光定量PCR技術研究了米酒在釀造過程中酵母菌和乳酸菌的變化情況;TOFALO等[10]利用熒光定量PCR技術研究了餐用油橄欖在發酵過程中總酵母的數量變化情況,也有學者通過監測食醋發酵過程中醋酸菌、乳酸菌的變化控制和提高產品的風味[17]。
本研究旨在通過熒光定量PCR的方法,對3個地區鮮雞蛋在儲存過程中蛋殼表面4種優勢菌屬(葡萄球菌屬、乳酸桿菌屬、鏈霉菌屬和腸球菌屬)進行定量分析,從而為具體研究雞蛋腐敗微生物、延長雞蛋的貨架期奠定理論基礎。
1 材料與方法
1.1 標本來源
在榆林(YL)、漢中(HZ)和西安(XA)3個地市,分別選取一家具有代表性的蛋雞養殖場進行取樣,采集當天生產的雞蛋,每個養殖場收集30枚雞蛋,共3個批次。所有樣品遵循無菌采樣要求,存放于25 ℃恒溫培養箱。采樣當天即為第0天,并于后續4個時間點(第14、28、42和56天)分別使用一次性棉拭子收集蛋殼表面微生物標本。所有拭子保存于-40 ℃冰箱,等待提取核酸。
1.2 實驗方法
1.2.1 DNA提取
使用德國Qiagen公司DNA提取試劑盒(51304),采用改良的核酸提取方法提取樣本DNA。將采樣標本拭子頭剪入1.5 mL離心管中。加入180 μL 20 mg/mL的溶菌酶,旋渦振蕩混勻37 ℃金屬浴30 min。加入25 μL蛋白酶K、200 μL AL,旋渦振蕩混勻56 ℃金屬浴過夜。短暫離心,將離心管中液體全部吸出轉移至新的1.5 mL離心管中。加200 μL無水乙醇,振蕩混勻,剩余步驟參照說明書。
1.2.2 擴增插入片段
針對4種菌屬按照文獻[11-13]合成特異性引物,引物序列見表1。25 μL PCR反應體系包括:10×buffer 2.5 μL,正向/反向引物(10 μmol/L)各0.5 μL,dNTP(10 mmol/L)0.5 μL,MgCl2(25 mmol/L)2.5 μL,rTaq(5 U/μL)0.2 μL,DEPC 水 16.3 μL,模板2 μL。PCR反應程序如下:預變性95 ℃ 5 min;變性95 ℃ 30 s,退火30 s(溫度見表1),延伸72 ℃ 2 min,共40個循環;最終延伸72 ℃ 5 min,4 ℃保存。PCR產物用2%瓊脂糖凝膠電泳檢測。使用北京天根公司DNA純化回收試劑盒(離心柱型)對瓊脂糖電泳條帶清晰的PCR產物進行純化。
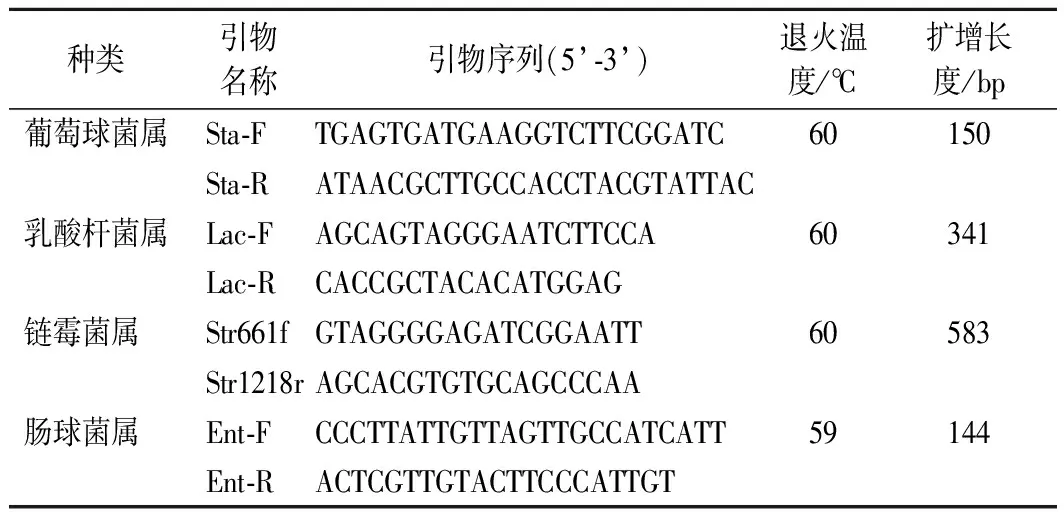
表1 四種優勢菌屬引物序列和退火溫度Table 1 Primer sequence and annealing temperature of four dominant bacteria
1.2.3 插入片段與pMD18-T載體的連接
吸取1 μL載體 pMD18-T,1 μL PCR擴增產物,3 μL DEPC 水和5 μL SolutionⅠ充分混合,室溫孵育1 h。
1.2.4 連接產物的轉化
吸取100 μL感受態細胞DH5α懸液到1.5 mL離心管中,將10 μL連接產物全部加入,吹打混勻,冰浴30 min。取出離心管,42 ℃金屬浴45 s,再放置冰中1 min。向離心管中加入890 μL SOC培養基,混勻后置于37 ℃搖床振蕩培養1 h。吸200 μL懸液鋪于倒好的LB/Amp/X-gal/IPTG固體培養基上,37 ℃培養過夜。
1.2.5 篩選陽性轉化子
取出隔夜培養的平板,室溫放置1~2 h,觀察平板上的藍白斑菌落,挑取白色菌落至5 mL LB/Amp培養液試管中,37 ℃搖床培養12 h。吸取1 mL菌液,送至上海生工生物工程公司測序。
利用DNASTAR軟件對測序結果核苷酸序列進行處理,得到目的片段基因序列。利用NCBI數據庫對得到的基因片段進行BLAST比對,確定轉化效果。
1.2.6 質粒提取
根據比對結果,選取轉化成功的質粒,使用日本Takara公司MiniBEST Plasmid Purification Kit Ver.4.0試劑盒進行質粒提取,最后得到標準品。
1.2.7 測定質粒濃度
使用 Nanodrop微量核酸蛋白檢測儀測定質粒濃度,應用 Avogadro’s常數(1摩爾溶液大約有6.022 141 5×1023拷貝數)計算質粒拷貝數,按公式(1)、(2)、(3)和(4)計算:
質量=質粒質量濃度(ng/μL)×體積(μL)
(1)
分子質量(平均分子質量)=(載體質粒片段大小+插入片段大小)×(330 Da×2)
(2)
(注:每個堿基平均分子質量為330 Da,每對堿基平均分子質量為660 Da)
溶液摩爾數=質量/分子質量
(3)
拷貝數=溶液摩爾數×6.022 141 5×1023
(4)
1.2.8 標準曲線的制作
取8個0.2 μL PCR反應管編號,每管加入20 μL DEPC水。從提取的質粒溶液中吸取5 μL,加入到第1管中,旋渦振蕩3 s,充分混勻。更換槍頭后,從第1管中吸取5 μL溶液加入到第2管中,同樣振蕩3 s。以此類推直至第8管,按體積比1∶5進行稀釋,蓋緊后短暫離心后備用。
1.2.9 熒光定量PCR擴增
20 μL反應體系包括:SYBR Green Realtime PCR Mix 10 μL,正/反向引物(10 μmol/L)各0.8 μL(引物序列同前),ROX Reference Dye 0.4 μL,DEPC 水 6 μL,模板2 μL。預變性95 ℃ 5 min,變性95 ℃ 10 s,退火15 s(溫度同前),延伸72 ℃ 45 s,共40個循環,72 ℃收集熒光,溶解曲線設置為默認值。
1.2.10 統計分析
統計分析使用SPSS 18.0軟件,組間差異性分析采用單因素方差分析的方法,當P<0.05時有統計學意義。
2 結果于分析
2.1 擴增插入片段
隨機挑選3份提取好的樣本核酸,利用4種優勢菌屬的特異性引物進行PCR擴增,結果如圖1所示,擴增產物片段大小與預期長度基本一致,葡萄球菌屬(150 bp)、乳酸桿菌(341 bp)、鏈霉菌(583 bp)和腸球菌(144 bp)。擴增產物無明顯非特異性條帶,說明菌屬引物特異性較好,陰性對照均正常無污染。

a-乳酸桿菌屬和葡萄球菌屬;b-鏈酶菌屬;c-腸球菌屬圖1 特異性引物擴增效果Fig.1 Specific primer amplification effect
2.2 陽性轉化子篩選
經過平板篩選和DNA測序驗證,4種優勢菌屬的標準品質粒均構建成功,通過提取質粒可以用于標準曲線樣本的制備。
2.3 葡萄球菌屬標準曲線及檢測結果
經過qPCR測定,計算葡萄球菌屬標準曲線各參數分別為:E=84.71%,R2=0.998,Slope=-3.753,Tm=83.67(圖2-a),R2值較好。不同取樣時間熒光定量PCR結果見表2。數據顯示HZ、XA組葡萄球菌屬的數量在14 d前均呈增多趨勢,而后持續減少。
2.4 乳酸桿菌屬標準曲線及檢測結果
乳酸桿菌屬標準曲線各參數分別為:E=88.73%,R2=0.996,Slope=-3.625,Tm=87.09(圖3-a),不同取樣時間熒光定量PCR結果見表2。由表2可知,隨著時間延長,3組乳酸桿菌屬的數量在14 d后均呈下降趨勢。
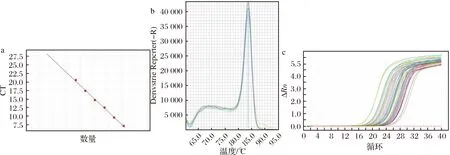
a-標準曲線;b-熔解曲線;c-擴增曲線圖2 葡萄球菌屬熒光定量PCR結果Fig.2 Staphylococcus qPCR results

表2 三個地市4種優勢菌屬的比較 單位:拷貝數
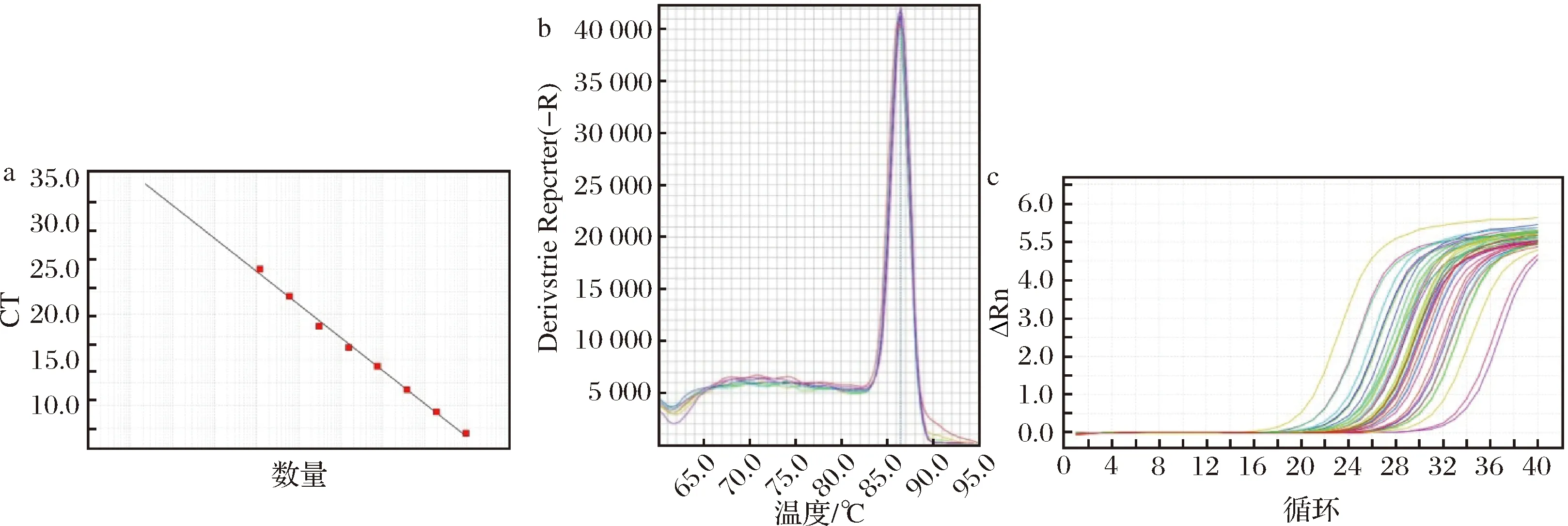
a-標準曲線;b-熔解曲線;c-擴增曲線圖3 乳酸桿菌屬熒光定量PCR結果Fig.3 Lactobacillus qPCR results
2.5 鏈霉菌屬標準曲線及檢測結果
經過倍比稀釋,鏈霉菌屬標準品所測得的標準曲線各參數分別為:E=79.68%,R2=0.990,Slope=-3.929,Tm=89.93(圖4-a)。從表2數據可以看出,隨著時間的延長,YL、XA組鏈霉菌屬的數量整體呈上升趨勢。
2.6 腸球菌屬標準曲線及檢測結果
腸球菌屬標準曲線各參數分別為:E=102.71%,R2=0.999,Slope=-3.259,Tm=84.86(圖5-a),R2值也較好,不同取樣點熒光定量PCR結果見表2。結果表明,HZ、XA組腸球菌屬的數量在28 d后才出現下降。
綜合來看,4種優勢菌屬的擴增曲線基線平整、指數區明顯,標準曲線線性擬合度高,說明可信度高結果可靠,熔解曲線呈現單一熔解峰,說明無引物二聚體和非特異性產物。
2.7 不同地區間優勢菌屬的比較
比較不同地區間4種優勢菌qPCR結果后發現,葡萄球菌屬和腸球菌屬3組之間存在顯著統計學差異(P<0.01),說明受采樣地影響較為明顯。而乳酸桿菌和鏈霉菌2個菌屬則無統計學差異。
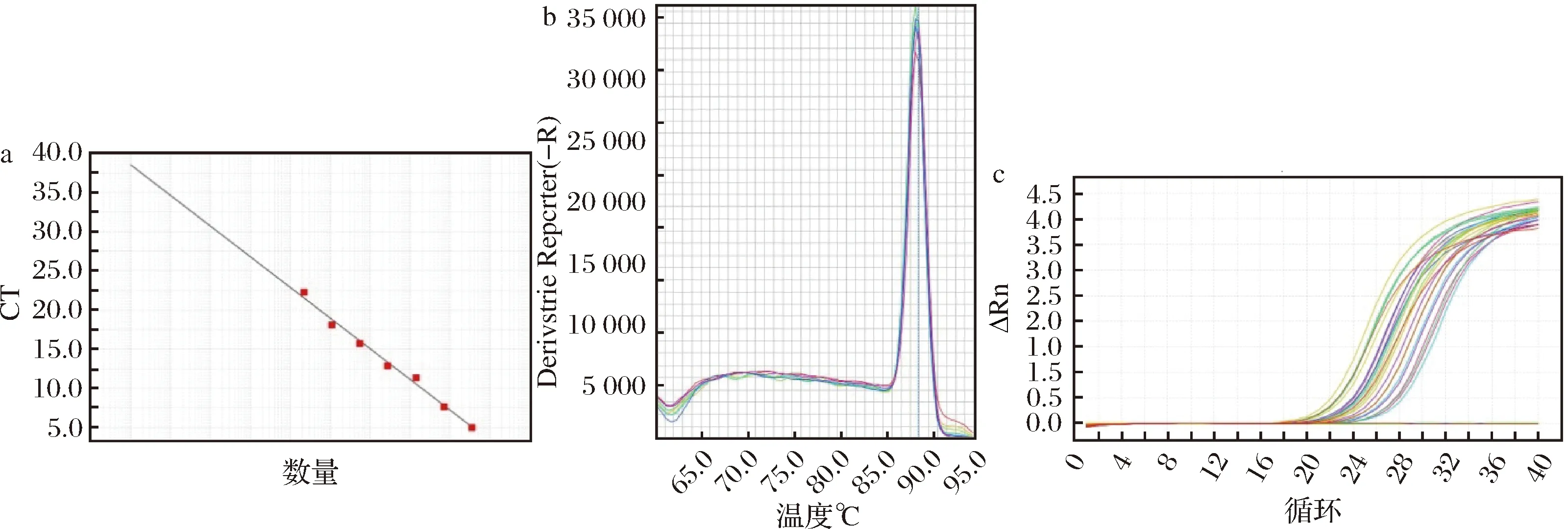
a-標準曲線;b-熔解曲線;c-擴增曲線圖4 鏈霉菌屬熒光定量PCR結果Fig.4 Streptomyces qPCR results
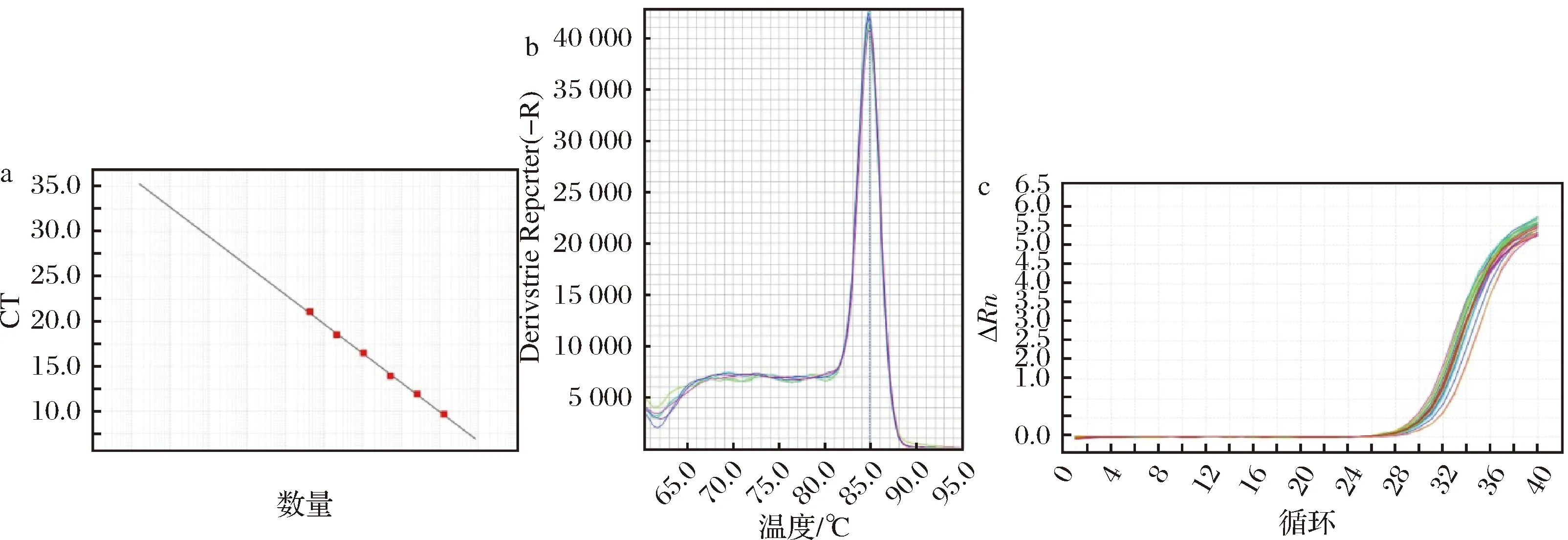
a-標準曲線;b-熔解曲線;c-擴增曲線圖5 腸球菌屬熒光定量PCR結果Fig.5 Enterococcus qPCR results
3 結論與討論
不同品牌的雞蛋蛋殼表面菌落總數在貯存初期介于9.315×102~1.367×104CFU/個[4],隨著貯藏時間的變化呈上升趨勢,貯藏時間越長受污染的程度越大[18]。然而蛋殼表面的菌群多種多樣,只有少部分是致病菌,一些正常菌群的增加似乎起到了避免雞蛋被致病菌定植,防止雞蛋腐敗變質的作用[22-23]。采用DGGE分析的方法與傳統微生物培養的方法,所測得的細菌總數和多樣性也不盡相同[24]。
在美國雞蛋的貨架期通常被限定為45 d[19],國內銷售的散裝雞蛋目前大多沒有標注生產日期,盒裝品牌雞蛋的保質期根據儲藏溫度也有所不同,通常在30~60 d且尚未有完善的雞蛋貨架期標準。此次通過熒光定量PCR的方法發現,4種蛋殼表面的優勢菌屬數量隨著儲存時間的變化各不相同,其中葡萄球菌屬、乳酸桿菌屬數量在儲存的前14 d呈現增多的趨勢,14 d后則下降。鏈霉菌屬數量整體呈上升趨勢,而腸球菌屬數量在儲存28 d 后呈下降趨勢。葡萄球菌屬是蛋內發現的主要細菌之一,除此之外還有鏈球菌、大腸桿菌、變形桿菌、假單胞菌和沙門氏菌等均能引起禽蛋不同程度的腐敗變質[20]。蛋殼表面葡萄球菌屬數量的增多與蛋內葡萄球菌的污染是否有關有待進一步研究。乳酸桿菌屬適宜在厭氧的環境下生長,此次實驗結果也顯示蛋殼表面的乳酸桿菌屬數量先增加后減少。有研究顯示乳酸菌能夠抑制某些腐敗菌引起的產膜、變色和使汁液渾濁等腐敗現象的發生[25],除此之外,鏈霉菌也具有一定的抗菌活性[21],此次實驗結果中鏈霉菌屬數量的增加是否與抑制其他細菌的生長有關還需要進一步驗證。蛋殼表面乳酸桿菌屬和鏈霉菌屬的數量在3個地區間無統計學差異,也許可以反映鮮雞蛋在儲存過程中品質變化的真實情況。由于我們的樣品數量有限, 4種優勢菌屬的統計學規律還有待進一步研究。

