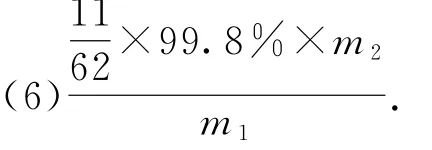高考化學試題中工藝流程題的特點分析及解題策略
◇ 山東 張劍鋒
工藝流程題是將工業生產中的主要階段以框圖形式抽象出來,以背景的形式出現在試題中,結合中學化學知識步步設問,綜合考查學生的基礎知識、基本技能、學科思想、學科素養.在高考試卷中占有較大比重,綜合性較強,難度大,考生得分往往比較困難.本文結合2020年全國理綜卷Ⅰ化學試題加以分析.
1 試題特點
縱觀近幾年高考試題,工藝流程題主要選擇以過渡元素為背景元素,結合物質的制備和分離考查元素化合物性質、平衡移動原理、電解質溶液、電化學、物質分離提純實驗操作、物質循環使用以及有關計算.
2 典例分析
例(2020年全國卷Ⅰ)釩具有廣泛用途.黏土釩礦中,釩以+3、+4、+5價的化合物存在,還包括鉀、鎂的鋁硅酸鹽以及Si O2、Fe3O4.采用圖1所示工藝流程可由黏土釩礦制備NH4VO3.
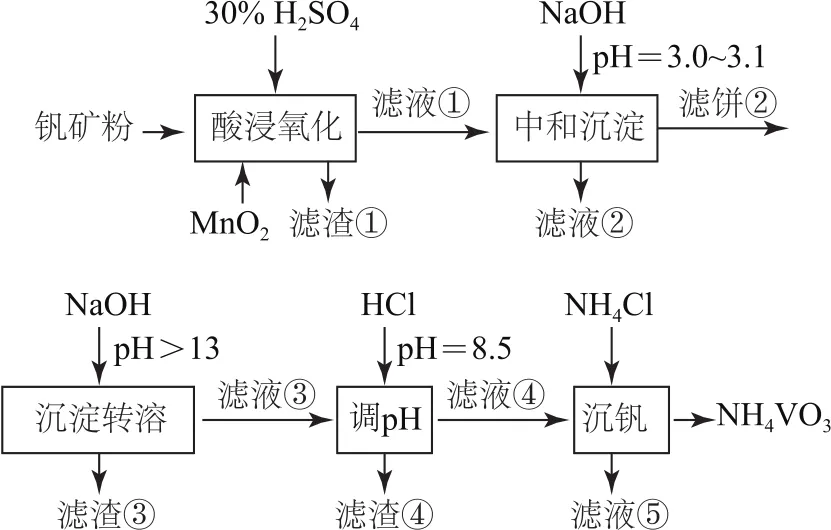
圖1
該工藝條件下,溶液中金屬離子開始沉淀和完全沉淀的p H如表1所示.
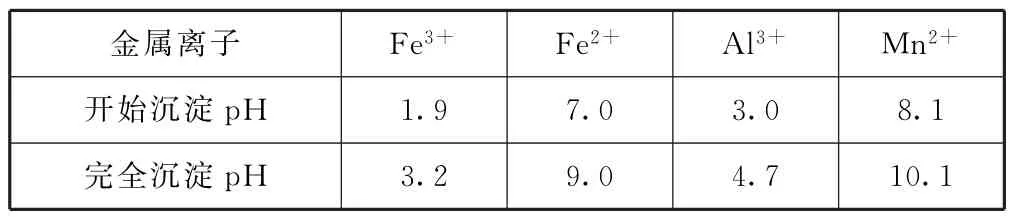
表1
回答下列問題:
(1)“酸浸氧化”需要加熱,其原因是________.
(2)“酸浸氧化”中,VO+和 VO2+被氧化成V,同時還有________被氧化.寫出VO+轉化為V反應的離子方程式________.
(3)“中和沉淀”中,釩水解并沉淀為 V2O5·xH2O,隨濾液②可除去金屬離子 K+、Mg2+、Na+、________,以及部分的________.
(4)“沉淀轉溶”中,V2O5·xH2O 轉化為釩酸鹽溶解.濾渣③的主要成分是________.
(5)“調p H”中有沉淀生成,生成沉淀反應的化學方程式是________.
(6)“沉釩”中析出NH4VO3晶體時,需要加入過量NH4Cl,其原因是________.
分析比較原料和產品,結合中間流程、表格數據和第(2)(3)(4)問中的相關信息,根據元素守恒和物質轉化基本規律,得出釩的變化路徑是:釩礦粉先酸溶為VO+和VO2+,后氧化為VO+2,然后“中和沉淀”為V2O5·xH2O,再“沉淀轉溶”為 Na VO3,最后“沉釩”為NH4VO3;鉀、鎂硫酸鹽易溶于水,“酸浸氧化”后進入濾液①,再“中和沉淀”后進入濾液②;鋁的變化是:鋁硅酸鹽被硫酸溶解為Al3+,然后進入濾液①,再經Na OH調節p H=3.0~3.1后一部分進入濾液②,一部分變成Al(OH)3進入濾餅②(聯系表格信息中Al3+沉淀的p H范圍),濾餅②中的Al(OH)3再經過Na OH調節p H>13變為[Al(OH)-4]進入濾液③,最后再經HCl調節p H變成Al(OH)3,進入濾渣④;鐵的變化為Fe3O4酸溶為Fe3+和Fe2+,Fe2+再被氧化為Fe3+,經“中和沉淀”一部分生成Fe(OH)3進入濾餅②,一部分進入濾液②(聯系表格信息中Fe3+沉淀的p H范圍),濾餅②中的Fe(OH)3經過沉淀轉溶環節進入濾渣③;Mn的變化為Mn O2被還原為Mn2+,再經Na OH調節p H=3.0~3.1后進入濾液②.
答案(1)加快酸浸和氧化反應速率(促進氧化完全).
(2)Fe2+;
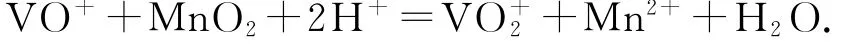
(3)Mn2+;Al3+和Fe3+.
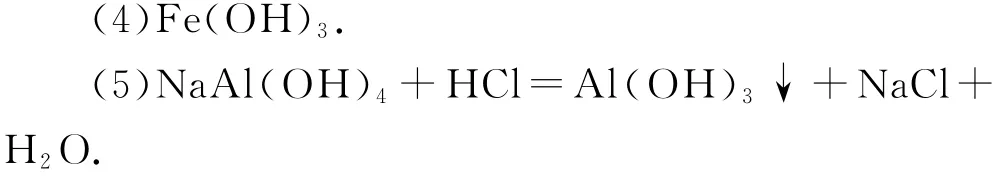
(6)利用同離子效應,促進NH4VO3盡可能析出完全.
點評
該題的難點是物質的轉化和推斷,在審題中要注意前后聯系,可采取先粗讀后細讀的方式,將附加信息或隱藏在題干或設問中的信息圈畫出來,用箭頭指向相關環節,進行推理.抓住一種元素進行追蹤,可以簡化分析問題的復雜性和難度.本題考查的是條件控制,是變化的觀念,第(2)問和第(5)問兩處考查了方程式的書寫,體現的是宏觀辨識與微觀探析以及符號表達;第(3)(4)問考查物質轉化和混合物分離,體現的是變化觀念與守恒思想;第(6)問考查平衡原理在物質轉化和分離中的應用.氧化還原理論和氫氧化鋁的兩性是必備知識.該題綜合考查考生的綜合分析判斷能力、信息挖掘和應用能力、閱讀理解能力、陌生方程式的書寫能力等.
3 思維模型
解題中可以形成如圖2所示的思維模型.
1)審題頭,明確原料和生產目的.
2)審流程,看箭頭,明確反應條件、原理及物質成分的分離、提純方法的選擇.
3)審問題,看考查的是反應方程式的書寫,還是平衡原理的應用,或者是物質的判斷及相關的計算,然后認真作答.
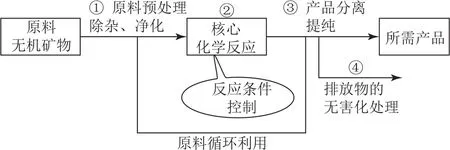
圖2
4 高考的命題規律及設問方向
高考工藝流程題常以“以自然資源為原料制備無機物”或“從工業廢料中分離提純無機物”為載體進行考查.
1)無機化學基礎知識(物質的類別、名稱、元素的化合價、化學式和電子式的規范書寫).
2)基本技能(陌生化學方程式、離子方程式、電極反應式的書寫、離子交換膜的選擇;分離提純規范操作等).
3)識圖能力(物質的轉化與跟蹤);表格數據的分析能力;圖象工藝條件的選擇.
4)物質制備及提純條件的控制(提高反應速率、產率或轉化率、產品純度的措施).
5)基本計算(產品化學式、含量及純度、氧化還原反應中電子轉移數目的計算等).
5 破解策略
5.1 循環物質的確定
1)從流程圖上看:箭頭回頭的是循環物質.
2)從物質的轉化上看:在流程中加入的物質,參與反應后續步驟中又會產生(在濾渣或濾液中尋找)的物質是循環物質.
5.2 副產物的判斷
1)從流程圖上看:支線產品就是副產物.
2)從制備的目的上判斷:不是主產品的是副產物.
5.3 濾渣、濾液中成分的確定
要考慮樣品中原料和雜質的成分在每一個步驟中與每一種試劑反應的情況:
1)反應過程中哪些物質(離子)消失了(每種沉淀劑沉淀了哪些離子)?
2)所加試劑是否過量或離子間發生化學反應,又產生了哪些新離子?要考慮這些離子間是否會再發生反應.
此外,聯系設問回讀題目也很重要,有時單獨看題干信息,會有好多環節弄不清楚,很容易產生焦躁心理,甚至放棄解題.如果仔細把題目讀完,會發現有好多信息蘊藏在設問中,沒有這些信息的支持,題目很難讀懂,這樣就對考生的閱讀能力提出了較高要求,這也符合考試大綱中的基本思想,考生要引起足夠重視.
當然有時候,對于流程圖中個別環節即使沒有弄清,一般也不影響設問的作答,在考場上,考生一定不要在此糾結,以免浪費寶貴時間,影響考試時的發揮.
工藝流程題中開始的幾個小問題,很多時候與題干信息沒有多大聯系,可以直接作答,考試中應該先答上,千萬不要因為感覺題目過難就全盤放棄.
拓展硼及其化合物在工業、醫藥、農業等部門有許多用途.某工廠以鐵硼精礦(主要成分為B2O3·2 Mg O,還有Si O2、Ca O、Fe O等雜質)制取硼酸、金屬鎂的工藝流程如圖3所示.
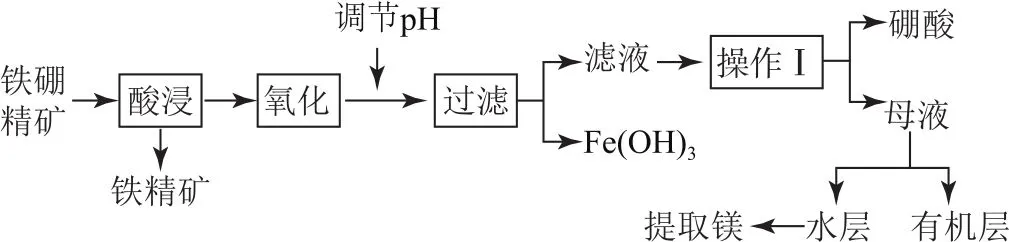
圖3
已知:硼酸在不同溫度下的溶解度見表1.
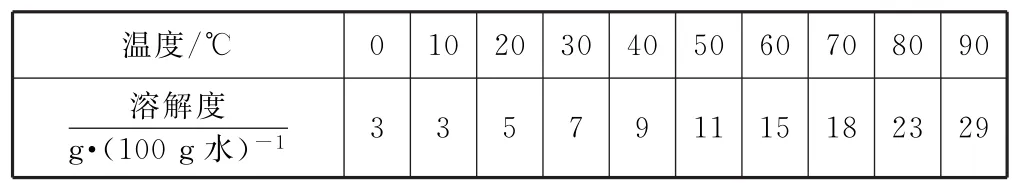
表1
回答下列問題:
(1)使用鹽酸酸浸,過程中主要反應的化學方程式為________,為提高浸出速率,可采取的措施有________(寫出兩條).
(2)酸浸時,溫度與硼浸出率的關系如圖4所示,則合適的酸浸溫度為________.
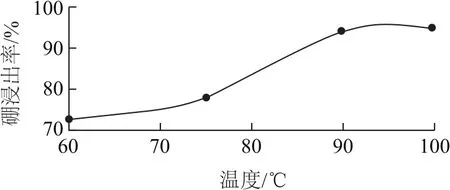
圖4
(3)浸出液“氧化”步驟是將溶液中的Fe2+用________試劑氧化為Fe3+,反應的離子方程式為________.
(4)從濾液中獲得H3BO3晶體的“操作Ⅰ”具體操作是________.
(5)向濾液中加入有機萃取劑萃取分液,此時硼酸處于________層中(填“有機”或“無機”).實驗室模擬“萃取”操作使用的玻璃儀器除燒杯外,另一主要玻璃儀器是________.
(6)某工廠用m1kg的鐵硼精礦制備硼酸,得到純度為99.8%的硼酸m2kg,則鐵硼精礦中硼的質量分數是________(列式表達).
分析先看原料和產品,依據元素守恒和對應元素化合物的性質可知,“硼酸”是硼的去向,“提取鎂”是鎂的去向,“鐵精礦”和“Fe(OH)3”是鐵的去向,Si O2不溶于酸,去了鐵精礦中,“Ca O”溶于鹽酸變成了Ca Cl2,與Mg Cl2一起進入“母液”,通過萃取分離.氧化和調p H 是為了將Fe2+氧化為Fe3+再變成Fe(OH)3沉淀除去;第(4)問應“回讀”前面“硼酸在不同溫度下的溶解度”表格,想到蒸發濃縮、冷卻結晶、過濾;結合設問(5)分析有機層中還有一部分H3BO3.
答案(1)B2O3·2 Mg O+4 HCl+H2O=2 H3BO3+2 Mg Cl2;適當增加鹽酸濃度、提高反應溫度、減小鐵硼礦粉粒徑、充分攪拌等.
(2)90~95℃(寫此范圍內的任意溫度均可).
(3)H2O2;2 Fe2++H2O2+2 H+=2 Fe3++2 H2O(寫氯氣也可以得分,2 Fe2++Cl2=2 Fe3++2 Cl-).
(4)蒸發濃縮、冷卻結晶、過濾.
(5)有機;分液漏斗.