凝血-纖溶失衡評價在預測維持性血液透析患者血管通路栓塞中的應用價值
王 穎,白若鑰
1.陜西省友誼醫院(西安710068);2.陜西省延安市人民醫院(延安716000)
近年來,接受維持性血液透析的終末期腎病患者逐漸增多,血管通路是確保透析效果和改善預后的生命線,然而,治療中血管通路栓塞的發生率較高,對患者的預后影響較大[1]。盡管絕大多數情況下,經皮血管腔內球囊擴張成形術可治療血管通路栓塞,但術后血管通路通暢情況是透析效果的重要影響因素。血管通路是否通暢,可能受炎癥、血栓形成和移植物選擇等因素影響。血栓形成前通常處于一種凝血-纖溶失衡狀態,逐漸可進展為血管通路栓塞,其機制尚未完全闡明[2-3]。Milburn等[4]以凝血酶-抗凝血酶復合物(Thrombin-antithrombin complex,TAT)作為凝血功能的敏感標志物,發現70例維持性血液透析患者血清TAT水平明顯升高,與血管通路通暢率呈負相關。與此同時,凝血-纖溶失衡可抑制纖溶功能,亦可導致高凝狀態,其中內皮細胞功能障礙是抑制纖溶蛋白溶解的主要原因。血漿纖溶酶-α2纖溶酶抑制物復合物(Plasminase-alpha 2 plasminase inhibitor complex,PIC)被公認為反映血漿纖溶酶含量的有效纖溶指標[5]。TAT/PIC比值亦可用于反映凝血后纖溶反應,評估凝血-纖溶失衡程度,有望在預測血管通路栓塞上取得突破性進展。本研究目的在于分析TAT、PIC、TAT/PIC比值、纖維蛋白降解產物(FDPs)等標志物是否與血管通路栓塞有關,探討凝血-纖溶失衡對預測維持性血液透析患者血管通路栓塞的效能。
資料與方法
1 一般資料 選擇我院自2016年1月至2017年6月接診的183例維持性血液透析患者作為研究對象,其中男101例,女82例;年齡21~73歲,平均年齡(62.47±7.83)歲;透析齡4個月至16年,平均(4.27±0.68)年;體質量指數20~28 kg/m2,平均(22.47±1.59) kg/m2;病因:糖尿病腎病90例、腎小球腎炎51例、腎硬化25例、多囊腎疾病8例、其他9例;血管通路類型:動靜脈瘺139例、動靜脈移植44例;位置:前臂158例、上臂25例;球囊類型:常規類型125例、切割類型49例、防滑類型9例。病例納入標準:擬行血管通路干預;彩超檢出至少一個狹窄病變<7 cm,狹窄率≥50%,血流量減少,血流阻力指數增大;經醫院倫理委員會批準通過,患者及其家屬知悉研究內容并簽署知情同意書,承諾配合治療和隨訪。排除標準:年齡<18歲或>80歲者;入組前1周發現狹窄病灶合并血栓形成、凝血功能障礙、敗血癥、血管通路感染和血栓性閉塞者;既往長期接受紅細胞生成刺激劑或抗血小板藥物治療者。
2 研究方法 在研究開始時血管通路干預前,采用彩色多普勒超聲檢查,測定內瘺血流量和血流阻力指數,這是反映血管通路通暢的重要參數。在建立血管通路時采集血樣5 ml,離心分離血漿進行凝血和纖溶功能檢測,以凝血酶-抗凝血酶復合物(TAT)和纖溶酶-α2纖溶酶抑制物復合物(PIC)分別為凝血功能和纖溶功能的標志物,采用酶免疫分析法檢測TAT(正常參考水平≤3.0 ng/ml),乳膠光度免疫分析法檢測PIC(正常參考水平≤0.8 μg/ml),乳膠免疫測定法檢測FDPs(正常參考水平≤4.0 μg/ml)和凝血酶原時間-國際標準化比值(PT-INR),計算TAT/PIC比率。將剩余血漿和血清樣品放置在-80℃冰箱中,待測;采用酶聯免疫吸附法檢測血清炎癥標志物:C反應蛋白、腫瘤壞死因子α和白細胞介素-6,其他因素均用常規分析法測定,納入本研究的協變量包括年齡、性別、透析齡、合并癥、體質量指數和各生物學參數。
3 隨訪及觀察指標 隨訪6~21個月,以定期回院復查、治療或電話聯系的方式隨訪,以血管通路栓塞為隨訪終點,如血運重建或通路維護;比較血管通路栓塞組與血管通路通暢組患者的臨床特征,包括性別、年齡、透析齡、體質量指數、收縮壓、糖尿病、血管通路情況(動靜脈移植、血流量、流量和阻力指數)、血細胞(白細胞、血紅蛋白、血小板)、凝血纖溶指標(TAT、PIC、PT-INR、FDPs)、血清指標(白蛋白、肌酸酐、尿素氮、鈣、磷、堿性磷酸酶、C反應蛋白、白細胞介素-6和腫瘤壞死因子α)。

結 果
1 血管通路栓塞組與血管通路通暢組臨床特征比較 所有患者均獲得隨訪,平均隨訪(12.84±5.67)個月,發生血管通路栓塞65例,血管通路栓塞組平均隨訪(14.52±4.93)個月,血管通路通暢組平均隨訪(12.23±5.98)個月;血管通路栓塞組與血管通路通暢組在動靜脈移植比例、流量、阻力指數、血漿TAT、PIC 、TAT/PIC比值、FDPs水平上比較差異均有統計學意義(P<0.05),見表1。
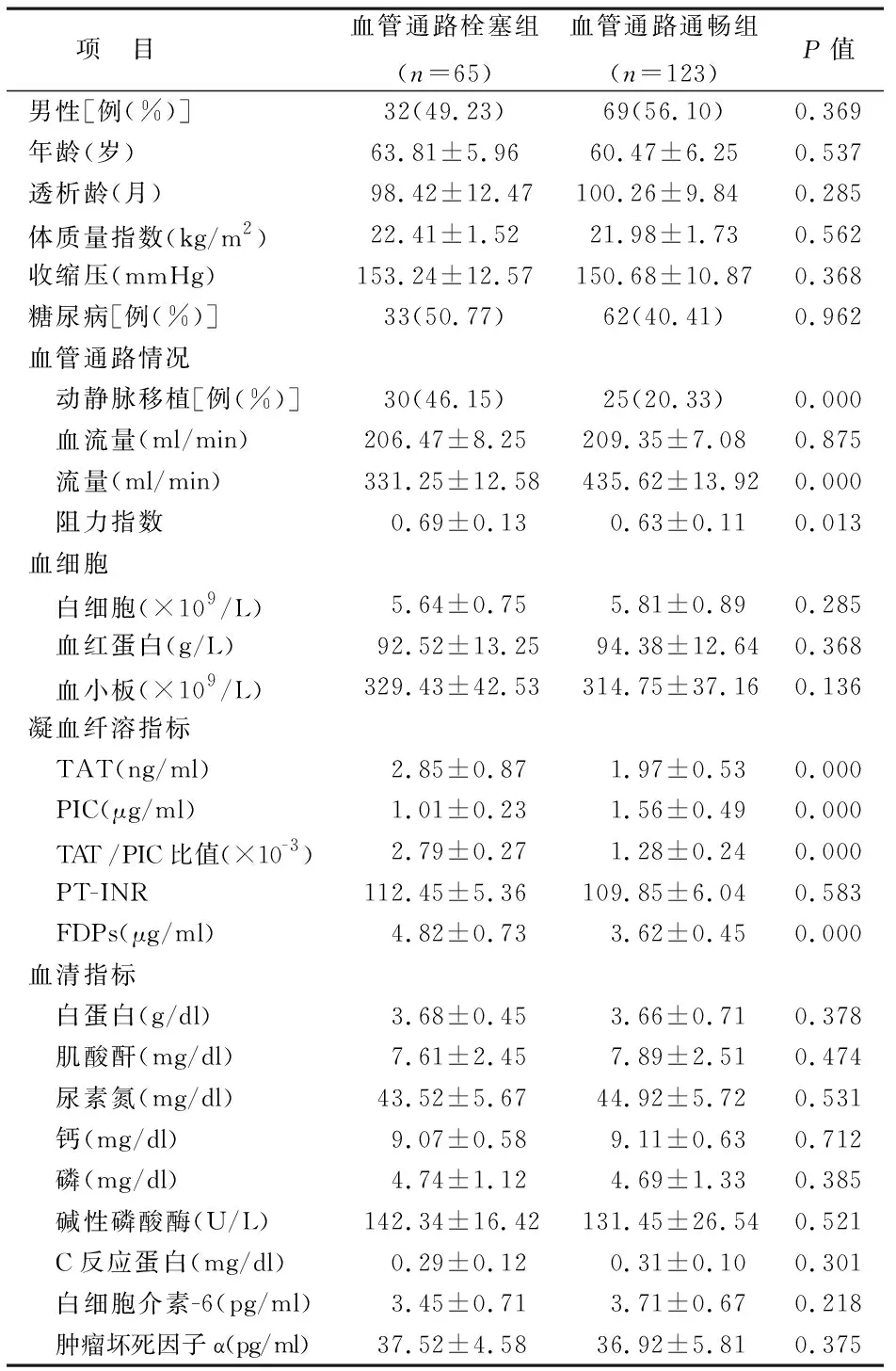
表1 血管通路栓塞組與血管通路通暢組的臨床特征比較
2 維持性血液透析患者血管通路栓塞的獨立危險因素分析 COX多因素回歸分析,動靜脈移植、流量和TAT/PIC比值均是血管通路栓塞的獨立危險因素(P<0.05),見表2。
3 凝血-纖溶失衡對預測血管通路栓塞的效能分析 ROC曲線分析,TAT/PIC比值預測血管通路栓塞的AUC為0.894(最佳截斷點值:4.19,標準誤:0.078,漸進Sig:0.004,95%CI:0.000~1.000),明顯大于流量的0.611(最佳截斷點值:352,標準誤:0.093,漸進Sig:0.414,95%CI:0.330~0.892),差異有統計學意義(Z=2.332,P=0.020),見圖1。
4 血管通路通暢率的生存曲線分析 TAT/PIC比值≥4.19×10-3患者21個月累計血管通路暢通率為34.17%,明顯低于TAT/PIC比值<4.19×10-3患者的75.86%,經Log-Rank檢驗,差異有統計學意義(χ2=5.015,P=0.025),見圖2。
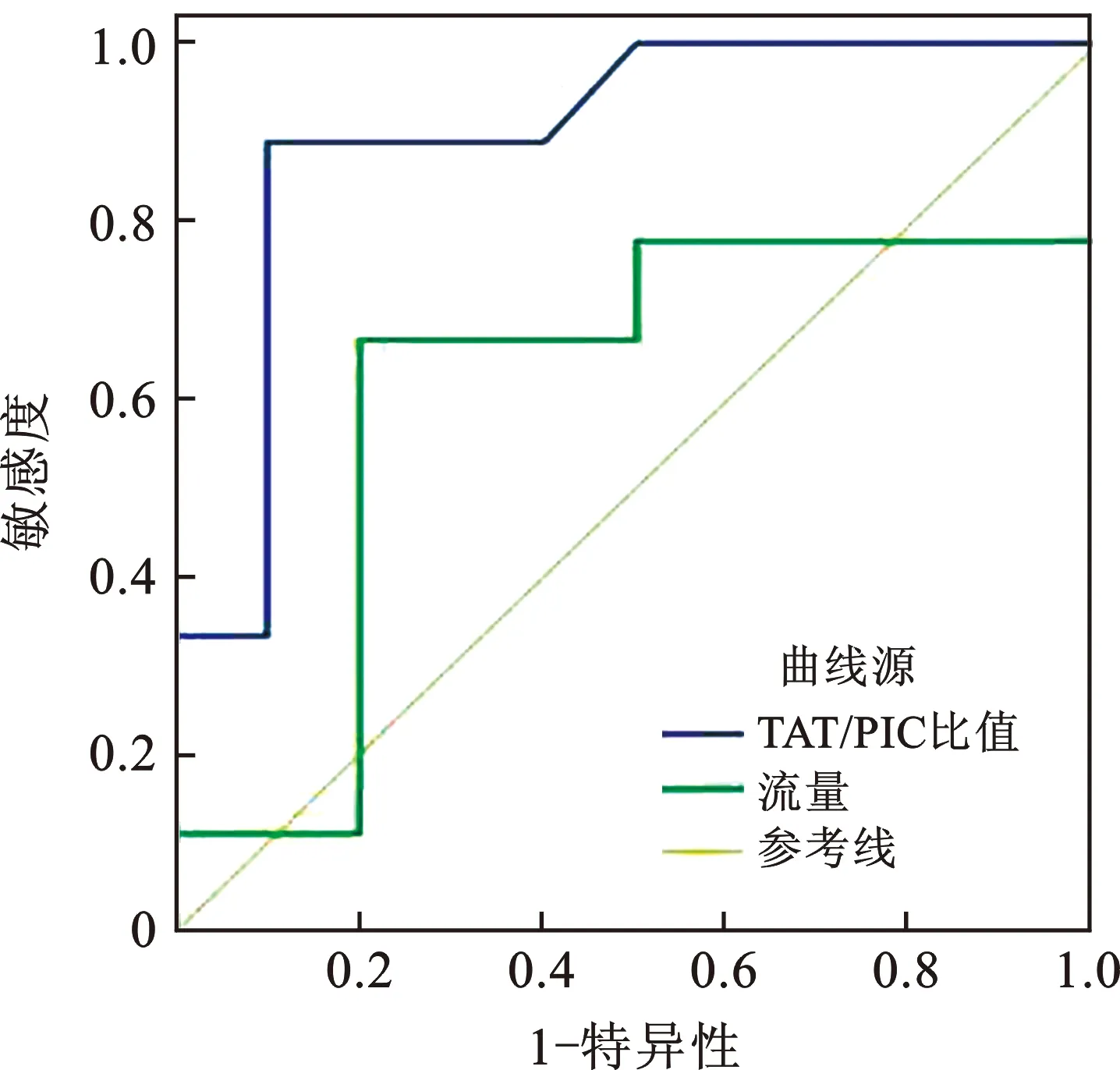
圖1 TAT/PIC比值和流量預測血管通路栓塞的ROC曲線
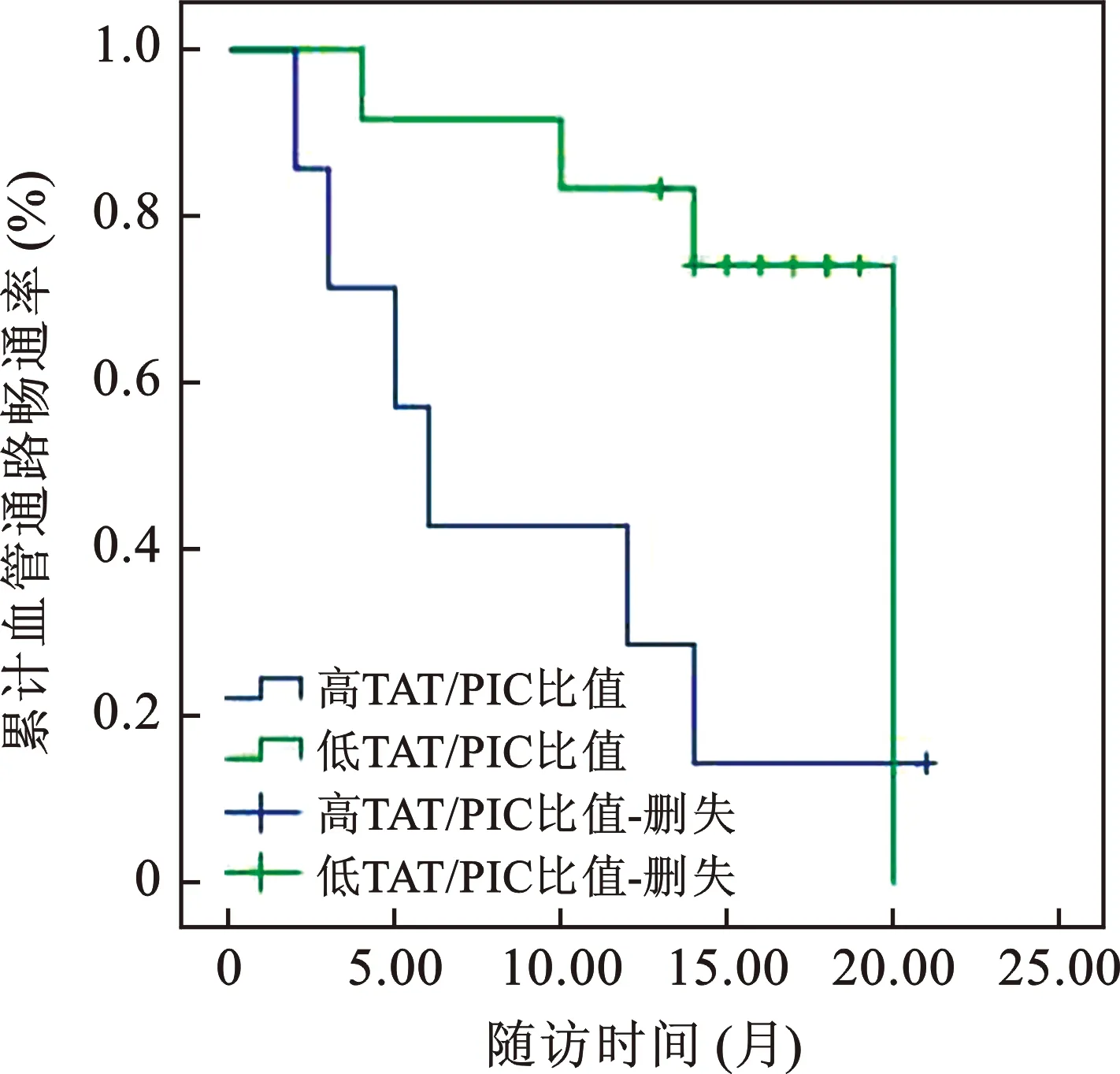
圖2 Kaplan-Meier法分析不同TAT/PIC比值患者血管通路暢通率差異
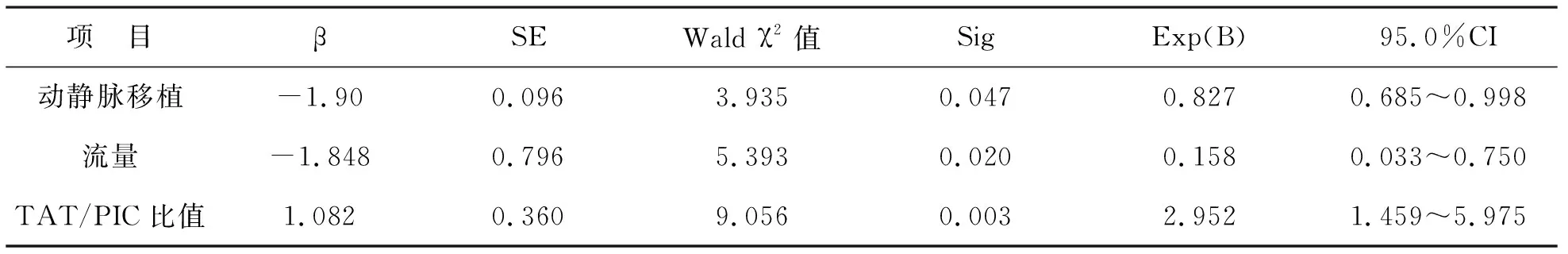
表2 維持性血液透析患者血管通路栓塞的獨立危險因素分析
討 論
長期血液透析使終末期腎病患者血管內皮細胞功能受損,進一步引起機體凝血、纖溶系統異常,導致凝血-纖溶失衡,與血小板異常、貧血、抗凝劑使用等因素一起,可能對血管通路血栓形成的發生有影響[6]。TAT是反映凝血系統激活的分子標志物,PIC是反映纖溶成分激活的分子標志物,TAT/PIC比值被用于評價凝血-纖溶失衡[7-8]。由于凝血-纖溶失衡與長期血液透析患者血管通路栓塞之間有無因果關系,能否采取措施預防,均尚未形成統一定論。本研究采取前瞻性研究,目的在于觀察維持性血液透析患者的凝血-纖溶失衡和血管通路栓塞情況,分析TAT/PIC比值對血管通路栓塞的預測效能,有望為及時采取預防措施提供證據支持。
從本研究表1結果可知,血管通路栓塞組與血管通路通暢組在動靜脈移植比例、流量、阻力指數、血漿TAT、PIC、TAT/PIC比值、FDPs水平上差異均有統計學意義,提示長期血液透析患者血管通路栓塞可能與血管通路類型、血流動力學、高凝狀態及纖溶障礙有關。究其原因,考慮在于上述原因均是血管通路血栓形成的危險因素。任紅旗等[9]研究表明,隨著透析齡延長,動靜脈移植比例逐漸升高,術后血管通路栓塞的風險亦隨之增大。Hideo等[10]研究顯示,血管通路流量小、阻力指數大,均是影響維持性血液透析患者血管通路使用壽命的重要因素。與上述研究結果相似的是,本研究發現血管通路類型和血流動力學均是影響長期血液透析患者血管通路通暢性的重要因素,但并不能解釋血管通路栓塞的根本原因。國外研究表明,維持性血液透析患者是血栓栓塞性疾病的高危人群,認為原因與血小板聚集功能增強、血管內皮細胞損傷和貧血等因素有關[11]。由此筆者推測,凝血和纖溶異常,可能是維持性血液透析患者血管通路栓塞的主要原因。本研究發現發生血管通路栓塞的維持性血液透析患者血漿TAT水平升高,PIC水平降低,必然會減弱機體抗凝作用,加劇高凝狀態,使患者有發生血栓的危險。也有研究認為,長期血液透析患者在血管通路栓塞時血漿PIC水平并非較正常時明顯升高[12],與本研究結果不同,原因可能與兩項研究對象的抗血小板藥物使用情況及凝血機能亢進程度存在差異有關。
本研究還發現,動靜脈移植、流量和TAT/PIC比值均是血管通路栓塞的獨立危險因素,說明維持性血液透析患者預后受多種因素影響。由于動靜脈移植、流量均與維持性血液透析患者血管通路使用現狀有關,在臨床上可給予改進,對于減少血栓栓塞具有積極作用。而TAT/PIC比值是反映凝血-纖溶失衡的敏感且特異指標,本研究通過COX多因素回歸分析顯示,維持性血液透析患者TAT/PIC比值增大,血管通路栓塞風險隨之顯著增大,與付陽等[13]研究表明TAT/PIC比值增大時,維持性血液透析患者纖溶功能明顯受損、血管通路栓塞風險增大的這一觀點相符。究其原因,可能與維持性血液透析進一步加重了終末期腎病患者原有的高凝狀態和纖溶異常有關。在血液透析過程中透析膜直接與血液接觸,不僅激活內源性凝血途徑,還可能損傷血管內皮細胞,導致凝血酶增多,而TAT是凝血過程的最終產物,有效反映凝血酶生成量[14]。與此同時,血液透析過程中纖溶缺陷不僅與患者高胰島素血癥、脂類異常、高同型半胱氨酸血癥有關,還與PIC過度釋放有關,必然加劇機體纖溶功能異常。由此可見,隨著維持性血液透析年齡增大,患者往往存在凝血-纖溶失衡,增大血管通路栓塞風險。正如Saigusa等[5]發現終末期腎病患者在一次血液透析后血漿中TAT水平明顯升高,PIC水平隨之降低。其他學者的研究也發現終末期腎病患者存在高凝狀態和血小板凝集功能亢進及繼發纖溶拮抗,透析過程則加重上述變化,導致血管通路栓塞發生[15]。
關于維持性血液透析患者的凝血-纖溶失衡原因,喬偉等[16]研究表明,在創傷、出血性疾病和終末期腎病的實驗模型中,均觀察到凝血酶激活纖溶抑制途徑。也有研究顯示,在接受血液透析的慢性腎病或腹膜透析的終末期腎病患者中存在不同程度的纖溶酶活性受損[17]。筆者認為,在終末期腎病患者中,纖溶酶分泌被拮抗,通過凝血誘導的纖溶反應降低,這可能是由于抑制了部分纖溶的生物啟動。迄今為止,國內外臨床均尚缺乏大型前瞻性研究分析凝血-纖溶失衡對血管通路栓塞的影響。從本研究的ROC曲線分析結果可知,TAT/PIC比值預測血管通路栓塞的AUC為0.894,明顯大于血管通路流量的0.611,說明TAT/PIC比值預測血管通路栓塞的效能較好,與王立華等[18]的研究相符。究其原因,考慮為凝血-纖溶失衡不僅抑制纖溶,還形成高凝狀態,降低血管通路流量,增大血栓形成風險,導致血管通路栓塞發生。與此同時,本研究發現TAT/PIC比值預測血管通路栓塞的最佳截值為4.19,且TAT/PIC比值≥4.19×10-3患者血管通路暢通率明顯低于TAT/PIC比值<4.19×10-3患者;說明TAT/PIC比值升高的患者預后較差,原因在于維持性血液透析患者在高凝狀態下血管通路內易形成微血栓,不僅影響透析充分性,還增大血管通路內殘留血量,減小血管通路流量,加上纖溶功能障礙,易形成血栓,成為血管通路栓塞的高危人群。國內外研究已證實,維持性血液透析患者血管通路栓塞與某些凝血因子增多和纖溶活性降低有關[19-20]。
綜上所述,凝血-纖溶失衡是導致維持性血液透析患者血管通路栓塞的重要危險因素,血漿TAT和PIC均可能是血管通路栓塞的有效標志物,TAT/PIC比值預測血管通路栓塞的效能較好。本研究的創新點在于觀察了維持性血液透析患者凝血纖溶與血管通路栓塞的關系,為合理選擇血管通路、使用抗凝劑和促紅素提供證據支持。當然,本研究亦存在不足之處:首先這是一項單中心觀察性研究,難以推廣至所有接受長期血液透析的患者;其次,本研究只評估了一次TAT/PIC比值,在不同治療階段可能會有所不同;第三,未能排除血管通路特征、用藥、病因等危險因素的潛在影響;有待日后擴大研究規模,深入分析維持性血液透析患者并發凝血-纖溶失衡的病理機制,探討TAT/PIC比值與動靜脈移植、流量的關系,為臨床制定延長血管通路使用壽命的診治措施提供依據。

