肝癌手術(shù)患者DYRK2表達水平對臨床預后的預測價值研究
程偉華 盧振華 趙利鋒 呂高波
肝細胞癌(hepatocellular carcinoma,HCC)主要采取手術(shù)切除、射頻消融、化療和靶向治療等,但復發(fā)率高、遠期生存期低[1]。因此尋找HCC的預后標志物對制定治療方案、降低復發(fā)風險、提高遠期生存率具有重要的臨床價值。雙特異性酪氨酸磷酸化調(diào)節(jié)激酶-2(dual-speci city tyrosine-(Y)-phosphorylation-regulated kinase-2,DYRK2)是DYRK家族成員之一。與多種實體瘤的腫瘤生物學行為和預后密切相關(guān)[2]。但DYRK2對HCC患者臨床預后的影響目前尚未報道。本研究主要探討DYRK2蛋白在預測HCC患者術(shù)后生存期的臨床價值。
資料與方法
一、研究對象
本研究納入了2010年1月至2015年12月期間在我院接受根治性手術(shù)的158例HCC患者。納入標準:(1)原發(fā)性HCC,并經(jīng)病理確診;(2)接受根治性手術(shù)切除;(3)術(shù)前未接受化療或靶向治療。排除標準:(1)轉(zhuǎn)移性HCC;(2)HCC復發(fā);(3)術(shù)前接受其他治療。158例患者的平均年齡為(58.3±12.4)歲,男性103例、女性55例。本研究經(jīng)本院倫理委員會討論通過,并經(jīng)患者簽署知情同意書。
二、免疫組化染色
將HCC患者的癌組織及癌旁組織的石蠟包埋樣本進行4 μm連續(xù)切片,經(jīng)二甲苯、酒精梯度洗脫,切片脫蠟至水化,加入3%過氧化氫孵育5 min。自來水沖洗后,PBS浸泡3 min,加入含5%的山羊血清封閉,室溫孵育10 min,加入1∶100稀釋的抗DYRK2多克隆抗體(貨號:ab37912,Abcam公司,美國),4℃孵育過夜。PBS沖洗3次,再加入辣根過氧化物酶標記的羊抗鼠IgG二抗,37℃孵育30 min,PBS沖洗3次,DAB顯色,自來水充分沖洗、復染、封片。
三、免疫組化分析
由2名病理科醫(yī)師獨立進行,評估內(nèi)容包括陽性率評分和染色強度評分,病理科醫(yī)師對患者臨床資料和預后情況均不知情。陽性率評分:每個樣本隨機選擇5個視野,在200倍視野下測定陽性(棕色)細胞占總細胞百分比為陽性率并取平均值,以<10%陽性率為0分、10%~30%陽性率為1分、30%~50%陽性率為2分、50%~70%陽性率為3分、>70%陽性率為4分。染色強度評分:根據(jù)陽性細胞的棕色染色強度,分為0分(無染色)、1分(弱染色)、2分(中等染色)、3分(強染色)。DYRK2的最終評分為陽性率評分與染色強度評分的乘積,范圍為0~12分,其中0~4分定義為低表達、5~12分定義為高表達。
四、術(shù)后隨訪
所有HCC患者出院通過門診隨訪,隨訪內(nèi)容包括病史、體格檢查、CT或MRI等腹部影像學檢查,術(shù)后1年內(nèi)每3個月一次,術(shù)后1年后每6個月一次。以手術(shù)日期至確診復發(fā)日期為無進展生存期(progress-free survival,PFS),以手術(shù)日期至死亡日期為總生存期(overall survival,OS)。最后一次隨訪時間為2018年9月30日。
五、統(tǒng)計學分析
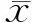
結(jié) 果
一、DYRK2染色情況
見圖1。158例HCC患者的癌組織中DYRK2的組化評分顯著低于癌旁組織[(4.8±1.3)分 vs (9.6±2.2)分],P<0.001。

圖1 3例HCC患者癌與癌旁DYRK2染色的典型圖片。
二、DYRK2低表達與高表達患者的臨床資料比較
見表1。根據(jù)DYRK2染色評分,將158例HCC患者分為低表達組(≤4分,95例)和高表達組(≥5分,63例)。與DYRK2高表達組相比,DYRK2低表達患者中AFP>20 ng/mL、腫瘤直徑>5 cm、TNM III-IV期、復發(fā)患者比例更高(P<0.05);但兩組患者的年齡、性別、HBsAg陽性率、肝硬化比例和組織學分級等均無統(tǒng)計學差異。

表1 不同DYRK2表達水平患者的臨床及病理資料比較
三、DYRK2低表達與高表達患者的生存期比較
見圖2。與DYRK2高表達組患者相比,DYRK2低表達組患者的PFS和OS均明顯縮短(均P<0.001)。

圖2 不同DYRK2表達水平患者的PFS和OS生存曲線
四、影響HCC患者OS的獨立危險因素分析
見表2。單因素及多因素Cox回歸分析顯示,DYRK2低表達(HR=1.874,95%CI:1.521~2.339,P<0.001)和TNM III-IV期(HR=1.455,95%CI:1.210~1.782,P<0.001)是預測HCC患者OS縮短的獨立危險因素。

表2 影響HCC患者OS的單因素及多因素Cox回歸分析
討 論
DYRK2是DYRK家族的主要成員之一,該激酶家族對酪氨酸和絲氨酸/蘇氨酸位點均有磷酸化酶的活性[3]。DYRK2能夠與含有EDD、DDB1和VPRBP結(jié)構(gòu)域(即EDVP復合物)的E3連接酶結(jié)合,從而直接磷酸化目標蛋白,在調(diào)控細胞凋亡、DNA損傷修復和細胞周期中起到重要的作用[4]。如DYRK2可直接磷酸化p53蛋白的第46位絲氨酸而增強p53的促凋亡活性,從而誘導腫瘤細胞凋亡[5]。細胞周期過程中G1/S期轉(zhuǎn)換的失調(diào)將導致腫瘤的發(fā)生發(fā)展,而c-Jun/c-Myc蛋白的降解是G1/S期轉(zhuǎn)換的關(guān)鍵過程。有研究發(fā)現(xiàn)DYRK2能磷酸化c-Jun和c-Myc蛋白,從而加速c-Jun/c-Myc蛋白由泛素化介導的蛋白酶體降解過程,從而延長G1期而抑制腫瘤細胞增殖[6],提示DYRK2在腫瘤中起到抑制腫瘤增殖的作用。此外,DYRK2還能夠通過磷酸化Snail蛋白促進其降解而抑制乳腺癌和卵巢癌細胞的上皮間質(zhì)轉(zhuǎn)化[7],而上皮間質(zhì)轉(zhuǎn)化是腫瘤細胞惡性侵襲轉(zhuǎn)移的驅(qū)動步驟,這提示了DYRK2在腫瘤中可抑制轉(zhuǎn)移侵襲的發(fā)生。
在本研究中,我們發(fā)現(xiàn)DYRK2在HCC癌組織中呈現(xiàn)低表達狀態(tài),其表達水平顯著低于癌旁正常組織,這提示在HCC中DYRK2的表達水平受到抑制。同時我們還發(fā)現(xiàn)HCC患者的DYRK2表達降低與AFP水平、腫瘤直徑、TNM分期和術(shù)后復發(fā)相關(guān)。通過生存曲線分析發(fā)現(xiàn),DYRK2表達降低與HCC患者的PFS縮短和OS縮短密切相關(guān),進一步通過單因素和多因素Cox回歸分析證實DYRK2低表達是HCC患者總體預后不良的獨立危險因素,提示DYRK2的表達水平可作為預測HCC患者預后的良好指標。

