三種預(yù)防肝硬化食管胃靜脈曲張?jiān)俪鲅椒ǖ膶?duì)比研究
林雪燕 林志輝
食管胃靜脈曲張出血(esophageal gastric varices bleeding,EGVB)是肝硬化嚴(yán)重并發(fā)癥,死亡率高達(dá)15%~20%[1]。超過(guò)60%的患者在首次出血后1-2年內(nèi)會(huì)再次發(fā)生靜脈曲張出血,病死率高達(dá)33%[2]。因此,預(yù)防再出血的二級(jí)預(yù)防是改善預(yù)后的關(guān)鍵。現(xiàn)就我院收治的101例肝硬化EGVB患者臨床資料進(jìn)行回顧性分析,比較藥物聯(lián)合內(nèi)鏡治療、TIPS治療及外科斷流術(shù)治療這三種二級(jí)預(yù)防措施的療效,從而為EGVB患者的二級(jí)預(yù)防選擇合適的治療方案。
資料與方法
一、研究對(duì)象
根據(jù)納入與排除標(biāo)準(zhǔn),選取2013年1月—2016年1月在福建省立醫(yī)院因肝硬化急性EGVB收住院的患者。納入標(biāo)準(zhǔn):①符合肝硬化急性食管胃靜脈曲張出血診斷的患者;②經(jīng)藥物保守治療(如補(bǔ)液、制酸、降門(mén)脈壓力等藥物)出血停止5 d后在我院行NSBB聯(lián)合內(nèi)鏡下硬化劑治療(endoscopic injection sclerotherapy,EIS)或 TIPS 或外科斷流術(shù)(賁門(mén)周?chē)茈x斷+脾切除術(shù)治療)治療;③術(shù)前均未行內(nèi)鏡治療、TIPS及外科斷流術(shù)治療。排除標(biāo)準(zhǔn):①排除患有惡性腫瘤性疾病、布加綜合征、合并嚴(yán)重心肺疾病及腎功能衰竭的患者;②排除實(shí)驗(yàn)室、影像學(xué)及內(nèi)鏡資料不完整的患者。根據(jù)納入及排除標(biāo)準(zhǔn)選取符合條件的病歷共 101例,根據(jù)治療方式分為內(nèi)鏡組(NSBB聯(lián)合EIS)、介入組(TIPS治療)及外科組(賁門(mén)周?chē)茈x斷+脾切除術(shù)治療)。
二、 材料與器材
內(nèi)鏡組:Olympus電子胃鏡,聚桂醇注射液(陜西天宇制藥有限公司),α-氰基丙烯酸正丁酯(北京康派特醫(yī)療器械有限公司),23G注射針(日本Olympus公司),組織膠注射針(北京康派特醫(yī)療器械有限公司)。
介入組:RUS-100穿刺系統(tǒng)(美國(guó)Cook公司),球囊擴(kuò)張導(dǎo)管(PTA-pro,美國(guó)Cook公司),Amplaz導(dǎo)絲(美國(guó)Cook公司),造影導(dǎo)絲及導(dǎo)管(泰爾茂,美國(guó) Cook 公司),10.00 mm×80.00 mm覆膜 Fluency支架(美國(guó)巴爾德公司),裸支架(Zilver,美國(guó)Cook 公司)。
三、治療方法
入院后均立即進(jìn)行補(bǔ)液、制酸、降門(mén)脈壓力等綜合治療,并密切監(jiān)測(cè)患者生命體征,完善血常規(guī)、肝腎功能、電解質(zhì)、血氨、上腹部增強(qiáng)CT、胃鏡等檢查,待出血停止5 d后進(jìn)一步行下述治療。
(一)內(nèi)鏡組 內(nèi)鏡下治療均由熟練的操作者實(shí)施,曲張的食管靜脈給予內(nèi)鏡下硬化劑治療(endoscopic injection sclerotherapy,EIS),曲張的胃底靜脈曲張給予內(nèi)鏡下組織膠注射。初次內(nèi)鏡下治療成功后,給予NSBB,且每2~4周復(fù)查胃鏡,對(duì)殘留曲張靜脈再次行內(nèi)鏡下治療直至靜脈曲張消失或基本消失。之后每6~12個(gè)月復(fù)查胃鏡,如發(fā)現(xiàn)靜脈曲張?jiān)俅涡袃?nèi)鏡下治療。
(二)介入組 TIPS術(shù)由熟練的操作者實(shí)施,超聲引導(dǎo)下行頸內(nèi)靜脈穿刺后進(jìn)入導(dǎo)絲,進(jìn)入導(dǎo)管測(cè)定下腔靜脈及肝靜脈壓力,RUS-100 穿刺系統(tǒng)彎曲成型后進(jìn)入肝靜脈,并選擇合適的穿刺平面及角度穿刺進(jìn)入門(mén)靜脈,予球囊擴(kuò)張定位后置入覆膜支架或雙支架(覆膜支架 + 裸支架),術(shù)后給予抗凝藥物應(yīng)用,根據(jù)情況予降低血氨藥物。術(shù)后第1月、第3個(gè)月及以后每6個(gè)月復(fù)查彩超,如發(fā)現(xiàn)分流道狹窄或閉塞則行球囊擴(kuò)張支架成型術(shù)或再次置入覆膜金屬支架。術(shù)后每6~12個(gè)月復(fù)查胃鏡了解靜脈曲張情況。
(三)外科組 術(shù)前禁食24 h,并行腸道準(zhǔn)備,手術(shù)方式選擇賁門(mén)周?chē)茈x斷+脾切除術(shù)。術(shù)后每6~12個(gè)月復(fù)查胃鏡了解靜脈曲張情況。
四、隨訪及療效觀察
根據(jù)電話隨訪直至研究終點(diǎn),隨訪時(shí)間為3年。研究終點(diǎn)包括患者死亡、并發(fā)惡性腫瘤、轉(zhuǎn)換治療方式及到達(dá)隨訪時(shí)間。無(wú)法與患者及家屬取得聯(lián)系者視為失訪。主要隨訪內(nèi)容為早期再出血、遠(yuǎn)期再出血、曲張靜脈消失情況、死亡情況和并發(fā)癥等。治療后30 d內(nèi)出血定義為早期再出血;治療后30 d以上至隨訪終點(diǎn)的出血定義為遠(yuǎn)期再出血;曲張靜脈完全消失是指治療內(nèi)鏡下完全看不到靜脈曲張,消化道黏膜呈現(xiàn)其基本色澤;曲張靜脈基本消失是后內(nèi)鏡下仍可見(jiàn)殘留的細(xì)小血管。本研究中曲張靜脈消失例數(shù)=曲張靜脈完全消失例數(shù)+曲張靜脈基本消失例數(shù)。
五、統(tǒng)計(jì)學(xué)方法
采用SPSS 23.0軟件進(jìn)行數(shù)據(jù)管理及統(tǒng)計(jì)學(xué)分析。計(jì)數(shù)資料采用χ2檢驗(yàn);計(jì)量資料,若滿足正態(tài)分布和方差齊性采用t檢驗(yàn),以平均值±標(biāo)準(zhǔn)差(x±SD)表示,否則采用Mann-Whitney秩和檢驗(yàn);繪制Kaplan-Meier生存曲線圖,比較三組遠(yuǎn)期生存情況;檢驗(yàn)標(biāo)準(zhǔn)P<0.05則差異有統(tǒng)計(jì)學(xué)意義。
結(jié) 果
一、 研究對(duì)象基本情況
本研究一共納入病例101例,其中內(nèi)鏡組38 例,介入組32 例,外科組31例。內(nèi)鏡組平均年齡(52.1±11.9)歲;男28例,女10例;其中乙型肝炎肝硬化28例,丙型肝炎肝硬化1例,酒精性肝硬化4例,其他原因肝硬化5例;其中Child-pugh分級(jí)A級(jí)17例,B級(jí)19例,C級(jí)2例。介入組平均年齡(51.4±10.2)歲;男22例,女10例;其中乙型肝炎病毒肝硬化26例,丙型肝炎病毒肝硬化1例,酒精性肝硬化2例,其他原因肝硬化3例;其中Child-pugh分級(jí)A級(jí)14例,B級(jí)16例,C級(jí)2例。外科組平均年齡(51.24±9.6)歲;男20例,女11例;其中乙型肝炎肝硬化24例,丙型肝炎肝硬化0例,酒精性肝硬化3例,其他原因肝硬化4例;其中Child-pugh分級(jí)A級(jí)17例,B級(jí)14例,C級(jí)0例。三組在年齡、性別、肝硬化病因及初始肝功能情況上的差異無(wú)統(tǒng)計(jì)學(xué)意義(P>0.05),具有可比性。
二、三組患者治療效果比較
(一)三組患者治療后轉(zhuǎn)歸情況:內(nèi)鏡組3例因EGVB死亡,1例因肝癌死亡,1例在遠(yuǎn)期出血后轉(zhuǎn)介入治療;介入組2例均因肝衰竭死亡,1例因遠(yuǎn)期出血轉(zhuǎn)內(nèi)鏡治療;外科組2例因EGVB死亡,1例因肝癌死亡,1例因早期出血轉(zhuǎn)內(nèi)鏡治療,1例因遠(yuǎn)期出血轉(zhuǎn)內(nèi)鏡治療。
(二)再出血情況:分別統(tǒng)計(jì)各組術(shù)后30 d內(nèi)、30 d以上再出血情況,比較三組的早期再出血率、遠(yuǎn)期再出血率,結(jié)果如下表1、表2所示。
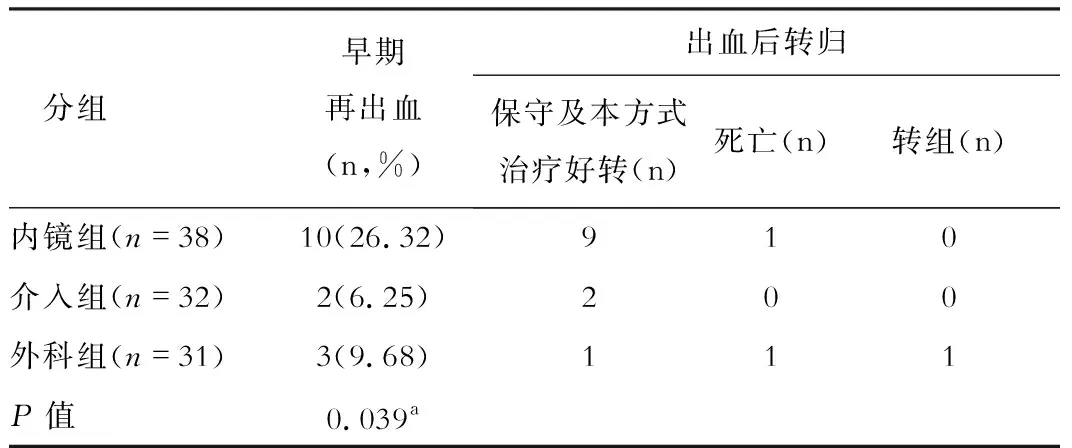
表1 三組早期再出血率比較
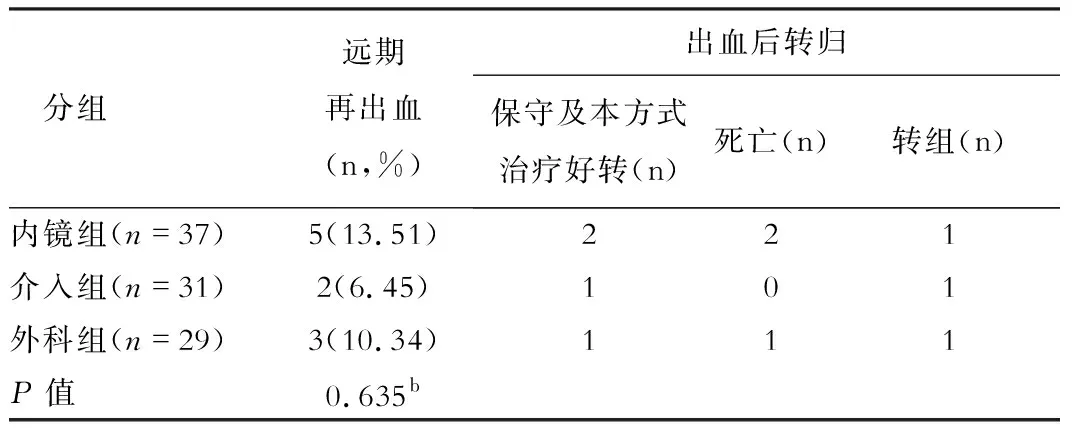
表2 三組遠(yuǎn)期再出血率比較
(三)曲張靜脈消失率情況:內(nèi)鏡組27例曲張靜脈消失,曲張靜脈消失率達(dá)71.05%;介入組24例曲張靜脈消失,曲張靜脈消失率達(dá)75%;外科組19例曲張靜脈消失,曲張靜脈消失率達(dá)61.29%,三組比較P值0.460,無(wú)統(tǒng)計(jì)學(xué)差異。
三、并發(fā)癥
內(nèi)鏡組:術(shù)后1例(2.63%)出現(xiàn)肝性腦病,4例(10.53%)出現(xiàn)新發(fā)腹水,17例(44.74%)術(shù)后第7~14 d復(fù)查胃鏡提示潰瘍形成。介入組:術(shù)后5例(15.63%)出現(xiàn)肝性腦病,0例出現(xiàn)新發(fā)腹水。外科組:1例(3.23%)出現(xiàn)肝性腦病,1例(3.23%)出現(xiàn)新發(fā)腹水。
四、遠(yuǎn)期生存情況
至隨訪終止,內(nèi)鏡組共4例(10.53%)死亡;介入組共2例(6.25%)死亡;外科組共3例(9.68%)死亡;繪制Kaplan-Meier生存曲線圖,結(jié)果提示P=0.384>0.05,無(wú)統(tǒng)計(jì)學(xué)差異,表明三組在遠(yuǎn)期生存上無(wú)明顯差異。見(jiàn)圖1。
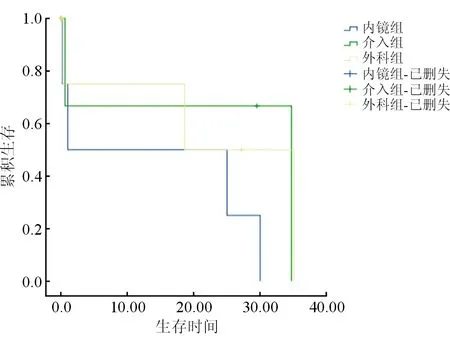
圖1 三組病人生存曲線的比較
討 論
本研究致力于為EGVB患者選擇最佳的二級(jí)預(yù)防方案,對(duì)于我院接受藥物聯(lián)合內(nèi)鏡、TIPS或賁門(mén)周?chē)茈x斷+脾切除術(shù)進(jìn)行EGVB二級(jí)預(yù)防的101例患者進(jìn)行回顧性分析,以進(jìn)一步評(píng)價(jià)上述二級(jí)預(yù)防措施的利弊。本研究中三種治療方式的EGVE再發(fā)生率均較未進(jìn)行二級(jí)預(yù)防患者明顯下降,故提示藥物聯(lián)合內(nèi)鏡治療、TIPS與外科手術(shù)治療均能有效預(yù)防食管胃靜脈曲張?jiān)俪鲅?/p>
本研究中內(nèi)鏡組早期再出血率(26.32%)明顯高于介入組(6.25%)及外科組(9.68%),以上差異具有統(tǒng)計(jì)學(xué)意義,提示在EGVB二級(jí)預(yù)防方面,介入及外科治療近期療效優(yōu)于藥物聯(lián)合內(nèi)鏡治療。EIS的原理是在內(nèi)鏡直視下將硬化劑注入曲張靜脈內(nèi)及靜脈周?chē)M織內(nèi),使曲張靜脈內(nèi)血栓形成,血管硬化閉塞,血管周?chē)M織發(fā)生纖維化,達(dá)到止血和防止再出血的作用[3-4]。其原理決定了其可導(dǎo)致食管黏膜壞死、糜爛及潰瘍形成,在潰瘍愈合期和結(jié)痂期(7-10d)容易發(fā)生早期再出血[5-6]。本研究中內(nèi)鏡治療組中有17例(44.74%)患者術(shù)后第7-14d復(fù)查胃鏡提示潰瘍形成,考慮內(nèi)鏡組早期再出血原因主要是EIS術(shù)后潰瘍形成伴出血所致。對(duì)于內(nèi)鏡組出現(xiàn)的早期再出血大多經(jīng)內(nèi)科保守治療或再次內(nèi)鏡下治療即可止血,較少出現(xiàn)因EGVB死亡患者,本研究中38例內(nèi)鏡組患者中僅1例因早期再出血而死亡。隨著內(nèi)鏡水平提高,對(duì)于內(nèi)鏡治療早期再出血的弊端也在不斷改進(jìn),近年內(nèi)鏡下精準(zhǔn)食管胃靜脈曲張斷流術(shù)被提出,其核心是選擇靜脈曲張來(lái)源支精準(zhǔn)斷,來(lái)源支血管即為血管剛從胃食管腔外進(jìn)入腔內(nèi)的部分,來(lái)源支是否充分閉塞是胃食管曲張靜脈治療后是否復(fù)發(fā)和再出血的重要原因[7]。Romero-Castro等研究均提示精準(zhǔn)治療方式的硬化劑使用量及再出血率明顯低于傳統(tǒng)內(nèi)鏡下治療方式[8-9]。
本研究中內(nèi)鏡組(13.51%)、介入組(6.45%)及外科組(10.34%)在遠(yuǎn)期再出血率上不存在顯著性差異;內(nèi)鏡組、介入組及外科組在曲張靜脈消失率方面亦無(wú)顯著性差異;以上提示在遠(yuǎn)期療效方面三種治療方式無(wú)明顯差異。EGVB二級(jí)預(yù)防后的遠(yuǎn)期再出血多由曲張靜脈復(fù)發(fā)所致,還包括門(mén)脈高壓性胃病[10]。TIPS 能直接將門(mén)靜脈血流分流至腔靜脈系,達(dá)到降低門(mén)靜脈壓力的目的,較好的預(yù)防EGVB發(fā)生。但TIPS仍無(wú)法改變肝硬化的病理生理及內(nèi)臟高血流動(dòng)力學(xué)狀態(tài),故仍存在曲張靜脈復(fù)發(fā)及出血的風(fēng)險(xiǎn)。賁門(mén)周?chē)茈x斷+脾切除術(shù)能阻斷占門(mén)靜脈血流60%~70%的脾動(dòng)脈,從而有效地降低門(mén)靜脈的壓力,起到改善靜脈曲張的效果;但離斷術(shù)始終無(wú)法徹底截?cái)嗍彻苤車(chē)c黏膜下的靜脈網(wǎng),且未能解決門(mén)靜脈系統(tǒng)的高壓淤血狀態(tài);內(nèi)鏡治療同樣不能完全閉塞食管壁間的交通支,且無(wú)法改變門(mén)靜脈壓力、血流,無(wú)法從源頭根除EGV,因此外科及內(nèi)鏡治療仍存在復(fù)發(fā)、再出血問(wèn)題[11],本研究中內(nèi)鏡組術(shù)后新發(fā)腹水4例(10.53%)亦提示內(nèi)鏡治療后可能存在門(mén)脈壓力不降反升而導(dǎo)致腹水產(chǎn)生。但內(nèi)鏡治療可通過(guò)反復(fù)多次治療使曲張食管胃靜脈基本消失,故靜脈曲張進(jìn)展緩慢,與外科手術(shù)治療相當(dāng)。以上原因?qū)е氯N治療方式在遠(yuǎn)期再出血率、曲張靜脈消失率方面無(wú)顯著差異。但在更長(zhǎng)時(shí)間的隨訪中三者的差異是否會(huì)越來(lái)越顯著仍需進(jìn)一步研究。
本研究中三種治療方式在遠(yuǎn)期生存上亦無(wú)顯著差異,考慮與內(nèi)鏡、介入、外科治療均不能從根本上阻止肝硬化疾病的進(jìn)展有關(guān)。D’Amico等[12]分析了118篇肝硬化患者預(yù)后的文獻(xiàn),發(fā)現(xiàn)肝功能Child—Pugh分級(jí)是肝硬化患者預(yù)后的獨(dú)立影響因子,提示患者生存期與治療方式關(guān)系不大,而肝硬化病程及治療時(shí)機(jī)的選擇可能是影響預(yù)后的關(guān)鍵因素。
早期多部指南及多項(xiàng)高質(zhì)量臨床研究證明,NSBB聯(lián)合內(nèi)鏡治療是二級(jí)預(yù)防食管靜脈曲張出血首選的標(biāo)準(zhǔn)方案。但隨著介入技術(shù)及質(zhì)量提高,肝性腦病發(fā)生率較前下降,TIPS地位逐漸上升,多項(xiàng)研究數(shù)據(jù)亦顯示,早期TIPS在控制出血及預(yù)防出血、患者無(wú)肝移植生存率及肝性腦病發(fā)生率等方面均有優(yōu)勢(shì)[13]。本研究中介入組肝性腦病發(fā)生率15.63%,均經(jīng)內(nèi)科保守治療好轉(zhuǎn),并未發(fā)生嚴(yán)重后果。根據(jù)本研究所示,介入治療在近期及遠(yuǎn)期治療效果上有優(yōu)勢(shì)。近年來(lái),關(guān)于肝硬化門(mén)靜脈高壓癥的外科手術(shù)應(yīng)用及地位的討論爭(zhēng)議不斷[14],在多數(shù)國(guó)外指南中外科手術(shù)地位逐漸下降[15],但這些國(guó)外指南存在外科專(zhuān)家參與少、我國(guó)專(zhuān)家參與少等情況,存在不能充分表達(dá)外科醫(yī)生意見(jiàn)、不能全面結(jié)合我國(guó)國(guó)情等情況。本研究中在近期及遠(yuǎn)期治療效果上外科組并未劣于內(nèi)鏡組。內(nèi)鏡、介入、外科手術(shù)治療在EGVB二級(jí)預(yù)防療效中各有優(yōu)點(diǎn),但在改善患者遠(yuǎn)期生存上并無(wú)差異,故在臨床實(shí)踐中應(yīng)根據(jù)患者及所在醫(yī)療機(jī)構(gòu)具體情況為患者選擇合理的治療方案。并且應(yīng)進(jìn)一步尋找新的降門(mén)靜脈壓力及改善肝硬化病理生理的措施。

