藥品定期安全性更新報告問題分析及創新舉措初探
吳 晶,甘 戈,司 瑋,郝 剛*
1 蘇州市藥品檢驗檢測研究中心,蘇州 215000;2 江蘇省藥品不良反應監測中心,南京 210002;3 南京市食品藥品監督檢驗院,南京210015
藥品定期安全性更新報告(PSUR)是制藥企業定期向政府藥品監管部門匯總某一藥品上市后某一時間段內全球安全性信息的一種報告形式。其目的是通過報告所有上市后藥品相關的更新的安全性信息,定期對藥品全面的安全性進行再評價。
1 PSUR 實施背景
PSUR 在國際上各國藥物警戒工作體系中都發揮著重要作用,目前美國、歐盟、日本均實行了PSUR 制度,而我國在2011 年7 月開始實施的《藥品不良反應報告和監測管理辦法》明確要求:藥品生產企業應當對本企業生產藥品的不良反應報告和監測資料進行定期匯總分析,匯總國內外該藥品的安全性信息,進行風險和效益評估,撰寫定期安全性更新報告。定期安全性更新報告的匯總時間以取得藥品批準證明文件的日期為起點計,上報日期應當在匯總數據截止日期后60 日內。國產藥品的定期安全性更新報告應向藥品生產企業所在地的省級藥品不良反應監測機構提交。進口藥品(包括進口分包裝藥品)的定期安全性更新報告應向國家藥品不良反應監測中心提交[1]。2012 年9 月由國家藥品不良反應監測中心制定的《藥品定期安全性更新報告撰寫規范》(簡稱《撰寫規范》)正式出臺,為藥品生產企業撰寫PSUR 提供進一步的規范指導。
藥品生產企業根據對匯總時間、正文和附件以及提交時限等相關要求,在國家藥品不良反應監測系統中進行網絡報告,并由各級藥品不良反應監測中心對報告進行在線審核和評價,審核評價結果反饋至藥品監管部門,作為上市安全監管的重要依據。
2 PSUR 數據現狀分析
2.1 PSUR 普遍達到基本要求,但企業及時提交報告意識不強
2019 年蘇州地區共收到205 份PSUR,除去71份補交的往年報告,2019 年度的PSUR 共134 份,對照年初摸底情況,轄區報告提交率100%。統計2019 年度的PUSR,因匯總時間不正確或者附件中要求的說明書、質量標準、批準證明性文件缺項、報告正文格式不符合等基礎要求的項目不通過、而退回的報告共11 份,形式審核報告通過率為91.79%。在報告提交及時性方面,按法規要求60 日內報告時限進行首次提交的報告僅為84.62%,審核后退回要求補充的報告、再次提交的及時率僅為27.27%[1-3]。
上述情況表明,生產企業已經基本建立了PUSR 工作機制,報告中對藥品的安全性信息進行匯總的時間段可以延續上一次提交或者符合首次提交PSUR 的要求,基本能覆蓋藥品上市后整個周期;附件要求的相關文件提交了解較為清楚;報告正文的格式基本均按照《撰寫規范》進行撰寫,但是按法規時限要求提交報告的意識須要加強。
2.2 PSUR 中安全性信息搜集、分析和安全性研究以及評價工作不足
安全性信息的收集和分析是PSUR 工作的基石,但在實際PSUR 中的藥品不良反應報告信息項目里,往往存在不良反應病例缺失、信息不完整、沒有對數據進行分析、或沒有對病例數據呈現的風險問題進行研析等情況較多。而且很少有企業會主動搜集并研析除了國家藥品不良反應監測系統反饋病例以外的安全性信息,包括全球范圍內的文獻、研究結果及醫藥報告等數據,這些信息也是了解藥品安全性的重要手段和路徑。此外,風險管理計劃意識缺失,對品種整體的安全性評價過于籠統片面,不具備說服力[4,5]。
在蘇州的134 份報告中,27 份為2019 年首次提交的PSUR,其不僅對報告正文中的國內外上市情況、用藥人數估算、藥品不良反應和安全性相關研究信息、風險管理計劃內容、藥品安全性評價結果進行統計外,還對主要存在問題作了分析。見表1。
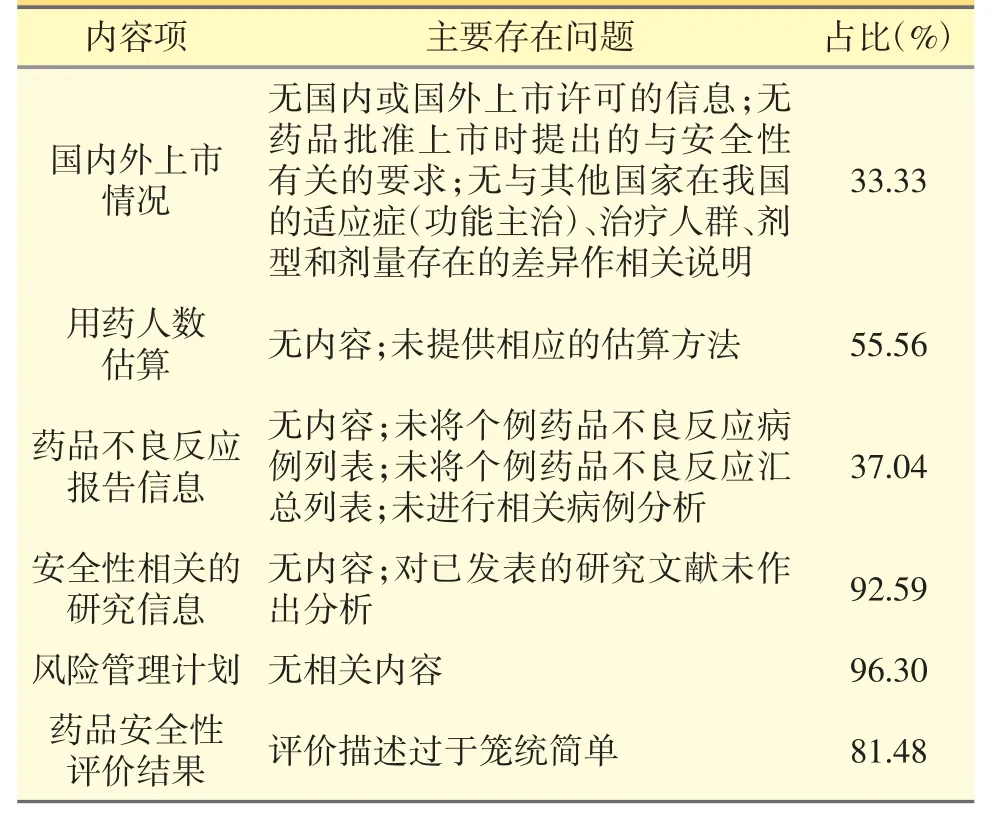
表1 PSUR 正文具體情況統計
因報告中關于藥品安全性原因而采取措施的情況、藥品安全性信息的變更情況等信息審核機構無法掌握,只能以報告單位提供的信息為準,故不在統計范圍內[2,3]。
以上情況在一定程度上反映了藥品生產企業在PSUR 安全性信息的搜集、數據分析以及安全性研究和風險評估等方面存在較多缺陷。
3 創新PSUR 審核評價機制的初探
報告質量是整個PSUR 工作的核心。一個具備完整性、客觀性與科學性的報告,更能保障監測部門對其分析和數據的利用,并提取潛在的風險信號,為藥品安全監管服務。分析PSUR 質量不高的原因主要存在兩方面問題:一是企業產品上市后風險控制意識不足,在人員和資源上投入有限,以及受到自身規模等經濟因素的制約;二是企業PSUR 的審核評價機制有待完善,崗位人員存在職數不足。當前的審核評價機制,基本只能滿足判斷PSUR 是否達到形式審核的基礎要求,但對于報告中無任何安全性信息搜集、無藥品說明書更新情況、上市情況不準確、應當開展安全性研究卻未開展、安全評價結論不具備說服力等有諸多欠缺[4-7],存在以下客觀因素:①現有的審核評價人員科學評價的能力有待加強;②按照現有的審核評價依據和標準也無法展開全面評價;③督促企業完善PSUR 的措施缺乏。針對上述問題,創新PSUR 審核評價機制的相關舉措亟待建立。
3.1 實施品種分級審核,對創新藥、高風險品種的PSUR 建立專門審核評價隊伍,提高整體科學評價能力
基層監測機構人員已經承擔了PSUR 的審核評價工作,任務繁重。據有關文獻報道,日常監測任務各地所轄監測范圍內現有藥品生產企業達到省均179.62 戶,所轄監測范圍內注冊備案的藥品批準文號省均4290 個[7]。面對生產企業數量多、規模小、品種多的現狀,現有的監測隊伍力量很難對PSUR 審核評價投入大量精力,加上基層審核人員往往沒有受到相關專業培訓,技術能力比較平庸,故對報告的客觀性、科學性等深入評價方面存在局限,從而很難從PUSR 中提取到有價值的產品風險信號。
隨著我國醫藥技術產業的發展,國內創新藥發展強勁,而創新藥往往是從未在市場上出現過的活性物質,不像仿制藥那樣,安全性已在多年臨床使用中得到驗證,而創新藥的安全性和有效性存在很多不確定性,故加強創新藥上市后風險監管顯得尤為重要。因此,對不同風險等級品種可以進行分級審核管理,對安全性高的仿制藥審核,仍保留由各轄區監測機構審核;對創新藥以及經監測發現風險較高的藥品,由國家監測機構在全國范圍內組織一支專門的審核評價隊伍,以在線審核為主,間或輔以定期開展現場審核,這樣可以對審核評價的技術力量進行資源整合和配置,有效聚集力量著重對創新藥、高風險品種進行專門的風險監測[8,9]。
3.2 建立評價等級模式,細化審核標準,進行報告質量評級,促使企業自我完善PSUR 工作
目前的審核評價機制,使報告審核評價人員很多信息無法掌握,沒有相關數據作為評價依據,比如,品種注冊情況、最新說明書更新情況、有沒有因監管部門要求采取過相關安全性措施等信息,很難形成統一評價標準,更無法確立硬性準則,往往只能對報告的形式進行審核,內容上無法全面審核評價,從而難對生產企業相關工作的督促、藥品安全性監管方面發揮作用,這是目前PSUR 工作的普遍難點。建議相關部門進一步研究,結合客觀制約因素,在目前審核機構能夠掌握的信息基礎上,制定可操作性的審核標準,同時建立報告質量等級評價體系,對報告的質量進行評價并給出相應的等級。須知,不同等級的報告反映了生產企業在藥品上市后有關信息的完整性和準確性、安全性信息的收集和分析、安全性研究和評價,以及風險管理的科學性等方面的工作水平[2,3]。這種報告評級模式,一方面可以作為依據幫助監管部門評估生產企業對藥品上市后安全監測工作的重視程度,也可作為企業是否認真執行PSUR 的參考;另一方面可作為依據,方便監管部門有效督促企業完善相關工作,激活相關部門之間關于PSUR 工作的互動聯通,落實生產企業藥品安全第一責任人的擔當。
3.3 完善在線報告系統對于補充報告的提示和報告方信息反饋的功能,提升審核流程效率
對于發現問題的報告,審核人員通過在線報告系統中要求補充的途徑退回至報告單位,報告單位應自行在系統的補充報告中找到被退回的報告,并按照審核反饋中的相關問題進行修改或補充,再次重新提交。但是實際上很多企業在提交報告后,關注是否有退回報告的意識不夠,往往需要督促提醒,才能完成補充報告流程。因此,建議在系統中對補充報告增加顯著提示功能,督促上報方自行完成補充報告流程。而對于有些報告單位認為無需修改或者補充的報告,在系統中增加向審核單位信息反饋渠道,由審核人員進一步判斷,避免造成因溝通不暢導致報告審核流程長時間擱置的情況。
4 小 結
PSUR 是藥品上市后安全性信號的重要來源,也是藥品上市許可持有人與監管部門在風險控制方面有效的溝通渠道。這些作用需要基于企業認真執行才能得以真正發揮。一個更加科學、客觀和有效的PUSR 審核評價機制,則可以更有力地促使生產企業做好該項工作。

