瀉肺利水合劑對慢性心衰大鼠心肌氧化應激和線粒體自噬的影響*
李超, 王巍, 楊雪卿
(北京中醫醫院順義醫院 心內科, 北京 101300)
慢性心力衰竭(chronic heart failure,CHF)是多種原因導致心肌細胞損傷,進而引起心臟射血功能異常,最終導致機體代謝失衡的一種心血管系統終末期疾病[1-3],患病率已達1.6%,嚴重地危害人類健康[4]。心室重構是CHF發生發展的基本機制,主要涉及心肌細胞結構功能的異常改變[5-6]。線粒體是心肌細胞重要的細胞器,參與了心室重構重要的環節[7]。既往研究發現,正常生理狀態下心肌細胞線粒體能夠為機體提供能量,同時受損的線粒體也能夠及時被自噬吞噬處理[8]。病理狀態下,心肌細胞線粒體功能異常,自噬小體過度激活,導致心肌細胞中線粒體自噬的失衡[9-10],提示心肌細胞線粒體自噬在CHF進展中發揮著重要作用。瀉肺利水合劑是由葶藶子、桑白皮、車前子、赤芍、水紅花子、生黃芪、甘草及太子參8味中藥組成,其水合劑用于治療CHF是由首都醫科大學附屬北京中醫醫院許心如教授首次提出、并進行了相關機制探討,認為其可通過“益氣活血,瀉肺利水”進而達到治療CHF的目的[10]。此外,瀉肺利水合劑可顯著提高心衰患者的生存質量,同時具有良好的血流動力學效應[11-12]。因此,本實驗研究擬通過構建CHF大鼠,探究瀉肺利水合劑對治療CHF的分子作用機制。
1 材料與方法
1.1 材料
1.1.1實驗動物 選取6~8周雄性SD大鼠60只,體質量200~220 g,購買于北京大學醫學部[SCXK(京)2018-0010],適應性喂養1周。
1.1.2藥品和主要試劑 瀉肺利水合劑(葶藶子30 g、桑白皮30 g、車前子30 g、赤芍10 g、水紅花子15 g、生黃芪30 g、甘草10 g及太子參30 g)由首都醫科大學附屬北京中醫醫院合成,阿霉素(批號D1515,美國Sigma),自噬微管相關蛋白輕鏈3抗體(microtubule associated protein light chain 3,LC3)和p62抗體(美國CST),細胞色素C氧化酶Ⅳ抗體(cytochrome c oxidase IV antibody,COX Ⅳ)、一抗和二抗稀釋液、超氧化物歧化酶 (superoxide dismutase,SOD)試劑盒、活性氧(reactive oxygen species,ROS)檢測試劑盒及丙二醛(malondialdehyde,MDA)檢測試劑盒(江蘇碧云天)。
1.1.3主要儀器 H1850高速離心機(美國Thermo Scientific),H22539細胞渦旋儀(武漢維塞爾),DW-86L578J -80 ℃超低溫冰箱(青島海爾),FYL-YS-128 4 ℃、-20 ℃冰箱(合肥美菱),H22820脫色搖床(江蘇盛藍),SuPerMax-3100多功能酶標儀(美國Thermo賽默飛世爾),SKFH-1600RW高速臺式冷凍離心機(湖南湘儀),NIB900-FL熒光倒置顯微鏡(日本奧林巴斯),125-0098電泳儀檢測裝置(美國Bio-Rad),CSB-20L高純水機(美國Millipore)。
1.2 方法
1.2.1動物分組及造模 60只SD大鼠隨機分為對照組(Control組)、模型組(Model組)及瀉肺利水合劑藥物處理組(treatment組,TM組),每組20只。Model組及TM組大鼠給予2.0 g/L阿霉素(生理鹽水配置),以2.0 mL/kg腹腔注射、1次/周、連續6周;TM組大鼠系給予瀉肺利水合劑[10 mL/(kg·d)]灌胃,1次/d、連續6周;Control組及Model組大鼠給予等量的生理鹽水灌胃處理,1次/d、連續6周。
1.2.2心臟超聲檢測 最后一次灌胃結束后,大鼠取平臥位固定,將探頭放置于胸骨左緣,取左室長軸最大直徑M超聲記錄室間隔、左室后壁收縮末期及舒張末期心內膜位置,于結束時采用小動物超聲儀器檢測大鼠左室舒張末期內徑(left ventricular end-diastolic diameter,LVDD)、左室收縮末期內徑(left ventricular end-systolic dimension,LVSD)、左室縮短分數(left ventricular fractional shortening,LVFS)、左室射血分數(left ventricular ejection fraction,LVEF),以LVFS<40%或LVEF<50%判定大鼠是否造模成功[13];利用計算機自帶操作軟件計算LVDD、LVSD、LVFS和LVEF值。上述操作均由同一操作員進行。
1.2.3酶聯免疫吸附試驗(enzyme linked immunosorbent assay,ELISA) 心臟超聲檢測結束時,各組大鼠使用10%的水合氯醛按照4.5 mL/kg腹腔麻醉,采用手術剪和手術鑷打開胸腔,剪開左心耳,剪下大鼠心尖組織、生理鹽水中清洗并于液氮罐內留存備用;實驗時取各組大鼠同等質量的心尖組織研磨成組織勻漿,采用二辛喹酸(bicinchoninic acid,BCA)法測定心尖組織蛋白質總濃度后,分別通過ELISA檢測心尖組織中SOD、ROS和MDA含量。
1.2.4Western blot 分別取各組大鼠心尖組織進行蛋白提取并測定濃度、電泳、轉膜,孵育COX Ⅳ一抗(1 ∶1 000)、p62一抗(1 ∶1 000)和LC3(1 ∶1 000)4 ℃過夜,洗膜,室溫孵育COX Ⅳ和p62的鼠二抗,LC3的兔二抗1 h;搖床搖晃加TPBS洗滌3次,5 min/次,加顯影液顯影并拍照,蛋白表達量以各目標條帶灰度值與內參β-actin條帶灰度值的比值表示。
1.2.5心肌線粒體自噬 取各組大鼠包埋的心肌組織采用超薄切片機進行切片,厚度100 nm,經醋酸雙氧鈾和檸檬鉛染色,透射電子顯微鏡觀察心肌線粒體形態以及自噬小體并對其拍照。
1.3 統計學分析
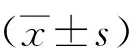
2 結果
2.1 LVEF、LVFS、LVDD和LVSD
與Control組相比,Model組與TM組大鼠的LVEF和LVFS水平明顯降低,LVDD和LVSD則明顯升高(P<0.01);與Model組相比,TM組大鼠的LVEF和LVFS水平升高,LVDD和LVSD則降低(P<0.05或P<0.01)。見表1。

表1 各組大鼠LVEF、LVFS、LVDD和Tab.1 Comparison of LVEF, LVFS, LVDD, and LVSD in each
2.2 MDA、ROS和SOD
與Control組相比,Model組和TM組大鼠心肌組織中MDA和ROS水平明顯升高、SOD水平則明顯降低(P<0.01);與Model組相比,TM組大鼠心肌組織MDA和ROS水平降低、SOD水平則升高(P<0.05或P<0.01)。見表2。

表2 各組大鼠心肌組織MDA、ROS和SOD的比較Tab.2 Comparison of MDA, ROS and SOD level of myocardial tissues in each group
2.3 心肌組織線粒體自噬相關蛋白的表達
與Control組相比,Model組大鼠心肌組織LC3-Ⅱ/LC3-Ⅰ和COX Ⅳ表達均升高、p62表達明顯降低(P<0.05或P<0.01);與Model組相比,TM組大鼠心肌組織LC3-Ⅱ/LC3-Ⅰ和COX Ⅳ表達均降低、p62表達增加(P<0.05)。見圖1。

注:與Control組相比,(1)P<0.05,(2)P<0.01;(3)與Model組相比,P<0.05。圖1 各組大鼠線粒體自噬相關蛋白的表達Fig.1 The expression of mitochondrial autophagy-related proteins in each group
2.4 心肌組織線粒體自噬的形態學特征
Control組大鼠心肌線粒體形態正常、膜完整且無明顯的自噬體小泡,Model組大鼠心肌線粒體形態大小不一、膜破裂且有明顯的自噬小泡形成,TM組大鼠心肌線粒體膜部分損傷、破裂且有少量的自噬小體形成;與Control組相比,Model組大鼠心肌組織線粒體自噬數量增加,差異有統計學意義(P<0.01),但Control組與TM組比較、差異無統計學意義(P>0.05);與Model組相比,TM組大鼠心肌組織線粒體自噬數量降低,差異有統計學意義(P<0.05)。見圖2。

注:箭頭表示自噬小體;(1)與Control組相比,P<0.01;(2)與Model組相比,P<0.05。圖2 各組大鼠的心肌組織線粒體自噬(透射電鏡,×10 000)Fig.2 Mitophagy of myocardial tissues in each group (transmission electron microscope,×10 000)
3 討論
CHF在中醫上可以歸屬為“喘證”、“心水”、“心悸”、“痰飲”等范疇,患病率與年齡呈現正相關,伴隨我國人口老齡化的加劇,CHF的患病率逐年提升,已成為我國重要的公共健康問題[14]。以往研究發現,中醫藥在治療CHF中發揮重要優勢,主要歸為中醫藥中“中成藥制劑治療”、“中藥湯劑辯證治療”、“中藥注射劑治療”以及“其他輔助性治療”[15]。其中中藥湯劑治療在CHF患者中占據重大部分。溫陽利水、益氣活血利水、益氣養陰以及益氣健脾等是中藥湯劑治療CHF的主要機理[16-19]。但是目前有關中藥湯劑治療CHF的主要機制尚不清楚。因此,探尋中藥湯劑治療CHF的可能機制尤為關鍵。
瀉肺利水合劑是由葶藶子、桑白皮、車前子、赤芍、水紅花子、生黃芪、甘草及太子參共計8味中藥組成,具有典型的益氣活血利水功效[10]。研究發現,在氣虛水飲內停型心衰患者中采用瀉肺利水合劑能夠有效改善患者血流動力學特征,提高患者生存質量[11]。但是截止到目前有關瀉肺利水合劑的研究主要側重于臨床治療,有關其在體動物研究以及分子作用機制研究缺乏。本研究主通過腹腔注射阿霉素構建CHF大鼠模型,瀉肺利水合劑10 mL/(kg·d)連續灌胃處理6周,結果顯示Model組大鼠LVEF和FS水平分別較Control組和TM組降低,但LVDD和LVSD升高(P<0.05或P<0.01),表明瀉肺利水合劑能夠改善CHF大鼠心臟功能。
心肌組織氧化應激和線粒體自噬在CHF中發揮重要作用[14]。研究發現,在CHF大鼠和患者中,心肌氧化應激水平均顯著增加[20];抑制心肌組織氧化應激能夠有效改善CHF大鼠癥狀[21]。本實驗結果發現,Model組大鼠心肌組織MDA和ROS水平分別較Control組和TM組升高,但SOD水平降低(P<0.05或P<0.01),提示過度氧化應激會引起心肌細胞線粒體損傷。以往研究也證實受損的線粒體會激活細胞自噬的產生,導致心肌功能的紊亂[22-24]。在CHF大鼠模型中心肌線粒體損傷明顯加重,通過給予參葵顆粒能夠激活AMPK信號通路,改善心肌細胞線粒體自噬水平[25]。在臨床研究20例心衰患者,采用輔酶Q10補充治療能夠有效改善線粒體功能障礙,從而降低心肌氧化應激水平[26]。為此,本研究通過Western blot檢測了線粒體自噬相關蛋白。結果顯示,Model組大鼠心肌組織LC3-Ⅱ/LC3-Ⅰ和COX Ⅳ表達分別較Control組和TM組升高,p62表達降低(P<0.05或P<0.01)。透射電鏡觀察結果發現,Control組大鼠心肌線粒體形態正常,膜完整,無明顯的自噬體小泡;Model組大鼠心肌線粒體形態大小不一,膜破裂,有明顯的自噬小泡形成;TM組大鼠心肌線粒體膜部分損傷,破裂,且有少量的自噬小體形成。
綜上所述,瀉肺利水合劑可通過降低CHF大鼠心肌組織氧化應激水平,抑制心肌線粒體自噬產生,最終改善心臟功能,從而為瀉肺利水合劑用于臨床CHF治療提供了新的理論基礎。

