姜黃藥渣真菌分離方法的改良及真菌多樣性分析*
蘭詠哲, 李啟瑞, 黃勁, 趙亮, 董宇華, 闞雨, 王迪, 廖萬清, 康穎倩*
(1.貴州醫科大學 基礎醫學院 微生物學教研室, 貴州 貴陽 550025; 2.貴州省微生物與人類健康關系研究人才基地 & 貴州省普通高校病原生物學特色重點實驗室, 貴州 貴陽 550025; 3.貴州醫科大學 基礎醫學院 生物化學與分子生物學教研室, 貴州 貴陽 550025; 4.中國人民解放軍海軍軍醫大學 上海長征醫院真菌學研究所, 上海 200003)
姜黃(Curcumalonga)為姜黃芭蕉目、姜科,屬多年生草本植物[1],其根莖發達,根粗壯,末端膨大呈塊根,廣泛栽培于我國西南、西北地區[2]。姜黃在中國中草藥領域已經應用了上千年,其特有的姜黃素具抗炎、抑菌、降糖、抗氧化及促進創口愈合等多種生物學活性[3-4]。姜黃藥渣以植物根莖組織為主,含有植物纖維、蛋白質、多糖及殘留的藥物成分[5-6],我國每年姜黃藥渣的排放量達3 000萬噸[7]。目前,利用投加具有高效降解木質纖維素的微生物對藥渣發酵堆肥的方式已成為國內外藥渣處理的研究熱點[8-9]。研究發現,降解木質纖維素的主要是絲狀真菌[10],研究者多用添加外源微生物的方式對藥渣進行發酵[11-12],但姜黃藥渣本身具有一定的抑菌作用[13-15],可能會抑制一些微生物的生長,降低發酵效率。有研究者發現,可從不同的混合藥渣中分離到具高效水解藥渣中木質纖維素的菌株,特別是一些菌株可有效地抵抗周圍環境而頑強地生存,證明從藥渣及其堆放環境中分離對藥渣有降解效果的真菌方法是有可行性的[16-18]。在分離方法上,研究者常采用平板劃線、平板稀釋涂布等方法分離生物質中真菌[19-21],但由于姜黃藥渣具有一定的抑菌效果,采用傳統的真菌分離方法效果不佳,難以分離出真菌[14]。有學者發現,先對生物質進行搖床富集培養,可有效地提高菌株的分離率[21]。此外,采用植物組織分離法對植物組織塊進行預處理也可以有效地對植物內生真菌進行分離[9]。因此,本研究結合多種方法對姜黃藥渣真菌分離方法進行改良,探究姜黃藥渣中真菌的多樣性,為篩選具有降解姜黃木質纖維素能力的真菌菌株,解決姜黃藥渣堆放污染環境的問題打下基礎。
1 材料與方法
1.1 材料
1.1.1藥渣來源 從貴州正業集團堆放姜黃藥渣的環境中,參照文獻[22]采集5處姜黃藥渣樣本。
1.1.2主要試劑與儀器 酵母浸出粉胨葡萄糖培養基(yeast extract peptone dextrose medium,YPD;美國BD),青霉屬及鏈霉素(上海生工);Ezup柱式真菌基因組DNA抽提試劑盒、Genstar PCR MIX、T100 聚合酶鏈式反應(polymerase chain reaction,PCR)儀及電泳儀(美國 BIO-RAD),Thermo 17R小型臺式高速離心機及HH-B11恒溫培養箱(上海躍進)。
1.2 方法
1.2.1藥渣真菌常規分離法 取大小適當的姜黃藥渣組織塊,無菌生理鹽水洗滌3次,置于滅菌的酵母膏胨葡萄糖鏈霉素及青霉屬抗性培養基[18],25 ℃恒溫搖床孵育3~7 d,每個樣本重復3次,將培養基上生長的菌株以劃線法接種于YPD固體培養基上,25 ℃恒溫培養3~7 d,分離培養至獲得單一菌種。
1.2.2藥渣真菌改良法 采用植物組織分離法[22]處理姜黃藥渣:取大小適當的姜黃藥渣組織塊用無菌生理鹽水洗滌3次后,用無菌手術刀將組織塊切開,分成均勻小塊,取直徑0.5 cm的組織塊置于錐形瓶中,加入無菌ddH2O 150 mL,25 ℃恒溫搖床孵育6 h;將震蕩均勻的菌液靜置30 min,吸取適量上清液,接種于酵母膏胨葡萄糖瓊脂鏈霉素及青霉屬抗性培養基,25 ℃恒溫倒置孵育3~7 d,每個樣本重復3次;將培養基上生長的菌株以劃線法接種在YPD固體培養基上,25 ℃恒溫孵育3~7 d,分離培養至獲得單一菌種。
1.2.3菌株的分離及鑒定 分別采用常規分離方法及改良方法對5個姜黃藥渣樣本進行菌株的分離,每個樣本重復3個平板;純化后的菌株按Ezup柱式真菌基因組DNA抽提試劑盒的操作步驟提取DNA,通過PCR擴增其轉錄間隔區(internal transcribed spacer, ITS)基因序列后送公司測序;將測序結果在美國國立生物技術信息中心(national center for biotechnology information,NCBI)中與已知菌株進行相似度比較,并結合菌株的形態,鑒定種屬[23],并計算分離率[24]。
1.3 統計學分析
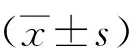
2 結果
2.1 菌株的分離
采用常規方法和改良方法分別從5個姜黃藥渣樣本中分離獲得菌株13株和222株,前者分離菌株均數低于后者,差異有統計學意義(P<0.05)。見表1。

表1 常規方法與改良方法分離的菌株數Tab.1 Comparison results of two methods for isolate strains
2.2 真菌的多樣性
2種方法分別從姜黃藥渣樣本中分離獲得的真菌菌株13株和222株,常規方法分離出的13株菌株分屬于2個門5個屬的6個菌種,改良方法分離出菌株分屬于3個門12個屬的20個菌種;青霉屬均為優勢菌屬,分離率分別為61.53%、46.84%(圖1);Aspergillusminisclerotigenes分離出的菌株均最多,分別為5株、58株,為優勢菌種(圖2)。

圖1 常規方法及改良方法分離菌株的菌屬比例構成Fig.1 Composition of the genus ratio of the conventional method and the improved method

圖2 常規方法及改良方法分離菌株的菌種分布情況Fig.2 Distribution map of strains was isolated by the conventional method and the improved method
3 討論
生物質資源具有很高的利用價值,但生物質微生物利用的過程中往往存在有效菌株難以分離的問題,如姜黃藥渣中姜黃素的抑菌作用[3]、酒糟的酸性環境[23]、茶渣中含有的茶多酚具有較強的抗氧化功效[13]等,這些因素都是導致菌株難以分離的原因。本次研究對姜黃藥渣真菌的分離方法進行了改良,結合了搖床培養及植物組織分離的方法,其中采用植物組織分離法對姜黃藥渣進行預處理,可提高藥渣組織各部分與培養基的接觸,并且可以分離出姜黃藥渣中的內生真菌,這些真菌往往也具有木質纖維素降解能力。此外,以姜黃藥渣為唯一碳源進行搖床富集培養,可有效提高菌株的分離率。在本次研究中采用改良方法從采集的5個姜黃藥渣樣本中分離出真菌菌株222株,每個樣本分離出的菌株均數大于常規平板分離方法(P<0.05),有效提高了姜黃藥渣真菌菌株的分離率,為中草藥藥渣及其他生物質中菌株的分離提供了思路。
本研究中,采用常規方法及改良方法分別從姜黃藥渣中分離獲得真菌菌株13株、235株,其中曲霉屬分離率分別為61.53%、46.84%,均為優勢菌屬;采用常規方法分離到的5個菌屬的6個菌種,在改良方法中都可以被分離獲得,且優勢菌屬及菌種均未改變,這說明改良方法不會影響樣本中真菌菌株的多樣性。此外,曲霉作為發酵工業和食品加工業的重要菌種,常活躍在人們的視野之中[24]。在其他生物質(如大白花杜鵑根[25]、沙冬青[26])微生態中,球囊霉屬、無梗囊霉屬及樹粉孢屬等菌屬往往為優勢菌屬,與姜黃藥渣存在著一定的差異,這可能與姜黃所特有的性質有關[17]。
本研究還從藥渣中分離出了根毛霉屬、假絲酵母菌屬、紅酵母屬菌、藍狀菌屬、輪層炭殼屬、傘菌屬、茶葉籽酵母屬、錐毛殼屬、毛霉屬及栓菌屬的菌株。其中,毛霉屬、根毛霉屬主要以腐生的方式生活,具極強的蛋白質分解能力,毛霉屬的一些菌種甚至被報道過有降解木質纖維素的能力[22]。假絲酵母菌屬為一類常見的深部感染真菌,種類很多,但能夠引起人類致病的僅有幾種,一些菌種也可以利用脫落的植物枝葉進行生長[27]。紅酵母屬的真菌為一些單細胞真菌,對周圍環境的適應能力很強,可產生莢膜使菌落呈粘稠狀,往往被認為是引起動植物致病的原因。此外,輪層炭殼屬、傘菌屬、錐毛殼屬及栓菌屬的菌株都常被報道存在于植物脫落的組織周圍,可有效地利用植物組織生長,對木質纖維素都具有一定的降解作用[28]。這為后續進一步篩選具有降解木質纖維素能力的菌株提供了依據。

