甘薯黑斑病菌脅迫對不同甘薯品種抗氧化酶活性及MDA含量的影響
張成玲,孫厚俊,謝逸萍,楊冬靜,馬居奎
(江蘇徐淮地區徐州農業科學研究所/農業農村部 甘薯生物學與遺傳育種重點實驗室,江蘇 徐州 221131)
甘薯黑斑病是由甘薯長喙殼菌(CeratocystisfimbriataEllis et Halsted)引起的,發生在甘薯苗期、大田期、貯藏期,為害甘薯莖蔓、薯塊等,是甘薯重要的病害之一。甘薯黑斑病在全國各大薯區均有發生,每年造成產量損失5%~10%,發病嚴重年份或地區的產量損失更高。發病甘薯中產生的黑皰霉酮等物質可引起家畜中毒,甚至死亡。用發病薯塊進行發酵時,能毒害酵母菌和糖化酶菌,延緩發酵過程,降低酒精產量和質量[1-2]。病原C.fimbriata能侵染牽牛、綠豆、紅豆等多種植物,造成了重大的經濟損失。為了能更好地防治甘薯長喙殼菌,國內外學者對不同寄主來源病菌的生物學特性、基因型及病菌侵染等方面進行了研究。2013年Simpson首先等對甘薯長喙殼菌進行全基因組測序,研究了該菌的微衛星標記,明確了其種群結構和起源,開發了微衛星標記,以區分甘薯長喙殼菌的物種[3]。隨后Li等[4]對中國、日本、澳大利亞和美國的C.fimbriata進行了分析,明確了這些地區來源的病菌具有相同的轉錄間隔區(ITS)序列,微衛星等位基因變異較小,甘薯與石榴上分離出的病原菌屬于同一個生物種,而桉樹上的病原菌具有典型亞洲種群特性。Scruggs等[5]利用ITS、TEF和MAT-2序列分析了美國北卡羅來納州甘薯黑斑病分離株的遺傳多樣性,發現50株供試菌株均為單一交配型MAT-2,ITS、TEF與MAT-2序列的比對顯示,所有分離株在每個位點都是相同的。不同寄主來源的甘薯長喙殼菌對寄主的親和性不同,芋頭菌株和石榴菌株均可在芋頭塊莖組織表面生長,并最終致其腐爛,表現出親和反應,但是甘薯菌株接種芋頭塊莖組織后,表面無菌絲生長,表現出非親和反應[6]。但來源于甘薯的C.fimbriata對所有甘薯品種均有致病性,但不同品種的抗性表現差異,篩選出了如蘇薯9號、徐薯23、渝蘇76、鄂薯2號、冀薯99、煙薯18等抗性品種[5,7-9]。利用SSH技術構建甘薯抗黑斑病材料的cDNA文庫,明確了muRdrl等抗性基因位點[10]。利用轉基因技術,明確了大麥硫蛋白α-hordothionin(αHT)能抑制甘薯長喙殼菌的侵染,顯著提高了甘薯的抗性[11]。
病原菌等生物脅迫可誘導植物體活性氧積累,對植物產生傷害,而植物體的保護酶系統,超氧化物歧化酶(superoxide dismutase,SOD)、過氧化物酶(peroxidase,POD)、過氧化氫酶(catalase,CAT)相互協調,可清除植物活性氧,降低其對植物的傷害[12-13]。接種甘薯黑斑病菌后,甘薯塊根中過氧化物酶(POD)和超氧化物歧化酶(SOD)活性顯著升高,且抗病品種的酶活力變化速度和峰值均高于感病品種,即不同甘薯品種酶活力變化與甘薯抗病性存在相關性[14]。劉美艷[15]、王景景[16]等測定了高抗黑斑病菌材料“南京-92”和高感材料“煙臺-252”塊根中綠原酸、總酚的含量、多酚氧化酶(PPO)、苯丙氨酸解氨酶(PAL)的活性。抗病品種在黑斑病侵染第1天,PAL活力就迅速提高,且一直保持較高水平,綠原酸含量也迅速提高。感病品種在黑斑病侵染后第3天的PAL活力才顯著升高、第5天后迅速下降;高抗品種體內PPO活性及總酚含量比高感品種提高迅速,且持續時間較長。盡管已有不少有關甘薯薯塊保護酶等活性變化的報道,但是甘薯黑斑病菌引起甘薯薯苗酶活力變化尚不清楚。本研究從山東濰坊采集到甘薯黑斑病樣品,經分離鑒定后,接種到不同甘薯薯苗上,測定并分析了不同接種時間不同甘薯品種葉片SOD和POD活性變化及丙二醛(malondialdehyde,MDA)含量,為甘薯薯苗抗逆機理的深入研究、抗性品種的篩選及培育提供理論依據。
1 材料與方法
1.1 試驗材料
甘薯黑斑病菌甘薯長喙殼菌(C.fimbriataEllis et Halsted)為江蘇徐州甘薯研究中心從山東濰坊甘薯黑斑病發病薯塊上分離得到,命名為WF。將病原菌在馬鈴薯葡萄糖瓊脂培養基上28 ℃活化培養7 d后備用。供試甘薯品種為煙薯252、沖繩100(勝利百號)、南京92、徐薯273、徐薯18,均為江蘇徐州甘薯研究中心提供。從苗床中剪取生長整齊一致的健壯幼苗,篩選4葉1心,基部莖粗12~13 mm,莖長(20±2)cm,莖節3節的幼苗進行清水培養。培養器為規格500 mL的燒杯,每瓶3株。水培期,每2 d更換1次清水,每次每瓶加300 mL。
1.2 試驗設計及接種
待幼苗緩苗后,利用上述培養的病原菌孢子濃度為1×106CFU/mL的孢子懸浮液進行處理30 min,移入清水中繼續培養,分別于接種后1、6、24、72、120、168 h采集葉片。每個試驗甘薯品種設3次重復,以清水處理為對照。
1.3 抗氧化酶活力的測定方法
POD、SOD、MDA測定試劑盒(微量法)均購自蘇州科銘生物技術有限公司。樣品冷凍研磨后加入提取液,根據蘇州科銘生物技術有限公司試劑盒使用說明,利用Thermo Scientific Multiskan GO酶標儀,測定不同酶在特定波長下吸光值,計算其活性及含量。
1.4 數據統計與分析
實驗數據采用Excel 2007軟件進行分析和作圖。
2 結果與分析
2.1 甘薯黑斑病菌脅迫下不同甘薯品種MDA含量的變化
4個甘薯品種的MDA含量隨時間的延長,抗性品種南京92和感病品種煙薯252在120 h(5 d)達到最高值,分別為121.68%和125.89%,隨后增長率逐漸減低。而徐薯273、沖繩100和徐薯18的整體增長率逐漸上升,在168 h(7 d)達到最高值。徐薯273和煙薯252接種后72 h的增長率稍低于24 h。處理初期,同一時間處理不同的甘薯品種發現,感病品種的MDA含量增長率明顯高于抗病品種,隨著抗性趨勢的增強,與感病品種增長率差異越明顯(圖1)。
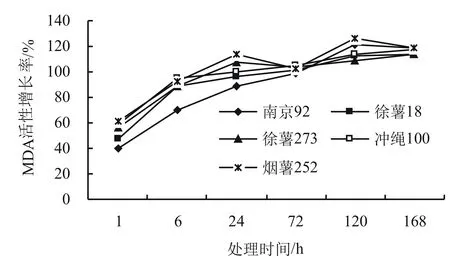
圖1 甘薯黑斑病菌不同處理時間對甘薯葉片MDA含量的影響
2.2 甘薯黑斑病菌脅迫下不同甘薯品種SOD活性的變化
由圖2可知,黑斑病菌侵染甘薯后,不同甘薯品種的抗氧化酶SOD活性隨時間的推移,其增長趨勢不同,抗性品種南京92呈現先上升后下降再上升的趨勢,在6 h時增長率最高,達到116.35%;徐薯18在1 h時增長率最高,為89.48%,隨后下降,到168 h時呈現上升趨勢。徐薯273、沖繩100及煙薯252的增長率整體呈現下降上升再下降趨勢。SOD活性隨著處理時間的推移,無論是正增長還是負增長,高抗品種南京92的增長率高于其他品種。
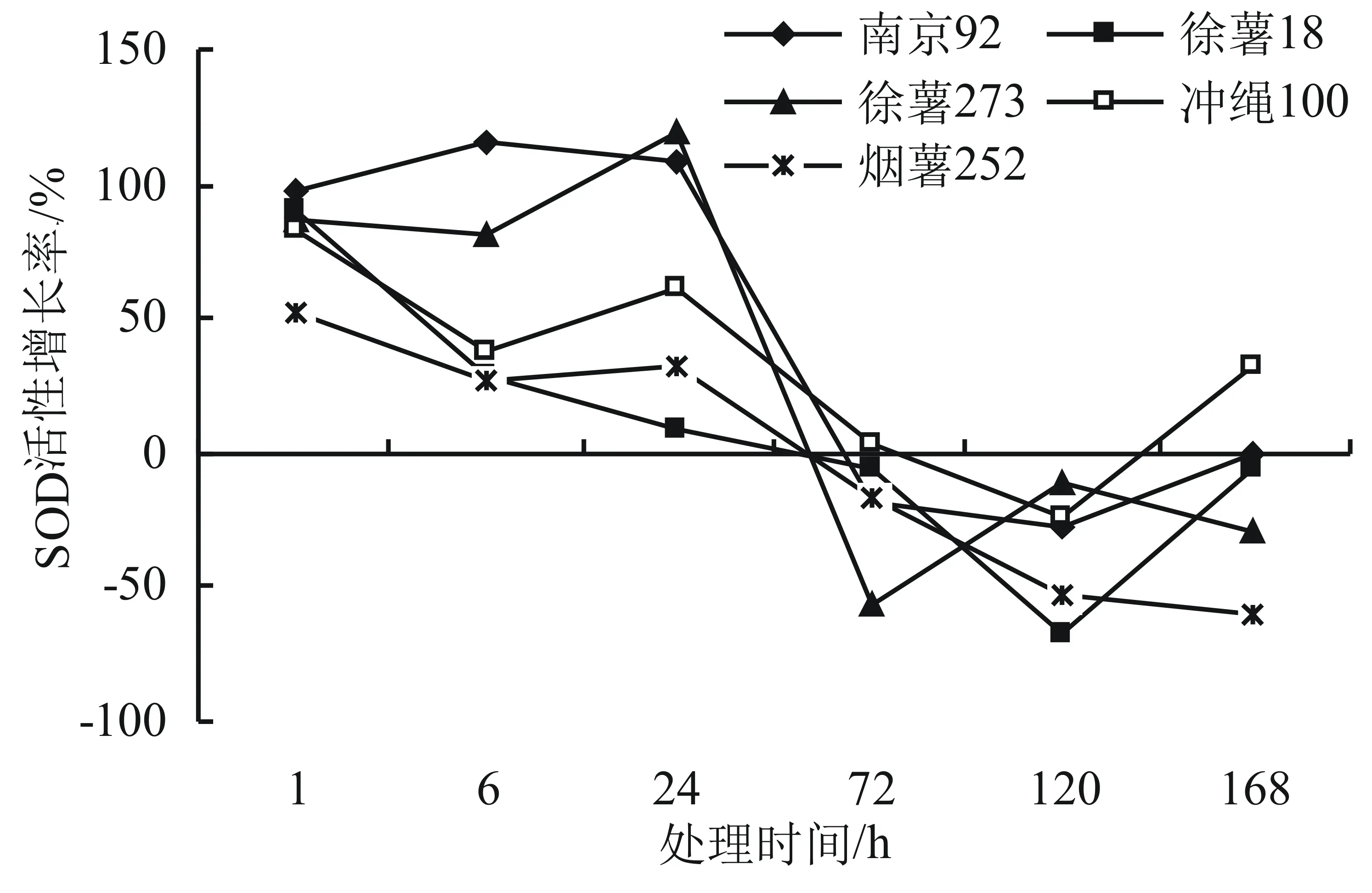
圖2 甘薯黑斑病菌不同處理時間對甘薯葉片SOD活性的影響
2.3 甘薯長喙殼菌脅迫下不同甘薯品種POD活性的變化
POD普遍存在于高等植物中,能夠催化分解由SOD清除自由基所產生的H2O2和過氧化物,在植物生長發育過程中起著重要作用。由圖3可知,所有甘薯品種抗氧化酶POD活性隨侵染時間的增長而呈現上升趨勢,隨后增長率下降,除徐薯273在6 h時達到最高值,為302.72%,高于其他甘薯品種,其余品種均在24 h時的增長率最高。同一時間處理不同的甘薯品種,高抗性品種南京92的POD活性的增長率明顯高于其他品種,且隨著不同品種的抗性變化,其增長率變化也不同。
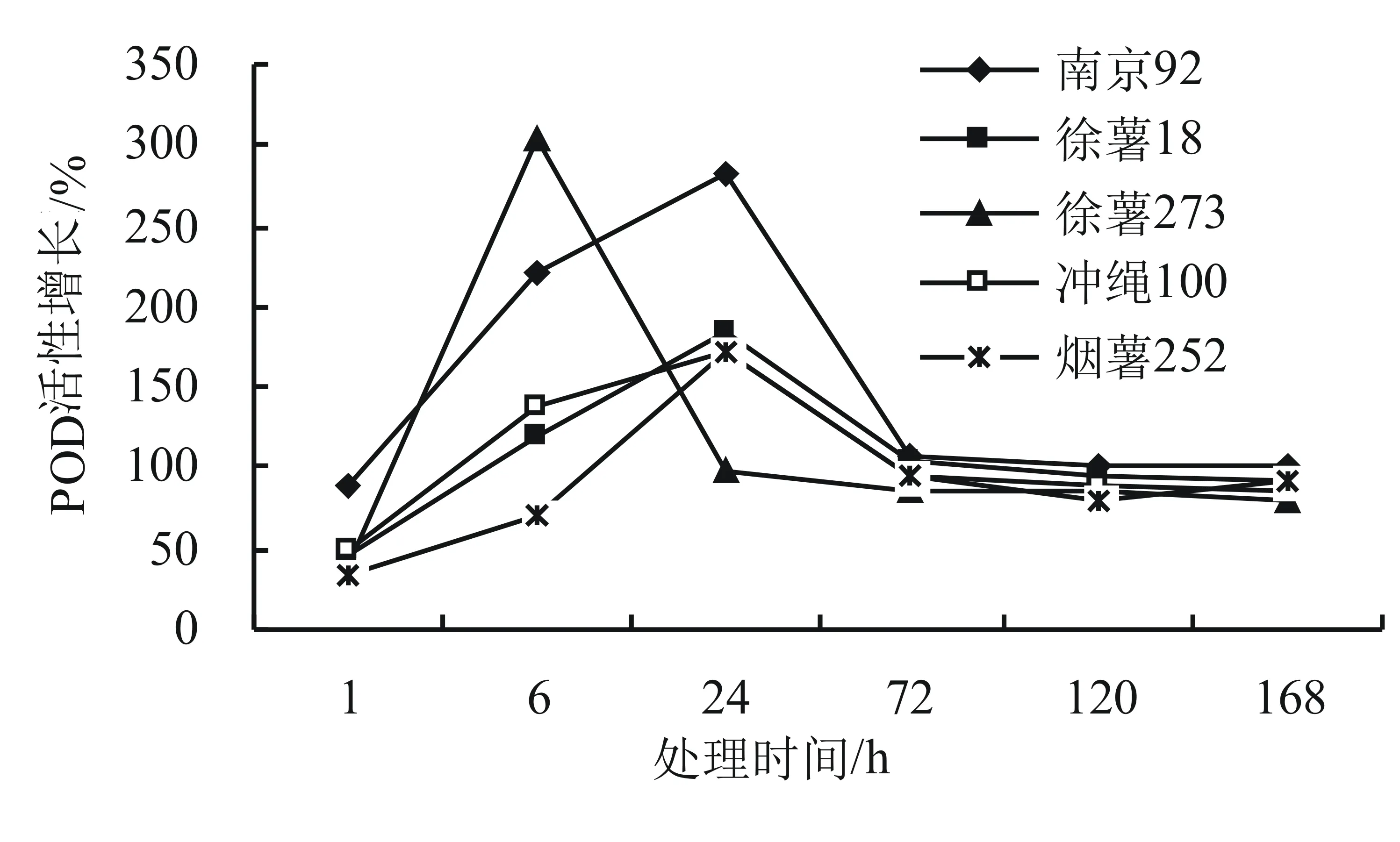
圖3 甘薯黑斑病菌不同處理時間對甘薯葉片POD活性的影響
3 小結與討論
植物受到脅迫時,活性氧動態平衡被打破,產生大量的活性氧,促使植物脂膜和細胞器膜的嚴重過氧化,MDA含量升高。為抵御這種脅迫,植物啟動膜保護系統又稱為抗氧化系統來清除植物體內多余的自由基。POD、SOD酶是植物體內主要的抗氧化酶,其活力的大小及變化趨勢反映了植物抗性的強弱[12-13]。
不同甘薯品種薯苗接種甘薯黑斑病菌后,體內MDA及抗氧化酶活力性變化不同。不同甘薯品種接種病菌后,體內MDA含量的變化隨時間的增長整體呈現上升趨勢,抗性品種南京92和感病品種煙薯252在120 h(5 d)達到最高值,隨后下降。處理初期,同一時間處理不同的甘薯品種發現,感病品種MDA增長率明顯高于抗病品種,隨著抗性趨勢的增強,與感病品種增長率差異越明顯抗氧化酶SOD隨時間推移增長趨勢呈現先上升后下降,在72 h時除沖繩100是增長,其余品種均為負增長。SOD隨著處理時間推移,無論是增長還是負增長,感病品種增長率低于抗性品種。抗氧化酶POD隨時間增長呈現上升趨勢,隨后增長趨勢下降,同一處理時間不同抗性品種,增長率不同,除處理6 h的徐薯273增長率高于其他品種,高抗品種南京92增長率高于其他品種,表現出明顯的優勢。
綜上所述,甘薯黑斑病菌侵染甘薯薯苗后,抗氧化酶活力增長率與品種抗性呈正比,MDA含量變化也反映了甘薯薯苗抗性強弱。

