一種大量提取獼猴桃不同組織高質量總RNA的方法
劉林婭,楊 那,代 玥,羅 彩,陳 婷,黃亞成
(六盤水師范學院 生物科學與技術學院,貴州 六盤水 553000)
獼猴桃(ActinidiachinensisPlanch.)隸屬獼猴桃科(Actinidiaceae)獼猴桃屬(ActinidiaLindl.),目前全世界共有54個種、21個變種[1]。從20世紀初被人工馴化栽培至今,獼猴桃的商業化種植栽培已在全世界展開,其中我國目前已成為栽培面積最大的國家[2]。獼猴桃果實風味獨特,富含豐富的維生素C、氨基酸、膳食纖維和多種礦物質,是近幾年世界上發展迅速的高檔水果之一[3]。此外,獼猴桃除了具有較高的營養價值外,還具有重要的保健功能[4],如:能通便和清理腸胃;降血脂;防治心血管病;預防癌癥等。因此,近些年獼猴桃越來越受到人們的廣泛關注。
隨著現代分子生物學手段的發展,高通量測序[5]、mRNA純化[6]、cDNA文庫構建[6]和Northern blot[7]等技術已被應用到獼猴桃的研究中,而這些技術能夠開展的前提就是能夠得到純度高、質量好且量多的總RNA。目前,植物中各組織總RNA的提取方法主要有以下幾種:(1)試劑盒提取方法。該方法在提取RNA時一般用時較短,且能得到較高質量的RNA[8]。但是此方法一次提取的費用較高,且提取量較少,不能滿足某些需要大量RNA的實驗。(2)CTAB(十六烷基三甲基溴化銨)法。該法對于大多數的植物能夠得到較高質量的RNA[9],但對于多糖多酚的植物組織,如果不加以改進,則很難適用。(3)熱硼酸法。硼酸鈉能夠很好地結合酚類物質和沉淀糖類,獲得較高質量的RNA[10],但不適用于蛋白含量多、成分復雜的植物組織。(4)SDS(十二烷基磺酸鈉)法。此方法對于橡膠樹膠乳中總RNA的提取效果好[11],但是其細胞裂解能力一般,對于多糖多酚的植物或者細胞壁較厚的組織細胞就很難獲得較高質量的RNA。(5)Trizol法。該方法適于提取擬南芥[12]等植物幼嫩組織的總RNA,但對樹皮、根等組織的提取效果較差,且得到的RNA質量一般也較差。此外,提取RNA的方法還有異硫氰酸胍法[13]、高鹽高pH法[14]、熱酚法[15]等等。不過,很難有一種方法適合所有植物組織的總RNA提取。因此根據不同植物組織的特點在現有的提取方法上改良出更優的方法,從而獲得大量、高質量的總RNA滿足實驗需要很有必要。
獼猴桃屬于富含多糖、蛋白質、礦物質、維生素C、色素和多酚類物質的植物材料,這對于總RNA的提取無疑帶來了大量的困難。為了能夠快速獲得大量、高質量的獼猴桃RNA,本研究對CTAB法進行了改良、優化,利用改良的CTAB法對獼猴桃的7種組織(果實、雄花、雌花、葉片、種子、皮、根)進行了總RNA的提取,并與試劑盒提取法進行了比較,結果證實此方法適用于獼猴桃不同組織總RNA的提取,能夠得到大量、高質量的總RNA,可以滿足分子生物學實驗要求。
1 材料與方法
1.1 實驗材料
本實驗所用的獼猴桃品種為中華獼猴桃“紅陽”,種植在貴州省六盤水市米籮鄉獼猴桃基地。分別采集獼猴桃的果實、雄花、雌花、葉片、種子、皮和根,用錫箔紙包裹存入液氮中,運回實驗室保存于-80 ℃冰箱內,備用。
1.2 試劑
CTAB(十六烷基三甲基溴化銨)、PVPP(交聯聚乙烯吡咯烷酮)、PVP(聚乙烯吡咯烷酮)、DTT(二硫蘇糖醇)、硼酸鈉、EDTA(乙二胺四乙酸)、β-巰基乙醇、LiCl(氯化鋰)、Tris(三羥甲基氨基甲烷)、NaAc(醋酸鈉)購于北京索萊寶科技有限公司;無氯仿多糖多酚植物RNA提取試劑盒購自北京百泰克生物技術有限公司(RP3501);Recombinant DNase I(RNase-free)(2270A)和逆轉錄試劑盒PrimeScriptTMRT reagent Kit with gDNA Eraser(Perfect Real Time)(RR047A)購自大連寶生物工程有限公司; TransTaq?DNA Polymerase High Fidelity(HiFi)購自北京全式金生物技術有限公司(AP131-11);其他所用生化試劑均為國產分析純。引物在上海捷瑞生物工程有限公司合成;測序在上海生物工程技術有限公司完成。
1.3 實驗方法
1.3.1 用改良的CTAB法提取獼猴桃各組織的總RNA 提取液配方:2%(w/v)CTAB, 100 mmol/L Tris-Cl(pH 8.0), 20 mmol/L EDTA(pH 8.0),100 mmol/L硼酸鈉,2.8 mol/L NaCl, 1%(w/v)PVP, 1%(v/v)β-巰基乙醇(現用現加)。
將液氮中保存的植物樣品置于研缽,加入一定量的石英砂、DTT、PVPP,用液氮研磨成粉末,備用。稱取2 g研磨好的樣品,加入5 mL預熱過的提取液和50 μL β-巰基乙醇,在65 ℃下水浴15 min左右(期間振蕩混勻4~5次)。然后加入等體積的酚/氯仿/異戊醇(25∶24∶1),顛倒混勻,在4 ℃下以12000 r/min離心20 min。取上清,加入等體積的氯仿/異戊醇(24∶1),顛倒混勻,在4 ℃下以12000 r/min離心20 min。取上清,加入1/3體積的8 mol/L LiCl,在-20 ℃下放置6 h以上。在4 ℃下以12000 r/min離心20 min,然后倒掉上清,加入200 μL RNase-free的ddH2O溶解沉淀,轉移到1.5 mL的離心管,加入1/10體積 3 mol/L NaAc(pH 5.2)和2.5倍體積的無水乙醇,充分混勻,在-20 ℃下放置2~4 h。在4 ℃下以12000 r/min離心 20 min,倒掉上清,沉淀用750 μL的75%乙醇漂洗2次,放于超凈工作臺上晾干,然后溶于60 μL RNase-free ddH2O中。
1.3.2 用試劑盒法提取獼猴桃各組織的總RNA 參照北京百泰克生物技術有限公司無氯仿多糖多酚植物RNA試劑盒說明書進行獼猴桃各組織總RNA的提取。
1.3.3 總RNA中DNA的去除 使用大連寶生物工程有限公司的Recombinant DNase I(RNase-free)進行總RNA中DNA的去除,具體操作參照該公司的操作說明書。
1.4 RNA的完整性、純度和濃度檢測
采用2%的瓊脂糖凝膠電泳檢測總RNA的完整性,在160 V電壓下電泳20 min后進行凝膠成像。RNA的純度和濃度用NanoDrop 2000超微量核酸蛋白測定儀進行測定,直接讀取總RNA濃度、OD260/OD280值和OD260/OD230值。
1.5 RT-PCR驗證
使用大連寶生物工程有限公司的逆轉錄試劑盒進行cDNA第一鏈的合成,按照該公司的說明書進行操作。搜索本實驗室的獼猴桃轉錄組數據庫,獲得獼猴桃18S rRNA基因序列,設計引物(正向引物:5’-TGTGAAACTGCGAATGGCTC-3’;反向引物:5’-ATTTGAATGATGCGTCGCC-3’),以用兩種方法提取的RNA逆轉錄后的cDNA為擴增模板進行基因的擴增。反應體系:10×PCR Buffer 2.5 μL、2.5 mmol/L dNTP 2 μL、cDNA模板1.5 μL、10 μmol/L的正向引物和反向引物各1 μL、Taq DNA Polymerase 0.2 μL(5 U/μL)、ddH2O 16.8 μL,共25 μL。反應程序:95 ℃預變性5 min;95 ℃變性30 s, 60 ℃退火30 s,72 ℃延伸30 s,共25個循環;72 ℃延伸8 min。PCR擴增產物用1.5%的瓊脂糖凝膠電泳進行檢測。
2 結果與分析
2.1 RNA完整性的檢測結果
采用本實驗室改良的CTAB法和無氯仿多糖多酚植物RNA提取試劑盒兩種方法分別提取了獼猴桃果實、雄花、雌花、葉片、種子、皮和根共7個組織的總RNA。如圖1和圖2所示,采用改良的CTAB法和試劑盒法都能在獼猴桃的7個組織中提取到總RNA,能看到有18S和28S兩條清晰條帶,其中28S條帶的亮度是18S條帶亮度的2倍左右,且兩條帶之間沒有明顯的拖尾現象。這表明這兩種方法都適用于獼猴桃不同組織中總RNA的提取,都能獲得完整性較高的總RNA。

1:果實;2:雄花;3:雌花;4:葉片;5:種子;6:皮;7:根。下同。
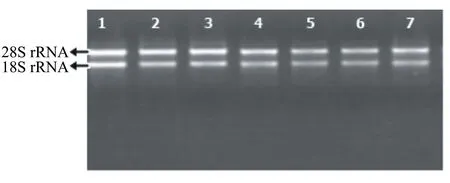
圖2 用試劑盒法提取的總RNA電泳圖
2.2 RNA的純度和濃度檢測結果
利用NanoDrop2000超微量分光光度計對提取好的獼猴桃各組織的總RNA進行檢測。由表1可知,所有RNA的OD260/OD280值在1.8~2.0之間,OD260/OD230值均大于2.0。這表明,不管是本實驗室改良的CTAB法還是試劑盒法,提取得到的獼猴桃不同組織中的總RNA含有的雜質較少,純度較高。比較用改良CTAB法和試劑盒法提取的總RNA的濃度,改良CTAB法的得率遠遠高于試劑盒法,說明該方法實現了對獼猴桃不同組織總RNA的大量提取。結合上述的電泳結果,說明采用本實驗室的提取方法可以獲得大量、高質量的獼猴桃各組織的總RNA。
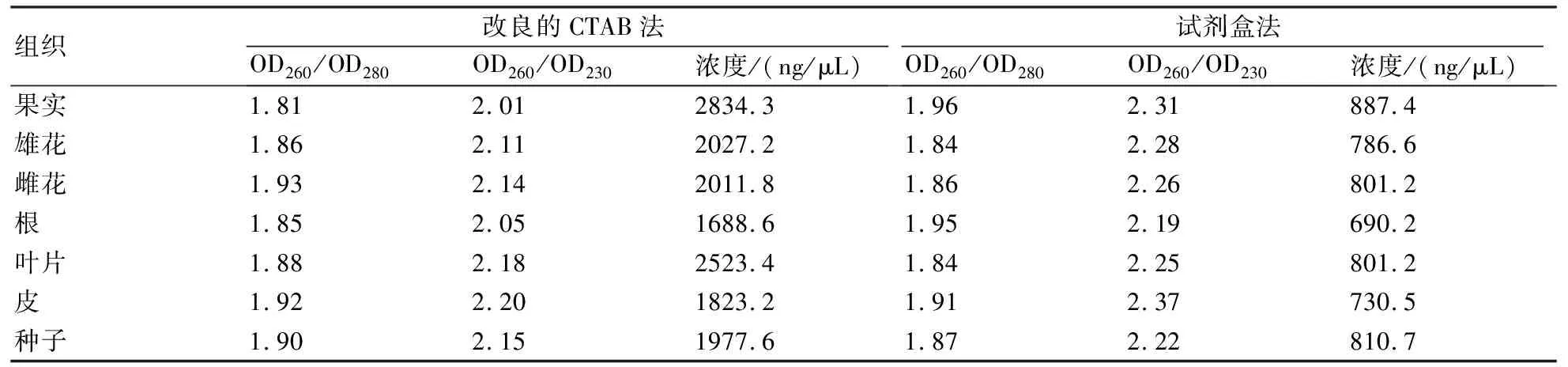
表1 采用兩種方法提取獼猴桃7種組織的總RNA的純度和濃度
2.3 改良CTAB法和試劑盒法的RT-PCR驗證結果
利用購自大連寶生物工程有限公司的逆轉錄試劑盒對兩種方法提取得到的獼猴桃各組織的總RNA進行逆轉錄,獲得了cDNA的第一條鏈。進一步選取內參基因18S rRNA設計特異性引物,以逆轉錄得到的cDNA第一鏈為模板,進行RT-PCR,檢測提取得到的總RNA的質量。圖3的電泳圖顯示,采用兩種方法分別提取的獼猴桃7個組織的總RNA都能擴增得到與目的條帶大小相符的單一條帶。對所有擴增條帶進行測序,測序結果與18s rRNA的序列均一致。這表明,采用兩種方法提取得到的總RNA的質量較高,這兩種方法適于獼猴桃不同組織總RNA的提取。

8:DL1000;7、9:果實;6、10:雄花;5、11:雌花;4、12:葉片;3、13:種子;2、14:皮;1、15:根。
3 討論
眾所周知,提取富含多糖多酚的植物組織材料中的RNA難度一般較大。這主要是由于多糖類物質會形成膠狀物質,很難通過離心得到上清溶液,且其理化性質與RNA極其相似,常常會與RNA共沉淀導致很難去除[16]。而細胞中的多酚類物質在細胞破碎后會迅速被氧化生成醌類物質,與RNA不可逆地結合,導致RNA褐化而難以溶解[17]。獼猴桃的果實富含多糖、多酚類、蛋白質、礦物質、維生素C、色素和其他次生代謝物,屬于較難提取到大量、高質量RNA的植物組織材料。據已有的研究報道,獼猴桃果實中總RNA的提取方法主要有改良的CTAB法[9]、總核酸提取法[18]、異硫氰酸胍提取法[13]、改良的SDS法[19]和試劑盒法[8]。但是相對而言,除了采用試劑盒法能夠得到質量較高的總RNA外,其他已有方法的提取效果都不夠好。而且,之前這些方法主要用于獼猴桃果實RNA的提取,并沒有一種方法適用于獼猴桃所有組織材料RNA的提取。因此本實驗室結合了現有的RNA提取方法,以CTAB法為基礎進行改良,獲得了一種能夠大量提取獼猴桃不同組織總RNA的方法。
本方法采用液氮加石英砂的方法研磨植物組織材料,能大大提高細胞的破碎效率。同時,在研磨的時候加入DTT和PVPP, DTT作為強還原劑能夠保證多酚類物質在研磨和貯存的過程中不被氧化;不可溶的吸附劑PVPP能在一定程度上吸附花色苷、黃酮和多酚類物質。因此加入這兩種物質能在一定程度上降低多酚類、花色苷等物質對RNA提取的影響。CTAB作為一種陽離子表面活性劑,可以在高鹽的環境下結合多糖、多酚和蛋白質,常被用于各種多糖多酚植物RNA的提取。結合獼猴桃組織材料的特點,本實驗室以CTAB法為基礎,在以下方面進行了改良:(1)在提取液中,提高了氯化鈉的濃度,以促進CTAB對多糖、多酚類、蛋白質等物質的結合能力;(2)在提取液中加入了較高濃度的PVP和β-巰基乙醇。β-巰基乙醇作為抗氧化劑可以抑制多酚類物質的氧化,從而提高RNA的產率和純度。此外,PVP還能有效地去除色素、脂類等物質;(3)在提取液中加入了硼酸鈉。硼酸一方面可以與酚類物質結合從而抑制其氧化,另一方面還可以沉淀多糖類物質,從而提高RNA產率和純度[10];(4)在RNA的沉淀過程中,采用了兩步沉淀法。首先用8 mol/L LiCl沉淀6 h以上,高濃度的LiCl可以選擇性沉淀RNA,從而可以在一定程度上減少DNA、糖類和其他雜質的污染。其次,用2.5倍體積的無水乙醇加3 mol/L NaAc(pH 5.2)進行第二次沉淀。低pH的NaAc可以使沉淀的效果更好,從而提高RNA的得率。利用該方法提取得到的RNA只要再用DNase I進行DNA的去除便可以滿足絕大多數分子生物學實驗的要求。通過與市場上專門用來提取多糖多酚類植物組織RNA的試劑盒法比較,該方法確實能在獼猴桃各種組織中提取到大量、高質量的總RNA。相對于試劑盒法,雖然本方法耗時較長,但是獲得的RNA量更多,而且成本也更低。
4 結論
改良的CTAB法和試劑盒法均能用于獼猴桃各組織中總RNA的提取,在具體的實驗中可以根據實際情況進行選擇。改良的CTAB法對其他富含多糖多酚類植物組織中總RNA的提取具有較好的參考價值。

