亞低溫對重型顱腦損傷患者血清神經元特異性烯醇化酶 內皮素-1及Tau蛋白水平的影響
彭月麗 孫榮青
鄭州大學第一附屬醫院,河南 鄭州 450052
重型顱腦損傷是一種常見疾病,在所有創傷性顱腦損傷中占據第2位,但致殘疾、致死率居第1位。相關臨床統計顯示,中國每年出現顱腦創傷患者約60萬,最終死亡占16%~18%,因此采取科學、有效的治療方式能明顯改善重型顱腦損傷患者的預后[1-2]。血清神經元特異性烯醇化酶(neuron-specific enolase,NSE)是神經元和神經內分泌細胞所特有的一種酸性蛋白酶,其在腦組織的細胞中活性最高,是神經細胞能量代謝的關鍵酶[3-5]。研究顯示神經內分泌組織相關的腫瘤患者血清NSE水平顯著升高,NSE水平升高與腫瘤臨床分期及疾病進展有較強的相關性[6],但與小細胞肺癌的腦轉移及轉移部位無明顯相關性,盡管如此,其診斷的靈敏度及特異性均很高,近年來研究發現NSE也是中樞神經系統損傷的敏感性和特異性生化標志物,在病情監測、復發預測及療效評估方面均有重要的臨床意義[7-8]。神經細胞損傷后NSE可釋放進入腦脊液,通過血-腦屏障進入血液循環,因此其與腦水腫、腦外傷的病理生理過程具有密切聯系。內皮素-1(endothelin-1,ET-1) 也可參與多種病理過程,如顱腦損傷的發生、發展及轉歸,是反映腦細胞功能的敏感指標。顱腦創傷后腦組織遭到破壞,刺激血管內皮細胞分泌大量ET-1,引起機體血清中ET-1水平顯著上升[9]。Tau蛋白是一種微管相關蛋白,腦細胞中Tau蛋白的作用為促進微管蛋白的聚合、維持微管結構的穩定,已有研究報道Tau蛋白與創傷性顱腦損傷的病情嚴重程度有顯著相關性,同時可對患者的預后作出判斷[10-11]。
亞低溫治療具有腦保護的作用,是一種通過物理方式使患者的體溫降到預期水平,從而達到治療疾病的目的。研究報道亞低溫治療在減輕腦水腫、降低顱內壓、保護血腦屏障、增加腦灌注等方面均有明顯優勢[12]。本次研究對重型顱腦損傷患者應用亞低溫治療的患者血清NSE、ET-1以及Tau蛋白水平進行分析,探討亞低溫治療的臨床效果。
1 資料與方法
1.1一般資料選取2018-07—2019-07鄭州大學第一附屬醫院治療的重型顱腦損傷患者120例為研究對象,使用隨機數字法將所有患者分為觀察組、對照組。觀察組60例,男35例,女25例,年齡19~70歲,平均42.35歲。對照組60例,男36例,女24例,年齡20~70歲,平均42.37歲。2組一般資料比較差異無統計學意義(P>0.05)。
1.2納入與排除標準納入標準:(1)顱腦損傷后24 h內入住醫院ICU,如急性腦血管疾病、顱腦外傷、顱腦術后;(2)頭顱CT/CTA檢查明確診斷為顱腦損傷;(3)GCS評分3~8分;(4)APACHE-Ⅱ評分<12分;(5)彌漫性腦損傷伴廣泛腦水腫及高ICP者;(6)丘腦下部損傷或伴持續性中樞高熱者。
排除標準:(1)年齡<18周歲或>70周歲;(2)合并全身衰竭期、低血壓休克尚未糾正或伴嚴重心功能不良者;(3)嚴重多發傷患者;(4)合并惡性腫瘤、血液系統疾病患者;(5)初步診斷腦死亡患者。
1.3方法對照組應用常規方式治療,降低患者顱內壓,采取脫水、營養腦細胞等治療措施,同時維持水電解質平衡、調控血壓以及抗感染治療,對需要機械通氣患者使用呼吸機支持治療。觀察組在對照組治療基礎上采用亞低溫治療,使用醫用自動調溫水循環冰毯機、冰帽、藥物,使患者直腸溫度在4~12 h內降至35 ℃以下,維持在33~34 ℃。對于昏迷程度較為嚴重,同時伴呼吸系統并發癥的患者進行早期氣管插管,使用呼吸機維持患者呼吸,在低溫過程中對患者體溫、肌張力、血壓、心率進行密切監測,低溫維持5 d,使用自然復溫法,每隔5 h復溫1 ℃,12~20 h將患者直腸溫度恢復至36~37 ℃[3]。
1.4觀察指標對比2組患者治療前后血清NSE、ET-1、Tau蛋白水平以及治療半年后預后情況。采集治療前、治療1周后患者3 mL外周靜脈血,離心處理后(速率:1 000 r/min,溫度:4 ℃,時間:10 min),分離血清,保存于—20 ℃環境下,使用全自動化學發光免疫分析儀檢測血清NSE以及ET-1,使用酶聯免疫吸附法檢測血清Tau蛋白水平。預后情況分為良好、中殘、重殘、植物生存狀態以及死亡。

2 結果
2.1 2組治療前后血清NSE、ET-1以及Tau蛋白水平對比治療前2組患者血清NSE、ET-1以及Tau蛋白水平差異無統計學意義(P>0.05),治療1周后觀察組患者血清NSE、ET-1以及Tau蛋白水平均明顯低于對照組(P<0.05)。見表1。
2.2 2組患者預后情況對比觀察組患者中殘、重殘以及植物生存狀態人數對比無明顯差異(P>0.05),預后良好率顯著高于對照組,病死率顯著低于對照組,差異均有統計學意義(P<0.05)。見表2。
3 討論
重型顱腦損傷患者繼發嚴重的腦細胞水腫,引起顱內高壓,因此如何采取有效措施緩解顱內壓過高是減少死亡的重要措施[13]。研究顯示去骨瓣減壓術能夠有效緩解患者的自主神經功能恢復,降低患者的病死率,但臨床中也存在不少患者術后腦功能恢復不佳、遠期預后不良的結局[14-15]。目前臨床對該方法治療顱腦損傷的條件、機制均有較為深刻的認識,具有較為完整的方法以及理論基礎。亞低溫治療預后不良的重要因素為治療過程中出現并發癥,因此需要解決的問題是如何廣泛地使用亞低溫治療[16-18]。亞低溫輔助治療顱腦外傷患者的機制包括:(1)減少NO合酶的活性,從而減少NO的合成,減輕NO的組織損傷作用[19];(2)降低腦代謝率,減少腦損傷后腦細胞的氧消耗,從而減輕腦損傷[20];(3)抑制神經遞質的釋放,減少腦細胞內乳酸堆積,減輕細胞的代謝性酸中毒[21];(4)增加神經元蛋白的合成,減少神經元壞死和凋亡,促進細胞間信號傳導的恢復,同時降低彌漫性軸索損傷[22]。

表1 2組治療前后血清NES、ET-1以及Tau蛋白水平對比Table 1 Comparison of serum NES,ET-1 and Tau protein levels before and after treatment in the two
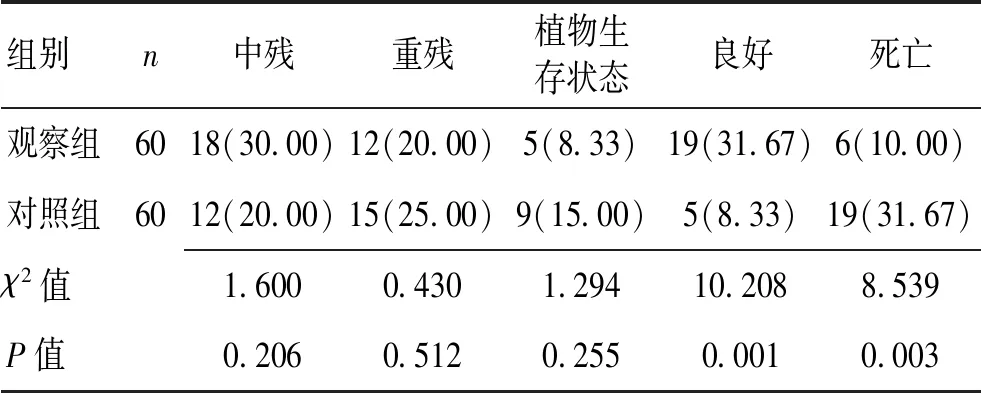
表2 2組患者預后情況對比 [n(%)]Table 2 Comparison of the prognosis of thetwo groups [n(%)]
當患者顱腦受損時,神經髓鞘崩解以及神經元壞死,導致細胞質中NSE進入患者腦脊液中,通過受損血-腦屏障進入血液,使患者血清中NSE水平增加,所以在腦損傷的早期NSE水平迅速上升。隨著腦組織病理以及生理的變化,患者血液及腦脊液中NSE水平降低或上升直到正常為止[23-25]。NSE是參與糖酵解途徑的烯醇化酶中的一種,是神經元損傷的標志酶,其在腦組織細胞中的活性最高,其次是外周神經及神經內分泌組織[26-27],所以其可作為反映腦組織損傷程度特異性的指標。當神經元受損時,NSE大量進入血液,患者血液中NSE水平迅速增高,血清中NSE水平越高,表示患者血-腦屏障以及神經元損傷越嚴重[28-29]。本研究顯示,亞低溫治療1周后觀察組血清NSE水平較對照組急劇下降,表明亞低溫治療可抑制內源性有害因子的產生,改善腦循環,保護腦組織營養代謝。
ET-1是一種多肽血管活性物質,且廣泛存在于各種組織和細胞中,人體腦部微血管內皮細胞、神經元以及神經膠質細胞均能產生ET-1,當患者出現腦外傷時,交感神經興奮性增強,導致釋放的循環兒茶酚胺類物質急劇增加,外周血管強烈收縮,刺激細胞合成與釋放ET-1增加[29];另外,腦水腫增高了顱內壓,腦灌注壓降低,同時缺氧、缺血會刺激血管內皮細胞、神經元以及神經膠質細胞產生ET-1,說明ET-1參與了腦損傷的發生、發展[30-31]。研究發現ET-1在腦血管張力調節方面起血管舒張和收縮作用,顱腦損傷的程度越重,血管內皮合成、釋放ET增加,導致ET-1水平顯著升高[30]。ET-1可促使腦血管痙攣,還可造成繼發性腦損傷。ET-1水平的升高與顱腦外傷后血管緊張素、凝血酶的增多、內皮細胞分泌增加ET合成有關。因此,顱腦外傷患者血漿ET-1水平極度升高時預示著患者預后不良及死亡的風險增大。本研究顯示亞低溫治療后顱腦外傷患者的血清ET-1水平明顯降低,明顯減輕腦損傷的程度,使患者預后得到改善。
Tau蛋白是一種小分子質量神經元微管相關蛋白,主要存在于神經元軸突,對微管穩定性具有維持作用,促進微管形成,是重要神經支架蛋白。當神經受損時,Tau蛋白出現降解,其血清水平會增加,與患者腦神經損傷程度呈正相關。顱腦外傷發生后,機體出現不同程度的軸索損傷,引起中樞神經軸索斷裂,鈣離子超載,氧自由基增多,細胞能量代謝障礙,導致創傷性腦積水[32]。軸索損傷后軸突中的Tau蛋白釋放增加,導致血液中Tau蛋白水平上升,隨著腦水腫的加劇,其水平逐漸升高,因此血清Tau蛋白與患者的預后有明顯相關性。亞低溫治療通過物理方式使患者體溫降至32~35 ℃,能夠減少腦組織的能量消耗,增加腦組織對缺氧、缺血的耐受力,降低內源性物質釋放、產生,避免出現繼發性神經元壞死、顱內壓增高以及腦水腫等,對血-腦屏障具有保護作用,降低腦腫脹出現率[14-15]。本次研究中治療1周后觀察組患者血清Tau蛋白水平均明顯低于對照組(P<0.05),同時預后良好率明顯高于對照組(P<0.05),病死率明顯低于對照組(P<0.05),可能與亞低溫治療能夠降低彌漫性軸索損傷程度有關。因此,對于重型顱腦損傷患者,亞低溫治療能夠明顯降低血清NSE、ET-1以及Tau蛋白水平,可能與減輕細胞結構的破壞、避免神經元凋亡、穩定細胞膜結構、促進腦細胞修復、提升腦血流的作用有關,表明亞低溫治療能夠改善重型顱腦外傷患者的預后,值得臨床推廣。

