暗紋東方鲀魚精蛋白的提取工藝優化研究*
張家源 張洪才 陳舜勝
暗紋東方鲀魚精蛋白的提取工藝優化研究*
張家源1,2張洪才1,2陳舜勝1,2①
(1. 上海海洋大學食品學院 上海 201306;2. 國家淡水水產品加工技術研發分中心(上海)食品科學與工程國家級實驗教學示范中心(上海海洋大學) 上海 201306)
以暗紋東方鲀()精巢組織為原料,采用酸提法提取魚精蛋白。以得率為指標,通過正交實驗,確定了最佳的提取參數。結果顯示,提取魚精蛋白的影響因素重要性依次為:提取次數>硫酸用量>硫酸濃度>95%乙醇用量;最佳提取工藝條件:硫酸濃度為0.2 mol/L、硫酸用量為2.5倍、提取次數為2次、95%乙醇用量為2.5倍。在此工藝條件下,暗紋東方鲀魚精蛋白的得率為3.82%,蛋白含量達89.01%。通過十二烷基硫酸鈉聚丙烯酰胺凝膠電泳(Tricine-SDS-PAGE)可知,提取的粗魚精蛋白有2個條帶,分子量分別在25和20 kDa附近。分析其氨酸酸組成發現,暗紋東方鲀魚精蛋白屬于雙魚精蛋白,其中,精氨酸和丙氨酸含量相對較高,分別占31.40%和17.39%。本研究對暗紋東方鲀魚精蛋白更好地應用在食品和醫藥領域具有重要意義。
暗紋東方鲀;魚精蛋白;提取;工藝優化
魚類的精巢俗稱魚白,因其具有特殊的氣味,常被作為廢棄物丟棄,是魚類加工的副產品之一。從魚類的精巢中可以提取到一種堿性蛋白質,即魚精蛋白。魚精蛋白(Protamine)又稱精蛋白,是一種高度聚陽離子肽,可代替精子細胞中的組蛋白,當其與DNA結合時形成核蛋白,等電點在11~13之間(Xie, 2018; Egawa, 2008; Fu, 2019; Potter, 2005)。魚精蛋白的分子量較小,由30~50個氨基酸組成,可溶于水,不溶于丙酮、乙醚等有機溶劑,富含核酸、蛋白和微量元素等活性成分(陳金梅等,2015)。由于魚精蛋白特殊的生物學組成而使其異于其他蛋白質有著獨特的功能。魚精蛋白是肝素唯一的拮抗劑,可用于外科手術后中和肝素,同時,由于魚精蛋白具有良好的生物兼容性,因此,可作為運輸藥物的載體(Gill, 2006; Kishimoto, 2012; Park, 2017; González-Aramundiz, 2015; Sommers, 2017)。此外,魚精蛋白還可作為一些食品中的抗菌成分應用在食品保鮮領域,具有安全性高、抗菌性能好、熱穩定性高等優點。其在堿性條件下具有明顯的抗菌活性,是一種很有前途的抗菌劑(Guan, 2017)。因此,無論在醫學領域還是食品領域,魚精蛋白都有著重要的作用和應用價值。
魚精蛋白常以DNA-蛋白質的形態存在,其結合鍵不牢固,易斷開,可用硫酸將其斷開,制成魚精蛋白硫酸鹽,再用有機溶劑析出沉淀(李若綺等, 2014)。提取反應過程:DNA-蛋白質+H2SO4→硫酸魚精蛋白+DNA+H2O(吳燕燕等, 1999)。對DNA-核蛋白和RNA-核蛋白溶解度的研究發現,當NaCl濃度為 0.14 mol/L時,DNA-核蛋白溶解度僅為水中溶解度的1%,而RNA-核蛋白有相當大的溶解度,因此,選用0.14 mol/L NaCl來沉淀DNA-核蛋白(謝俊杰等, 2002)。因魚的種類不同,提取得到的魚精蛋白也存在較大差異。目前,國內外學者主要從鮭魚()和鯡魚()的成熟精巢中提取魚精蛋白,而對河鲀()魚精蛋白的研究較少。河鲀,又名鲀、吹肚魚、氣泡魚等,屬硬骨魚綱、鲀形目、鲀科、東方鲀屬,主要分布在我國渤海、東海、黃海及江河下游,為近海與河川底層肉食性海產有毒魚類(楊春等, 2003)。野生河鲀毒性較高,而人工養殖的河鲀基本無毒。中國河鲀資源豐富,據統計,中國海水養殖河鲀產量約為23000 t,淡水養殖河鲀產量約為5000 t。暗紋東方鲀()是主要養殖種類之一,主要養殖區域是江蘇、廣東和福建地區(張迪等, 2017)。江蘇地區主要為淡水養殖河鲀,產量約占全國總河鲀淡水養殖的68%。
本研究以暗紋東方鲀精巢為原料,采用酸法提取魚精蛋白,通過6個單因素實驗,探討硫酸濃度、硫酸用量、提取時間、提取次數、提取溫度和95%乙醇用量對魚精蛋白提取的影響,并通過正交法優化其提取工藝,得到最佳提取工藝條件,通過十二烷基硫酸鈉–聚丙烯酰胺凝膠電泳(Tricine-SDS-PAGE)分析暗紋東方鲀魚精蛋白的分子量,并對其氨基酸含量進行測定。本研究對河鲀精巢的高效利用具有重大意義,以期河鲀魚精蛋白可以更好地應用在食品和醫藥領域。
1 材料與方法
1.1 材料與試劑
暗紋東方鲀精巢(2019年2月,冷凍運輸)江蘇中洋集團提供。
NaCl、95%乙醇、丙酮、乙醚和硫酸(均為分析純),國藥集團上海化學試劑有限公司;考馬斯亮藍染色液G-250、SDS-PAGE電泳液、BeyoGelTMSDS- PAGE預制膠(4%~20%),上海碧云天生物技術有限公司;2×Protein Loading Buffer,天根生化科技(北京)有限公司;Real Band蛋白預染,美國Marker Bio Basic Inc (BBI);蛋白定量測試盒,南京建成生物工程研究所。
1.2 儀器與設備
FJ-200高速分散均質機,上海標本模型廠;GL- 26M/MI立式高速冷凍離心機,上海趙迪生物科技有限公司;AUW320電子分析天平,日本島津公司;凝膠成像系統,上海天能科技有限公司;UV-1800PC紫外可見分光光度計,上海美譜達儀器有限公司;氨基酸自動分析儀L-8800,日本日立公司;LGJ-12冷凍干燥機,河南兄弟儀器設備有限公司;DHG-9076A 型電熱恒溫鼓風干燥箱,上海精宏實驗設備有限公司;TY-80A/S脫色搖床,江蘇省金壇市榮華儀器制造有限公司;DYCZ-24DN電泳槽、DYY-6C型電泳儀,北京六一儀器廠。
1.3 方法
1.3.1 樣品制備 將暗紋東方鲀精巢組織解凍后,用蒸餾水清洗干凈(主要去除附著的雜物,如結締組織、腺體、脂肪等),瀝干水分,分裝在密封袋中(每袋約200 g),–30℃冷藏備用。
1.3.2 原料基本營養成分測定 水分測定參考(GB 5009.3-2016)《食品中水分的測定》中的直接干燥法;灰分測定參考(GB 5009.4-2016)《食品中灰分的測定》中的食品中總灰分的測定;蛋白質測定參考(GB 5009.5-2016)《食品中蛋白質的測定》中的凱氏定氮法;脂肪測定參考(GB 5009.6-2016)《食品中脂肪的測定》中的索氏抽提法。
1.3.3 暗紋東方鲀魚精蛋白提取工藝 工藝流程:解凍后的精巢組織→搗碎→勻漿→離心→棄上清液,沉淀重復操作1次→H2SO4溶液提取→離心→收集離心的上清液→過濾→冷乙醇沉淀→丙酮洗滌→乙醚洗滌→冷凍干燥→魚精蛋白粗品。
參照白嬋等(2018)和曹文紅等(2017)的方法稍作修改。稱取100 g暗紋東方鲀精巢于組織搗碎機中,加入2倍體積0.14 mol/L的NaCl溶液,勻漿1 min,冰浴攪拌15 min,靜置15 min,于4℃、8000 r/min離心10 min,棄上清液,沉淀重復操作1次,收集沉淀,加入H2SO4,在一定溫度下提取一定時間,4℃、10000 r/min離心10 min,收集離心的上清液,過濾,濾液用一定體積的95%乙醇冰浴沉淀過夜后離心,所得沉淀用丙酮洗滌2次,乙醚洗滌1次,冷凍干燥即得暗紋東方鲀魚精蛋白粗品。
1.3.4 硫酸提取法提取條件單因素實驗
(1)硫酸濃度對暗紋東方鲀魚精蛋白得率的影響
設定硫酸用量為3倍(ml/g),提取溫度為(25±1)℃,提取時間為0.5 h,提取2次,95%乙醇用量為3倍(ml/g),分別控制硫酸濃度為0.1、0.3、0.5、0.7和0.9 mol/L,探討硫酸濃度對暗紋東方鲀魚精蛋白得率的影響。
(2)硫酸用量對暗紋東方鲀魚精蛋白得率的影響
設定硫酸濃度為0.3 mol/L,提取溫度為(25±1)℃,提取時間為0.5 h,提取2次,95%乙醇用量為3倍(ml/g),分別控制硫酸用量為1、2、3、4和5倍,探討硫酸用量對暗紋東方鲀魚精蛋白得率的影響。
(3)提取次數對暗紋東方鲀魚精蛋白得率的影響
設定硫酸濃度為0.3 mol/L,硫酸用量為3倍(ml/g),提取溫度為(25±1)℃,提取時間為0.5 h,95%乙醇用量為3倍(ml/g),分別控制提取次數為1、2、3、4和5次,探討提取次數對暗紋東方鲀魚精蛋白得率的影響。
(4)提取時間對暗紋東方鲀魚精蛋白得率的影響
設定硫酸濃度為0.3 mol/L,硫酸用量為3倍(ml/g),提取溫度為(25±1)℃,提取2次,95%乙醇用量為3倍(ml/g),分別控制提取時間為0.5、1.0、1.5、2.0和2.5 h,探討提取時間對暗紋東方鲀魚精蛋白得率的影響。
(5)提取溫度對暗紋東方鲀魚精蛋白得率的影響
設定硫酸濃度為0.3 mol/L,硫酸用量為3倍(ml/g),提取時間為0.5 h,提取2次,95%乙醇用量為3倍(ml/g),分別控制提取溫度為10℃、20℃、30℃、40℃和50℃,探討提取溫度對暗紋東方鲀魚精蛋白得率的影響。
(6) 95%乙醇用量對暗紋東方鲀魚精蛋白得率的影響
設定硫酸濃度為0.3 mol/L,硫酸用量為3倍(ml/g),提取溫度為(25±1)℃,提取時間為0.5 h,提取2次,分別控制95%乙醇用量為1、2、3、4和 5倍,探討95%乙醇用量對暗紋東方鲀魚精蛋白得率的影響。
1.3.5 硫酸提取法正交實驗 根據單因素實驗結果,選擇硫酸濃度、硫酸用量、提取次數和95%乙醇用量進行L9(34)正交實驗,以確定暗紋東方鲀魚精蛋白的最佳提取工藝條件,實驗因素與水平設計見表1。
表1 L9(34)暗紋東方鲀魚精蛋白提取工藝正交實驗設計因素水平

Tab.1 Factors and their levels used in L9(34 ) orthogonal design of the extraction of T. obscurus protamine experiments
1.3.6 暗紋東方鲀魚精蛋白得率的測定 準確稱取10 mg提取的粗魚精蛋白,用生理鹽水定容至10 ml,配制成1 mg/ml的蛋白溶液。再用蛋白定量試劑盒進行測定。
蛋白質提取率按公式(1)計算:

式中,1為暗紋東方鲀魚精蛋白得率(%),1為蛋白質量(g),0為暗紋東方鲀精巢質量(g)。
1.3.7 暗紋東方鲀魚精蛋白相對分子質量的測定
采用十二烷基硫酸鈉–聚丙烯酰胺凝膠電泳(Tricine-SDS-PAGE)對提取的暗紋東方鲀魚精蛋白進行分析,以確定該魚精蛋白的相對分子質量。100 v恒壓電泳約100 min,至溴酚藍遷移至距凝膠下端約1 cm處,停止電泳,取出凝膠,用考馬斯亮藍染色液染色30 min,再用脫色液脫色至背景褪色、條帶清晰可見(Compton, 1985; Sedmak, 1977; Sch?gger, 2006)。測量遷移距離,計算相對遷移率(f)(徐明生等, 2004)。
1.3.8 暗紋東方鲀魚精蛋白的氨基酸組成 采用GB 5009.124-2016《食品中氨基酸的測定方法》進行樣品前處理。
氨基酸自動分析儀條件:色譜柱(4.6 mm I.D.×60.0 mm);分離樹脂:陽離子交換樹脂;柱溫度: 57℃;檢測波長:570 nm(脯氨酸440 nm);1通道緩沖溶液流速:0.40 ml/min;反應液:茚三酮試劑;2通道反應液流速:0.35 ml/min;進樣量:20 μl。
1.4 數據處理
所測結果為3次重復實驗的平均值,采用Origin 8.5軟件進行作圖,SPSS Statistics 17.0軟件進行數據統計分析。
2 結果與分析
2.1 暗紋東方鲀精巢基本成分
暗紋東方鲀精巢的營養成分見表2。從表2可以看出,含水量較高,達80.22%;其次是粗蛋白,占濕重的的14.66%;脂肪含量較低,僅占濕重的1.73%。通過計算,粗蛋白占暗紋東方鲀精巢干重的74.12%,脂肪占8.75%,說明暗紋東方鲀精巢是富含蛋白質,而脂肪含量很低的產品,與胡曉璐等(2013)研究的魷魚精巢組織基本成分的結論一致。
表2 暗紋東方鲀精巢的基本成分
注: 各組分含量按濕重計
Note: The content of every composition was counted on wet weight
2.2 暗紋東方鲀魚精蛋白提取工藝單因素實驗
2.2.1 硫酸濃度對暗紋東方鲀魚精蛋白得率的影響
硫酸濃度對暗紋東方鲀魚精蛋白得率的影響見圖1。低濃度的硫酸對魚精蛋白提取不完全,硫酸與魚精蛋白結合較少,生成的魚精蛋白硫酸鹽較少,得率較低,適當提高硫酸濃度,可幫助拆分核酸與目標蛋白之間的鍵,提高目標蛋白得率,當濃度達到 0.3 mol/L時,蛋白的提取接近飽和,得率為3.51%,出現峰值后,得率會隨濃度的增大而降低,此時,高濃度的硫酸會使蛋白質暴露出更多的疏水基團(Omana, 2010),從而破壞蛋白結構,導致蛋白質可能被部分水解,降低了魚精蛋白的含量。該結果與劉淑集等(2019)的研究一致,均表現出相對較高濃度的硫酸會使魚精蛋白的得率下降。從圖1中還可以看出,暗紋東方鲀魚精蛋白受硫酸濃度影響明顯,所以選擇硫酸濃度值為0.3 mol/L為最適宜條件。
2.2.2 硫酸用量對暗紋東方鲀魚精蛋白得率的影響
硫酸用量對得率的影響見圖2。硫酸用量從1 ml/g (體積與質量比,下同)增加到5 ml/g時,魚精蛋白得率呈先升高、后降低,最后趨于平穩的變化趨勢。當硫酸用量較少時,體系過小而導致魚精蛋白溶解不完全,適當增加硫酸提取液有助于魚精蛋白溶出,當硫酸用量為3 ml/g時,魚精蛋白得率最高,蛋白質溶出達到飽和,繼續增加硫酸用量,魚精蛋白得率出現小幅度降低,主要是因為提取液體積過大,增加了操作體系的整體規模,也增大操了作過程中的損失率,因而對得率產生負面影響。故使得蛋白得率最大化的最佳硫酸用量為3 ml/g。

圖2 硫酸用量對暗紋東方鲀魚精蛋白得率影響
2.2.3 提取次數對暗紋東方鲀魚精蛋白得率的影響
提取次數對魚精蛋白得率的影響見圖3。暗紋東方鲀魚精蛋白經過2次提取后,繼續增加提取次數時,得率反而降低,說明殘渣中可提取的魚精蛋白在第2次基本被提取完全,繼續重復提取只會增加操作過程中的損失,降低魚精蛋白得率。因此,提取次數2次為最佳。
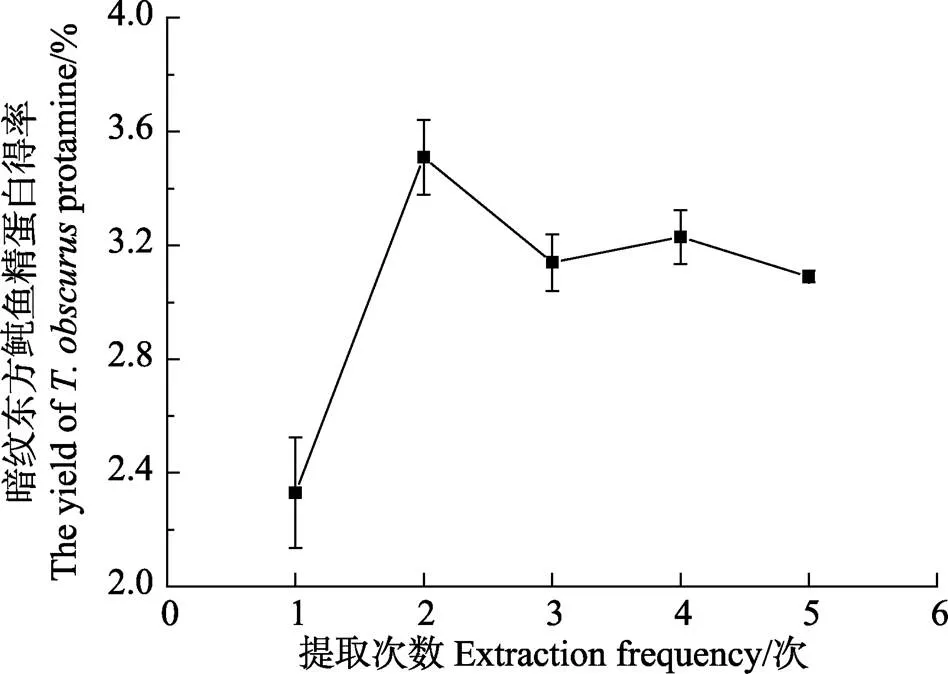
圖3 提取次數對暗紋東方鲀魚精蛋白得率的影響
2.2.4 提取時間對暗紋東方鲀魚精蛋白得率的影響
提取時間對暗紋東方鲀魚精蛋白得率的影響見圖4。隨著提取時間從0.5 h延長到2.5 h,暗紋東方鲀魚精蛋白得率整體呈下降趨勢,說明延長提取時間不能提高魚精蛋白的得率。從加入硫酸開始提取計時,0.5 h前,硫酸會輔助魚精蛋白與核酸之間的鍵斷開,隨著時間的增加,得率逐漸降低,可能是因為之前被分離出來的魚精蛋白被酸水解,因此,絕大多數的精蛋白都在0.5 h內被提取出來。綜合來看,0.5 h時,魚精蛋白溶解量與損失量差值達到最大化,得率較高,提取較為充分,故選取提取時間為0.5 h比較合適。
2.2.5 提取溫度對暗紋東方鲀魚精蛋白得率的影響
提取溫度對暗紋東方鲀魚精蛋白得率的影響見圖5。溫度較低時,對魚精蛋白得率產生副作用,當溫度從10℃升高到50℃時,魚精蛋白得率呈現先升高后趨于平穩的趨勢。因為適當升高溫度可使分子的運動速度加快,提高了蛋白的溶出率(洪晶等,2013)。繼續增加溫度,魚精蛋白得率沒有明顯升高,而是在此基礎上浮動,說明該魚精蛋白的耐熱性較好,不易受溫度的影響而變性。總體來看,溫度對河鲀魚精蛋白的提取率影響并不大,提取得到的蛋白均為白色,因此,在簡化提取條件和節約操作成本的角度考慮,選取室溫提取比較好。
2.2.6 95%乙醇用量對暗紋東方鲀魚精蛋白得率的影響 乙醇用量對魚精蛋白得率的影響見圖6。隨著乙醇用量的增大,暗紋東方鲀魚精蛋白得率呈先增長后降低的趨勢,用量3倍時,得率達到最高點,繼續增加乙醇用量,魚精蛋白得率呈緩慢下降趨勢,可能是乙醇用量過大,破壞了蛋白的結構,影響得率。因此,最佳用量為3 ml/g。

圖5 提取溫度對暗紋東方鲀魚精蛋白得率的影響

圖6 乙醇用量對暗紋東方鲀魚精蛋白得率影響
2.3 暗紋東方鲀魚精蛋白提取工藝優化
根據單因素實驗結果,分別以硫酸濃度、硫酸用量、提取次數和95%乙醇用量為考察因素,以暗紋東方鲀魚精蛋白得率為評價指標,按L9(34)進行正交實驗,優化最佳提取條件,結果見表3。
由表3可知,在9個實驗設計組中,第4組的提取效果最好,蛋白得率達到3.04%;其次為第2組,蛋白得率達到3.01%;由極差分析可知,影響暗紋東方鲀魚精蛋白得率的因素主次為:C>B>A>D,即提取次數>硫酸用量>硫酸濃度>95%乙醇用量。暗紋東方鲀魚精蛋白提取最優工藝組合為A1B1C2D1,即硫酸濃度為0.2 mol/L、硫酸用量為2.5倍、提取次數為2次、冷乙醇用量為2.5倍。該工藝條件下提取的魚精蛋白得率可達3.82%,高于各實驗組中暗紋東方鲀魚精蛋白的得率。
表3 L9(34)暗紋東方鲀魚精蛋白提取工藝正交實驗結果

Tab.3 L9(34) orthogonal result of the extraction of T. obscurus protamine
由表4可知,校正模型具有顯著性,其中,硫酸濃度(A)、硫酸用量(B)對提取率的影響(<0.05),提取次數(C)對提取率的影響(<0.01),95%乙醇用量(D)對提取率的影響(>0.05),依次對應與蛋白得率的關系依次為顯著、顯著、極顯著和不顯著。四者在暗紋東方鲀魚精蛋白提取過程中需重點控制的順序為:提取次數>硫酸用量>硫酸濃度>95%乙醇用量。
表4 正交實驗方差分析

Tab.4 Analysis of variance of the experimental results of orthogonal array design
*:差異顯著,<0.05;**:差異極顯著,<0.01
*: The difference is significant,< 0.05; **: The difference is highly significant,<0.01
2.4 SDS-聚丙烯酰胺凝膠電泳
利用十二烷基硫酸鈉–聚丙烯酰胺凝膠電泳(Tricine-SDS-PAGE)確定暗紋東方鲀精巢中抗菌活性蛋白的相對分子量及分析其成分組成見圖7。由圖7可知,所提取的暗紋東方鲀精巢組織中的抗菌活性蛋白組分由2個條帶組成,主體成分相對分子量在17~ 25 kDa之間。經計算,暗紋東方鲀魚精蛋白2條區帶的相對遷移率(f)分別為0.7814和0.8772。以標準蛋白分子量的對數為縱坐標,相對遷移率(f)為橫坐標,進行直線回歸分析(圖8),回歸系數2=0.9934,回歸方程為=–1.1073+2.2321。暗紋東方鲀魚精蛋白的分子量分別為23.27和18.23 kDa。在相關魚類精巢抗菌活性蛋白的研究中,此抗菌活性蛋白的相對分子質量大于徐明生等(2004)測得鯉魚()抗菌魚精蛋白純品的分子量(15.32 kDa)。本研究提取的暗紋東方鲀粗魚精蛋白有2個條帶,分析其原因主要有2點,一是樣品中含有其他雜蛋白,二是該蛋白質分子具有幾個亞基。也有研究表明,魚類精巢抗菌活性蛋白組分并不單一,它是由互相類似的數種成分組成。

圖7 暗紋東方鲀魚精蛋白Tricine-SDS-PAEG電泳
M:預染蛋白Marker;A:暗紋東方鲀魚精蛋白
M: Pre-stained protein marker; A:protamine

圖8 相對分子質量標準曲線
2.5 暗紋東方鲀魚精蛋白的氨基酸組成
暗紋東方鲀魚精蛋白的氨基酸組成見表5,從 表5中可以看出,丙氨酸和精氨酸是是該魚精蛋白的主要氨基酸,相對含量分別為17.39%和31.40%,約占總氨基酸的50%。這與劉紅玉等(2007)研究的大馬哈魚()的氨基酸組成較為類似,均含有較高的精氨酸。堿性氨基酸(精氨酸、賴氨酸和組氨酸)占31.87%,與鰱魚()中堿性氨基酸含量相近(謝俊杰等, 2001)。但與俞加林(1994)文中提到的精氨酸占2/3以上的結果有明顯差別。分析其原因可能是隨著時間的延長,人工養殖的河鲀由于食物、地理位置和環境等差異,導致目前河鲀精巢的氨基酸組成與過去有所差異。根據氨基酸的組成和種類,可將魚精蛋白分為3類,分別是單魚精蛋白、雙魚精蛋白和三魚精蛋白。因暗紋東方鲀魚精蛋白含有精氨酸和組氨酸,所以屬于雙魚精蛋白。
表5 暗紋東方鲀魚精蛋白氨基酸組成分析

Tab.5 Amino acid composition analysis of T. obscurus protamine
*:必需氨基酸;–:未檢測到
*: Essential amino acid; – : Not detected
3 結論
本研究采用硫酸提取法提取暗紋東方鲀魚精蛋白,通過正交實驗法優化得到最佳提取工藝:硫酸濃度為0.2 mol/L、硫酸用量為2.5倍、提取次數為2次、冷乙醇用量為2.5倍。影響暗紋東方鲀魚精蛋白得率的因素主次為:提取次數>硫酸用量>硫酸濃度>95%乙醇用量。溫度對暗紋東方鲀魚精蛋白的得率影響較小,說明暗紋東方鲀魚精蛋白具有很好的耐熱性。在最佳提取工藝條件下,暗紋東方鲀魚精蛋白的得率最大為3.82%。由Tricine-SDS-PAGE電泳可知,魚精蛋白的分子量較小,粗提法得到的魚精蛋白經電泳后出現2個條帶,說明該粗魚精蛋白雜質較少。經計算,暗紋東方鲀魚精蛋白的分子量分別為23.27和 18.23 kDa。丙氨酸和精氨酸是是該魚精蛋白的主要氨基酸,相對含量分別為17.39%和31.40%,約占總氨基酸的50%。根據氨基酸的組成種類和數量來分,暗紋東方鲀魚精蛋白屬于雙魚精蛋白。該研究為河鲀魚精蛋白的高效利用奠定理論基礎。接下來可對該魚精蛋白的理化特性進一步研究。
Bai C, Rao DH, Xiong GQ,Enzymatic extraction optimization of protamine peptides from sturgeon by response surface methodology. Food and Fermentation Industries, 2018, 44(4): 180–185 [白嬋, 饒丹華, 熊光權, 等. 響應面法優化鱘魚精蛋白肽的酶解提取. 食品與發酵工業, 2018, 44(4): 180–185]
Cao WH, Liu ZJ, Lin Y,. Optimization of the extraction technology and preliminary study on antibacterial activity of protamine from the testis of Giant grouper. Food Science and Technology, 2017, 42(11): 261–265 [曹文紅, 劉忠嘉, 林蕓, 等. 中巨石斑魚精巢魚精蛋白提取工藝優化及其抗菌活性的初步研究. 食品科技, 2017, 42(11): 261–265]
Chen JM, Li F, Zheng YQ,. The review of comprehensive utilization with high value of squid processing by-products. Fishery Modernization, 2015, 42(1): 44–47 [陳金梅, 李鋒, 鄭允權, 等. 魷魚加工副產物高值化綜合利用綜述. 漁業現代化, 2015, 42(1): 44–47]
Compton SJ, Jones CG. Mechanism of dye response and interference in the Bradford protein assay. Analytical Biochemistry, 1985, 151(2): 369–374
Egawa Y, Hayashida R, Seki T,Fluorometric determination of heparin based on self-quenching of fluorescein-labeled protamine. Talanta, 2008, 76(4): 736–741
Fu XD, Liu YN, Zhu L,Flocculation activity of carp protamine in microalgal cells. Aquaculture, 2019, 505: 150–156
Gill TA, Singer DS, Thompson JW. Purification and analysis of protamine. Process Biochemistry, 2006, 41(8): 1875–1882
González-Aramundiz JV, Olmedo MP, González- Fernández á,Protamine-based nanoparticles as new antigen delivery systems. European Journal of Pharmaceutics and Biopharmaceutics, 2015, 97(Pt A): 51–59
Guan GM, Sha JC, Zhu DD. Heparin-MPA dual modified CdS quantum dots used as a simple and rapid label-free fluorescent sensor for protamine and hemin detection. Microchemical Journal, 2017, 133: 391–397
Hong J, Chen TT, Tang MR,Optimization of protein extraction technology from Chinese Leek seeds by response surface method. Journal of Chinese Institute of Food Science and Technology, 2013, 13(12): 89–96 [洪晶, 陳濤濤, 唐夢茹, 等. 響應面法優化韭菜籽蛋白質提取工藝. 中國食品學報, 2013, 13(12): 89–96]
Hu XL, Liu SJ, Wu CY. The extraction process research of squid protamine. Journal of Fujian Fisheries, 2013, 35(6): 434–440 [胡曉璐, 劉淑集, 吳成業. 魷魚魚精蛋白的提取工藝優化研究. 福建水產, 2013, 35(6): 434–440]
Kishimoto S, Ishihara M, Takikawa M,. Novel experimental and clinical therapeutic uses of low-molecular-weight heparin/ protamine microparticles. Pharmaceutics, 2012, 4(1): 42–57
Li RQ, Han L, Li RR,Optimization of ultrasonic assistant protamine extraction processing parameters using response surface methodology in bovine testes. Science and Technology of Food Industry, 2014, 35(16): 212–216 [李若綺, 韓玲, 李儒仁, 等. 超聲波輔助提取牛睪丸中精蛋白工藝優化. 食品工業科技, 2014, 35(16): 212–216]
Liu HY, Jiang XF, Cui HB. Study on Extraction and antimicrobial activities of protamine fromspermary. Food Science, 2007, 28(2): 37–39 [劉紅玉, 姜學芬, 崔洪斌. 大馬哈魚魚精蛋白的提取及抑菌作用的研究. 食品科學, 2007, 28(2): 37–39]
Liu SJ, Chen WY, Xu M,Study on optimization of the extraction of protamine from. Fishery Modernization, 2019, 46(2): 73–80 [劉淑集, 陳梧英, 許旻, 等. 菊黃東方鲀魚精蛋白提取工藝優化研究. 漁業現代化, 2019, 46(2): 73–80]
Omana DA, Xu Y, Moayedi V,Alkali-aided protein extraction from chicken dark meat: Chemical and functional properties of recovered proteins. Process Biochemistry, 2010, 45(3): 375–381
Park J, Hwang SR, Choi JU,Self-assembled nanocomplex of PEGylated protamine and heparin-suramin conjugate for accumulation at the tumor site. International Journal of Pharmaceutics, 2017, 535(1–2): 38–46
Potter R, Hansen LT, Gill TA. Inhibition of foodborne bacteria by native and modified protamine: Importance of electrostatic interactions. International Journal of Food Microbiology, 2005, 103(1): 23–34
Sch?gger H. Tricine-SDS-PAGE. Nature Protocols, 2006, 1(1): 16–22
Sedmak JJ, Grossberg SE. A rapid, sensitive, and versatile assay for protein using Coomassie brilliant blue G250. Analytical Biochemistry, 1977, 79(1–2): 544–552
Sommers CD, Ye HP, Liu J,. Heparin and homogeneous model heparin oligosaccharides form distinct complexes with protamine: Light scattering and zeta potential analysis. Journal of Pharmaceutical and Biomedical Analysis, 2017, 140: 113–121
Wu YY, Li LH, Yang XQ,. Study on the extraction process of nucleoprotein and protamine. Food Science, 1999(7): 30–33 [吳燕燕, 李來好, 楊賢慶, 等. 核蛋白和魚精蛋白提取工藝的研究. 食品科學, 1999(7): 30–33]
Xie JJ, Xiong Y, Zhao L,Purification and identification of chubprotamine. Jiangxi Science, 2001, 19(4): 214–217 [謝俊杰, 熊瑜, 趙利, 等. 鰱魚()魚精蛋白的純化和鑒定. 江西科學, 2001, 19(4): 214–217]
Xie JJ, Zhao L, Xiong Y,Extraction of squid protamine. Journal of Beijing Fisheries, 2002(5): 35–37 [謝俊杰, 趙利, 熊瑜, 等. 鰱魚魚精蛋白的提取. 北京水產, 2002(5): 35–37]
Xie M, Zhang F, Liu LJ,Surface modification of graphene oxide nanosheets by protamine sulfate/sodium alginate for anti-cancer drug delivery application. Applied Surface Science, 2018, 440: 853–860
Xu MS, Chen JP, Shang Guan XC. Separation, purification and identification a kind of protein with antibacterial activity from cypriniod. Science and Technology of Food Industry, 2004, 25(10): 51–54 [徐明生, 陳錦屏, 上官新晨. 鯉魚抗菌精蛋白的分離純化及鑒定. 食品工業科技, 2004, 25(10): 51–54]
Yang C, Su XR, Li TW,Extraction and determination of tetrodotoxin from low toxicity pufferfish. Natural Product Research and Development, 2003, 15(5): 398–400 [楊春, 蘇秀榕, 李太武, 等. 低毒河豚魚毒素的提取和檢測. 天然產物研究與開發, 2003, 15(5): 398–400]
Yu JL. Fish essence: New medicinal resources worth developing. Chinese Marine Medicine, 1994, 13(2): 53–54 [俞加林. 魚精: 值得開發的藥用新資源. 中國海洋藥物, 1994, 13(2): 53–54]
Zhang D, Yang ZY, Zhang YL. Development status and development countermeasures of China's puffer-fish breeding industry. Scientific Fish Farming, 2017(12): 1–3 [張迪, 楊正勇, 張英麗. 中國河鲀養殖產業發展現狀與發展對策. 科學養魚, 2017(12): 1–3]
Optimization of Extraction Process of Protamine from
ZHANG Jiayuan1,2, ZHANG Hongcai1,2, CHEN Shunsheng1,2①
(1. College of Food Science and Technology, Shanghai Ocean University, Shanghai 201306;2. National Research and Development Branch Center for Freshwater Aquatic Products Processing Technology (Shanghai),National Experimental Teaching Demonstration Center of Food Science and Engineering (Shanghai Ocean University), Shanghai 201306)
The fish's testis, commonly known as fish white, is often discarded as waste owing to its specific odor and is one of the by-products of fish processing. A basic protein, protamine, can be extracted from the testis of fish. Protamine has the advantages of high safety, good antibacterial performance, and high thermal stability. It can be used as an antibacterial ingredient in some foods in the field of food preservation. It has obvious antibacterial activity under alkaline conditions and is a promising antibacterial agent. Here, the testis ofwas used as the raw material, and the protamine was extracted by acid extraction. The extraction coefficient was used to determine the optimal extraction parameters. According to the results of orthogonal test, the importance factors of the extraction of protamine are as follows: extraction times > sulfuric acid dosage > sulfuric acid concentration>95% ethanol; optimal extraction conditions are: sulfuric acid concentration 0.2 mol/L, sulfuric acid dosage is 2.5 times, the number of extractions was 2, and the amount of 95% ethanol was 2.5 times. Under this condition, the extraction rate of protamine fromwas 3.82%, and the protein content was 89.01%. According to the tricine-SDS-PAGE, the extracted crude protamine has two bands with molecular weights of 25 kDa and 20 kDa, respectively. Analysis of its lytic acid composition found that arginine and alanine content were relatively higher, accounting for 31.40% and 17.39%, respectively. This study is of great significance for the efficient use of testes of puffer-fish (dark-spotted oriental carp), and also lays a theoretical foundation for the application of stag beetle (dark-spotted oriental carp) protamine in the food and pharmaceutical fields.
; Protamine; Extraction; Process optimization
CHEN Shunsheng, E-mail: sschen@shou.edu.cn
TS254.4
A
2095-9869(2020)05-0020-09
10.19663/j.issn2095-9869.20190810001
http://www.yykxjz.cn/
張家源, 張洪才, 陳舜勝. 暗紋東方鲀魚精蛋白的提取工藝優化研究. 漁業科學進展, 2020, 41(5): 168–176
Zhang JY, Zhang HC, Chen SS. Optimization of extraction process of protamine from. Progress in Fishery Sciences, 2020, 41(5): 168–176
* 國家自然科學基金面上項目(31471685)和上海市高校知識服務平臺項目(ZF1206)共同資助[The work was supported by National Natural Science Foundation of China (31471685), and Shanghai University Knowledge Service Platform Project (ZF1206)]. 張家源,E-mail: JYZhangshou@163.com
陳舜勝,教授,E-mail: sschen@shou.edu.cn
2019-08-10,
2019-08-30
(編輯 陳 輝)

