熒光PCR探針熔解曲線法檢測結核分枝桿菌耐藥性的價值
李愛芳 崔曉利 康磊 雷靜 黨麗云 楊翰
結核病是嚴重危害人類健康的全球十大致死原因之一,尤其是耐藥結核病的出現使結核病治療困難重重,結核病防治任重道遠[1]。因此,高效精準的藥物敏感性試驗(簡稱“藥敏試驗”)和耐藥監測對結核病的控制至關重要。BACTEC MGIT 960液體藥敏試驗(簡稱“MGIT 960藥敏試驗”)是目前檢測結核分枝桿菌對一線抗結核藥品耐藥性的常用方法之一。但由于MTB生長緩慢,此方法耗時較長,約需14 d才能報告結果,以致患者延誤診斷與治療而錯過最佳時機。
近年來,隨著檢測技術的不斷進步,各種各樣的分子診斷技術運用于結核病的診斷和耐藥性檢測中,為患者提供更加快速、準確的診斷和治療建議。熒光PCR探針熔解曲線法(簡稱“熔解曲線法”)是目前臨床應用較為廣泛的一種分子檢測技術,其通過監測特定耐藥基因在熔解分析中的熔點變化來判定相應基因是否發生突變。已有文獻研究了該方法檢測結核分枝桿菌耐藥性的價值,結果表明熔解曲線法對利福平和異煙肼的耐藥突變檢測具有較高的敏感度和特異度[2-4]。但仍然有10%左右的不一致結果會干擾臨床醫生對耐藥性的判斷,影響患者的治療方案選擇[3]。因此,本研究以MGIT 960藥敏試驗為參考標準,評價熔解曲線法對結核分枝桿菌臨床分離株耐藥性的檢測效能,對MGIT 960 藥敏試驗和熔解曲線法檢測利福平、異煙肼耐藥性結果不一致對象采用基因芯片法耐藥基因檢測對熔解曲線法結果進行驗證,進一步探討分子和表型耐藥檢測結果不一致現象的可能原因和處理方式。
材料和方法
一、標本來源
收集全部2017年9月至2019年8月西安市胸科醫院確診的546例結核病住院患者作為研究對象,獲得培養陽性菌株546株;經MPB64快速抗原檢測初篩,531株為結核分枝桿菌,15株為非結核分枝桿菌,最終納入531例(株)為本研究對象。收集患者痰標本,每份標本量均不少于2 ml。每例患者采用同一標本進行MGIT 960藥敏試驗和熔解曲線法耐藥基因檢測,對MGIT 960 藥敏試驗和熔解曲線法檢測利福平、異煙肼耐藥性結果不一致對象采用基因芯片法耐藥基因檢測對熔解曲線法進行驗證。
二、研究方法
1.主要儀器與試劑:BACTEC MGIT 960全自動分枝桿菌培養及藥敏檢測系統(購自美國BD公司),PCR擴增儀(購自美國BioRad公司), Lad-Aid 824s 核酸提取儀(購自廈門致善生物科技有限公司),SLAN系列實時熒光定量PCR檢測系統(購自廈門致善生物科技有限公司),芯片雜交儀和微陣列芯片掃描儀(購自北京博奧生物科技有限公司), MGIT 960 液體藥敏試劑盒(購自美國BD公司),分枝桿菌核酸檢測試劑盒(購自北京博奧生物科技有限公司),Lad-Aid 824結核分枝桿菌核酸提取Maxi試劑(購自廈門致善生物科技有限公司),結核分枝桿菌耐藥基因突變檢測試劑盒(鏈霉素、異煙肼、利福平、乙胺丁醇,購自廈門致善生物科技有限公司),晶芯?結核分枝桿菌耐藥基因檢測試劑盒(DNA微陣列芯片法,購自北京博奧生物科技有限公司)。
2.標本前處理:痰標本用N-乙酰-L-半胱氨酸(NALC)-NaOH消化液處理15 min,加入磷酸鹽緩沖液(PBS)至40 ml,4 ℃ 3000×g離心20 min,棄上清液,沉淀加入1.5 ml PBS振蕩重懸。
3.BACTEC MGIT 960液體培養:參照《結核病診斷實驗室檢驗規程》[5]取患者0.5 ml上述重懸液加入含分枝桿菌培養添加劑的液體培養管中,混勻后放入BACTEC MGIT 960液體培養系統,儀器報陽后取培養后菌液經萋-尼抗酸染色確認是否為抗酸桿菌,MTB64快速抗原檢測陽性確認為初篩結核分枝桿菌。
4.MGIT 960 藥敏試驗:根據《結核病診斷實驗室檢驗規程》[5]對培養陽性菌液采用MGIT 960藥敏試驗對鏈霉素、異煙肼、利福平、乙胺丁醇進行耐藥性檢測,各類藥品濃度分別為 1.0 μg/ml、0.1 μg/ml、1.0 μg/ml、5.0 μg/ml。
5.熔解曲線法耐藥基因檢測[3]:按結核分枝桿菌耐藥基因突變檢測試劑盒說明書進行試劑配制,取5 μl待檢核酸加入反應體系,瞬時離心,彈去氣泡后上機檢測。按照Lad-Aid 824結核分枝桿菌核酸提取試劑盒說明書進行核酸提取。
質量控制:使用0.5麥氏單位H37Rv菌懸液按照Lad-Aid 824結核分枝桿菌核酸提取試劑盒說明書提取核酸,與試劑盒自帶陽性對照、陰性對照一起與樣品同時進行檢測。菌液熔解曲線與陽性對照結果均敏感為質控合格,陰性對照用于檢測環境及操作過程中的污染。
6.結核分枝桿菌耐藥基因檢測(DNA微陣列芯片法):對MGIT 960 藥敏試驗和熔解曲線法檢測利福平、異煙肼耐藥性結果不一致者采用基因芯片法耐藥基因檢測對熔解曲線法進行驗證。按照博奧核酸提取試劑盒說明書要求進行標本前處理,提取痰標本中的DNA,按照晶芯?結核分枝桿菌耐藥基因檢測試劑盒(DNA微陣列芯片法)的說明書進行PCR擴增和芯片雜交,檢測利福平的rpoB和INH的katG及inhA基因啟動子的耐藥基因突變堿基位點。
三、統計學處理
應用SPSS 19.0軟件進行統計學分析,以MGIT 960藥敏試驗為參考標準,計算熔解曲線法檢測結核分枝桿菌耐藥性的敏感度、特異度和符合率,并進行一致性分析(Kappa檢驗),Kappa值在0.41~0.60為中等一致,0.61~0.80為基本一致,0.81~1.00為幾乎完全一致。
結 果
一、熔解曲線法的檢測效能
以MGIT 960藥敏試驗檢測結果為參考標準,熔解曲線法檢測鏈霉素耐藥性的敏感度、特異度和符合率分別為86.67%、99.38%和98.31%,一致性分析幾乎完全一致(Kappa=0.887);檢測異煙肼耐藥性的敏感度、特異度和符合率分別為69.23%、98.68%和94.35%,一致性分析基本一致(Kappa=0.751);檢測利福平耐藥性的敏感度、特異度和符合率分別為87.50%、96.89%和96.05%,一致性分析基本一致(Kappa=0.778);檢測乙胺丁醇耐藥性的敏感度、特異度和符合率分別為50.00%、98.83%和97.18%,一致性中等(Kappa=0.531),見表1。
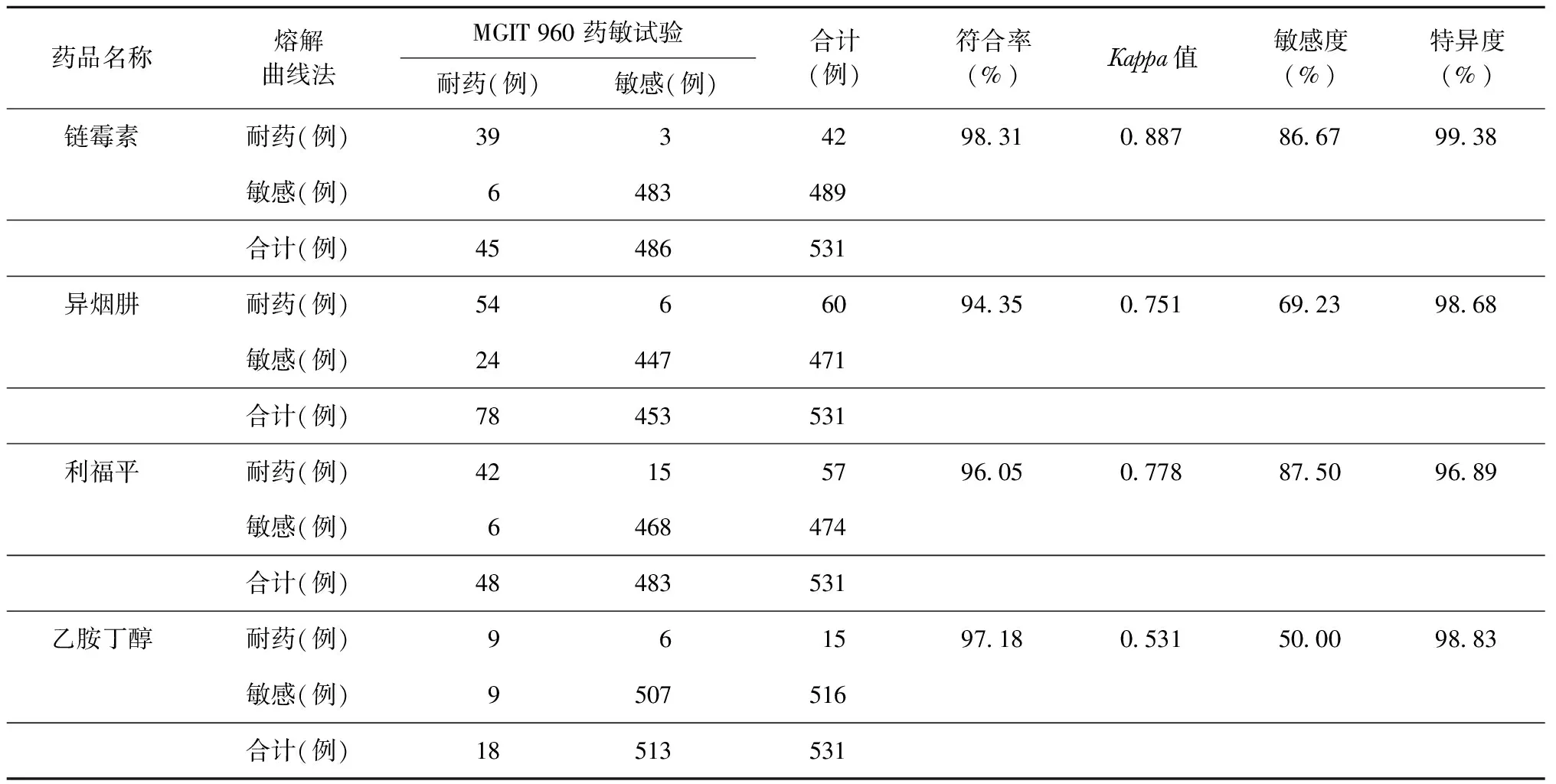
表1 以MGIT 960藥敏試驗為參考標準評價熔解曲線法檢測MTB對鏈霉素、異煙肼、利福平、乙胺丁醇耐藥性的效能
二、兩種方法檢測耐藥性不一致的結果分析
在531例肺結核患者痰標本中,30例MGIT 960藥敏試驗與熔解曲線法檢測MTB對異煙肼的耐藥性結果不一致。其中6例為MGIT 960藥敏試驗檢測結果為敏感而熔解曲線法檢測到突變,具體位點均為katG315位密碼子;有24例為MGIT 960藥敏試驗檢測結果為耐藥而熔解曲線法檢測結果為敏感。基因芯片法耐藥基因檢測6例突變樣本結果為katG315(AGC→ACC)突變和katG315(AGC→AAC)突變。
在531例肺結核患者痰標本中,21例MGIT 960藥敏試驗與熔解曲線法檢測MTB對利福平的耐藥性結果不一致。其中15例MGIT 960藥敏試驗檢測結果為敏感而熔解曲線法檢測到突變,具體為ropB507-512位密碼子突變3例、ropB521-528位密碼子突變3例、ropB529-533位密碼子突變9例;6例分離株MGIT 960藥敏試驗檢測結果為耐藥而熔解曲線法檢測結果為敏感。基因芯片法耐藥基因檢測15例突變樣本結果為ropB基因511位CTG→CCG突變、526位CAC→TAC突變和531位TCG→TGG突變。
在531例肺結核患者痰標本中,9例MGIT 960藥敏試驗與熔解曲線法檢測MTB對鏈霉素的耐藥性檢測結果不一致。其中3例為MGIT 960藥敏試驗檢測結果為敏感而熔解曲線法檢測到突變,具體突變位點均為rrs513-517位點;6例MGIT 960藥敏試驗檢測結果為耐藥而熔解曲線法檢測結果為敏感。
在531例肺結核患者痰標本中,15例MGIT 960藥敏試驗與熔解曲線法檢測MTB對乙胺丁醇的耐藥性結果不一致。其中6例為MGIT 960藥敏試驗檢測結果為敏感而熔解曲線法檢測到突變,具體突變位點均為embB306位密碼子;9例MGIT 960藥敏試驗檢測結果為耐藥而熔解曲線法檢測結果為敏感。
討 論
隨著檢測技術的不斷進步和對MTB耐藥機制的深入了解,耐藥結核病的檢測方法越來越多地應用于臨床,且大大提高了耐藥結核病的檢出率。目前,分子藥敏試驗主要有基因芯片法、線性探針法和熒光PCR熔解曲線法等用于結核分枝桿菌耐藥基因檢測,對耐藥性的輔助診斷具有快速、精準的意義[2-4,6-8]。
熒光PCR熔解曲線法結合了聚合酶鏈反應和熒光探針熔解曲線分析的優點,通過對目的基因進行擴增,觀察其熔解溫度與對照的差值(ΔTm),從而判斷是否有耐藥基因突變。該方法簡便、快速、高效,可以準確檢出耐藥基因的具體突變位點,適用于專科醫院進行大批量樣本檢測。
本研究顯示,與MGIT 960藥敏試驗相比,熔解曲線法檢測結核分枝桿菌對4種一線抗結核藥品耐藥性的敏感度和特異度較高,均在95%以上。敏感度低于特異度的原因可能為試劑盒并不能覆蓋所有耐藥突變位點,以及存在低水平異質性耐藥[9-10]。現有研究熔解曲線法在對利福平和異煙肼兩種常用抗結核藥品的耐藥基因突變檢測較多,而對鏈霉素、乙胺丁醇的檢測較少。本研究在對鏈霉素的耐藥基因突變結果顯示,熔解曲線法與MGIT 960藥敏試驗相比,具有極好的一致性,其符合率達到98.31%。這與曹志華等[11]的研究結果一致。吳慧娜等[3]對異煙肼耐藥基因突變的檢測結果顯示,以MGIT 960藥敏試驗為參考標準,熔解曲線法檢測的敏感度和特異度分別為85.4%和96.4%。劉艷等[2]對利福平耐藥基因突變的檢測結果顯示,以MGIT 960藥敏試驗為參考標準,熔解曲線法檢測的敏感度和特異度分別為95.83%和95.50%;其敏感度高于本研究,特異度與本研究結果相近。本研究納入531例患者痰標本進行耐藥性分析,而劉艷等[2]只有135例標本納入耐藥性檢測;敏感度方面的差異可能與樣本量及檢測水平等因素有關。對乙胺丁醇耐藥基因突變的檢測結果顯示,以MGIT 960藥敏試驗為參考標準,熔解曲線法檢測結果與MGIT 960藥敏試驗相比,其符合率高(97.18%)、特異度高(98.83%);但敏感度只有50.00%,可能原因為試劑盒檢測未能覆蓋所有耐藥突變位點。徐玉輝和張宗德[12]的研究發現,雖然embB306位點突變在對乙胺丁醇耐藥的菌株中占有很大比例,但是對乙胺丁醇耐藥可能存在如embA、embC和embR等其他基因的突變;而本研究試劑盒只能檢測embB基因的306、378、406、497位點是否突變。
中國湖南[13]及美國加利利福尼亞[14]多地都檢測到MTB對利福平耐藥的ropB突變而表型藥敏試驗檢測結果為敏感的現象,這些突變主要是有爭議的511Pro、516Tyr、526Asn、526Leu、533Pro等突變位點,雖然這種不一致率不高,但對醫生用藥和治療效果有較大影響。這兩項研究均發現,在耐藥基因ropB突變而表型藥敏試驗檢測敏感的菌株(患者)大多對異煙肼也存在耐藥現象,且一線抗結核藥品治療效果不好。這種表型藥敏試驗敏感而熔解曲線法檢測到耐藥基因突變位點的現象可能與低度耐藥相關。因此,MGIT 960藥敏試驗雖然是耐藥性檢測的參考標準,但仍然存在一定的假陰性率,選擇敏感度高的分子藥敏試驗檢測方法可以提高耐藥菌株的檢出率。對于表型DST(MGIT 960藥敏試驗)與分子DST(熔解曲線法)結果不一致的患者,臨床醫師應引起重視。參考《結核分枝桿菌耐藥性檢測專家共識》[15]的建議,當分子藥敏試驗和表型藥敏試驗結果不一致時,需參考對不同抗結核藥品分子藥敏試驗檢測的敏感度和特異度;若是對利福平、異煙肼和氟喹諾酮類藥品的檢測結果,只要其中1種方法檢測結果顯示耐藥,首先考慮可能是耐藥或異質性耐藥;若是其他抗結核藥品則還需結合臨床進行綜合判斷。
綜上所述,熔解曲線法能夠用于結核分枝桿菌耐藥基因突變的快速檢測,對結核病及耐藥結核病的診斷治療具有重要的參考意義。對于MGIT 960藥敏試驗與熔解曲線法檢測結果不一致的患者,任一方法提示對異煙肼和利福平耐藥,均要給予足夠重視,必要時應該及時調整用藥方案。

