雙席夫堿銅配合物修飾玻碳電極用于碳酸飲料中苯甲酸的測定
梁楚欣,劉 崢?,陳則勝,馮煒怡,李海瑩,張淑芬,2
(1.桂林理工大學 化學與生物工程學院 電磁化學功能物質廣西區重點實驗室,桂林 541004;2.大連理工大學 精細化工重點實驗室,大連 116024)
苯甲酸及其鈉鹽是一種常用的防腐劑,廣泛用作食品、飲料、牙膏、漱口水、化妝品等的添加劑[1]。苯甲酸作為食品添加劑時,其添加量應在規定的范圍內。美國食品和藥物管理局規定食品中苯甲酸的添加量為0.05%~0.1%[2];國家標準GB 2760-2014對苯甲酸的使用量有更嚴格的規定,如膠基糖果、調味糖漿、復合調味料、碳酸飲料中的苯甲酸最大使用量分別為1.5,1.0,0.6,0.2 g·kg-1。然而,一些不法貿易商為了延長食品的保質期,在食品中違規添加了過量的苯甲酸,人在食用后,可能存在食物中毒等危害人身體健康的風險[3]。因此,建立一種簡便、快捷和高靈敏的測定食品中苯甲酸含量的方法對相關執法部門監管食品中苯甲酸的添加量具有十分重要的意義。
目前,苯甲酸的測定方法主要有差示掃描量熱法(DSC)[4]、膠束電動色譜法(MEKC)[5]、氣相色譜法(GC)[6-7]、高效液相色譜法(HPLC)[8-9]等,但這些方法存在成本高、操作復雜和分析速率慢等缺點。薄層色譜法(TLC)[10]、紫外分光光度法[11]和熒光光譜法[12]也可用來測定苯甲酸的含量,具有操作簡單、分析速率快和結果準確等特點,但其靈敏度還需要提高。電分析法具有成本低、靈敏度高、檢測速度快等特點,已廣泛用于食品分析領域,但開發一種成本更低廉、操作更方便、靈敏度更高、測定時間更短的測定食品中食品添加劑含量的方法,仍是科研工作者不斷努力的方向。
雙席夫堿結構靈活多變,能與過渡金屬離子配位形成穩定的雙席夫堿金屬配合物,將其作為電子轉移媒介物修飾到電極表面,可提高電極的選擇性與靈敏度[13]。將雙席夫堿金屬配合物應用于分析化學領域,建立測定苯甲酸含量的方法,可拓寬雙席夫堿及其金屬配合物的應用領域范圍。本工作采用溶液法制備了雙席夫堿銅配合物(M),并采用電沉積法將其固定在玻碳電極(GCE)表面,形成了雙席夫堿銅配合物修飾GCE(M/GCE),據此建立了M/GCE測定碳酸飲料中的苯甲酸含量的電化學方法,以期為食品中苯甲酸含量的測定提供技術參考。
1 試驗部分
1.1 儀器與試劑
CHI 760E型電化學工作站;AL 204型電子分析天平;WS 701型紅外快速干燥燈;BPZ-6000型真空干燥箱;DHG-9023A 型鼓風干燥箱;KQ-100DE型數控超聲波清洗器;Perkin-Elmer 240Q 型元素分析儀;SU 5000 型場發射掃描電子顯微鏡(SEM);Shimadzu FTIR-8400 型紅外光譜儀(FTIR);GCE(直徑為2 mm),鉑絲電極(直徑為2 mm)。
KCl溶液:0.1 mol·L-1,稱取KCl 固體1.862 5 g,用水溶解并定容至250.0 mL。
苯甲酸標準溶液:2.000 0 mmol·L-1,稱取苯甲酸0.024 4 g,用0.1 mol·L-1KCl溶液溶解并定容至100.0 mL。
所用試劑均為分析純;試驗用水為蒸餾水。
1.2 儀器工作條件
三電極體系:以M/GCE 或GCE 為工作電極,飽和甘汞電極為參比電極,鉑絲電極為輔助電極;電化學方法為循環伏安法(CV);掃描范圍為-1.0~1.0 V,掃描速率為50 mV·s-1;以0.1 mol·L-1KCl溶液為支持電解質。
1.3 試驗方法
1.3.1 M 的制備
鄰羧基苯甲醛縮乙二胺席夫堿:根據文獻[14],以鄰羧酸苯甲醛和乙二胺為原料制備,得到白色粉末,熔點為131.0~134.0 ℃。
稱取0.324 5 g(1 mmol)鄰羧基苯甲醛縮乙二胺席夫堿和20 mL 甲醇于100 mL 的三口燒瓶中,于室溫下磁力攪拌成白色渾濁溶液,然后向溶液中緩慢滴加含有0.199 5 g(1 mmol)一水合乙酸銅的甲醇溶液25 mL,溶液由渾濁狀態逐漸變成藍色澄清狀態。在100 ℃下攪拌回流3 h后,停止攪拌,靜置,冷卻至室溫,有藍色片狀晶體析出。用中速濾膜減壓抽濾,并用甲醇洗去沉淀中的雜質,置于30 ℃真空干燥箱中干燥24 h,得到 M 的質量為0.201 9 g,產率為42.47%。
1.3.2 M/GCE的制備
在麂皮上依次用0.1μm 和0.03μm 的氧化鋁粉末將GCE拋光20 min,打磨至鏡面,然后在水中超聲30 min,除去電極表面的雜質,用水沖洗后,置于50℃的烘箱中干燥5 min。將3 mmol M 在瑪瑙研缽中碾碎,用400 mLN,N-二甲基甲酰胺(DMF)溶解,配制成0.007 5 mol·L-1M-DMF 溶液。將預處理好的GCE浸泡在M-DMF溶液中,采用三電極體系(參比電極為Ag/AgCl電極),以四丁基高氯酸銨(TBAP)為支持電解質,控制電位為-1.5~1.5 V,電沉積速率為50 mV·s-1,電沉積圈數為20,將M 通過CV 沉積到GCE 表面,得到M/GCE,用適量水沖去M/GCE 表面吸附的雜質,在紅外快速干燥燈下干燥。
1.3.3 樣品的分析方法
超聲除去雪碧中CO2后,量取10.0 mL雪碧樣品,用0.1 mol·L-1KCl溶液定容至100.0 mL,分取15.0 mL于25 mL燒杯中,按照儀器工作條件測定其中苯甲酸含量。
2 結果與討論
2.1 M 的 表征
通過元素分析的結果可知,M 的分子式為C41H52Cu2N4O15,M 中碳、氮、氫元素的質量分數的實測值(理論值)為:C 50.73%(50.87%);N 5.64%(5.79%);H 5.51%(5.42%)。
采用KBr壓片,對合成的M 進行了FT-IR 表征,見圖1。
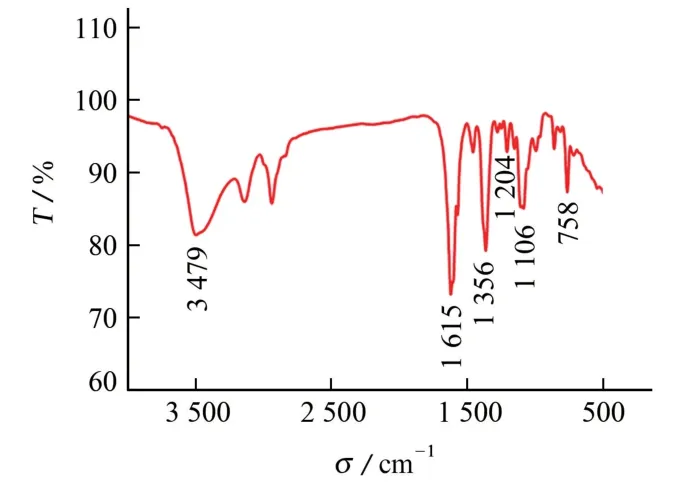
圖1 M 的紅外光譜圖Fig.1 IR spectrum of M
由圖1可知:在3 479 cm-1處出現了較寬的吸收峰,此峰的出現主要歸因于配合物中含有配位水和結晶水中的O-H 伸縮振動;1 615 cm-1是NH 的彎曲振動吸收峰,表明N-H 中氮原子與金屬銅離子發生了配位;1 204 cm-1是羧基C-O 的伸縮振動吸收峰;1 106 cm-1是伯烷基醚sp3雜化的C-O 鍵的伸縮振動吸收峰。
2.2 電沉積過程的電化學行為
M 在GCE上的電沉積過程的CV 曲線見圖2。

圖2 M/GCE修飾電極的CV 曲線Fig.2 CV curves of M/GCE
由圖2 可知:0.079 V 處出現了氧化峰,-0.014 V 處出現了還原峰,兩峰電位差約0.059 V,可歸屬為Cu(Ⅱ)/Cu(Ⅰ)電對的電極反應[15],且該反應的可逆性較高[16]。隨著掃描圈數的增大,氧化峰和還原峰越來越明顯,推測可能是M 通過其中的芳香環與銅離子之間的d-π作用,已逐漸沉積到了GCE上。
2.3 M/GCE的表面形貌
為了考察M/GCE表面的修飾效果,采用SEM對GCE和M/GCE 的表面形貌進行了表征。在加速電壓為5.0 k V,放大倍數為800倍時,GCE和M/GCE表面的SEM 形貌見圖3。

圖3 GCE和M/GCE表面的SEM 圖Fig.3 SEM images of the surface of GCE and M/GCE
由圖3可知:GCE顯示為較為光滑的表面,M/GCE顯示為凹凸不平的表面,說明GCE 表面已形成一層聚合膜[17]。
2.4 苯甲酸在電極上的電化學行為
以2.000 0 mmol·L-1苯甲酸標準溶液為待測對象,按照儀器工作條件考察了GCE和M/GCE對苯甲酸的電化學響應效果,結果見圖4。
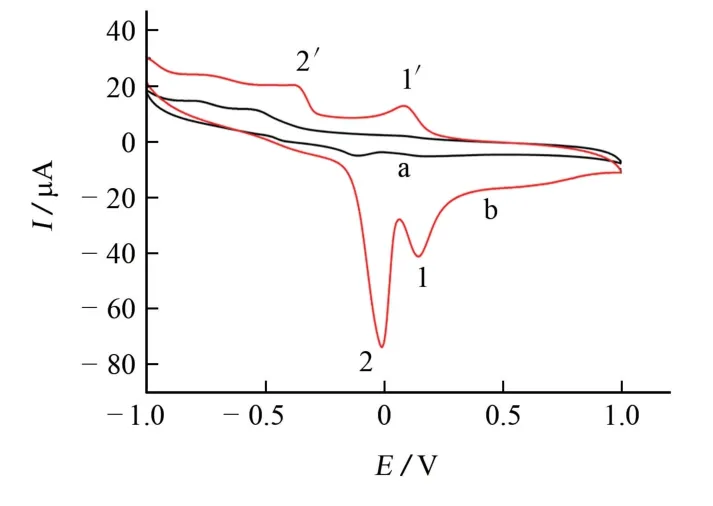
圖4 GCE和M/GCE上苯甲酸的電化學行為Fig.4 Electrochemical behavior of benzoic acid on the GCE and M/GCE
由圖4可知:當以GCE 為工作電極時,在CV曲線上幾乎觀察不到電化學響應信號;當以M/GCE作為工作電極時,在CV 曲線上觀察到分別位于0.148,-0.007 V 處的氧化峰1 和氧化峰2,0.096,-0.359 V 處的還原峰1′和還原峰2′。氧化峰1和還原峰1′可能與Cu(Ⅱ)/Cu(Ⅰ)電對的電極反應有關,而氧化峰2和還原峰2′來源于苯甲酸的電極反應[18]:
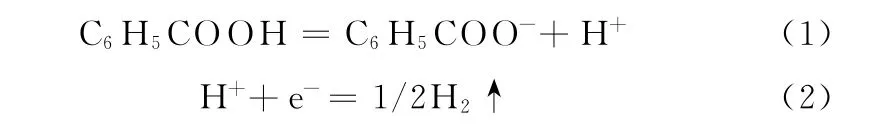
以上結果表明:M/GCE 對苯甲酸的電化學響應和其表面修飾的M 有關。
2.5 掃描速率對M/GCE 上苯甲酸電化學行為的影響
試驗考察了掃描速率為25~200 mV·s-1時對苯甲酸電化學行為的影響,結果見圖5。
由圖5可知:氧化峰2和還原峰2′電流隨掃描速率的增加而增大,氧化峰2電流從18.6μA 增加至40.2 μA,還原峰2′電流從8.23 μA 增加至19.7μA。氧化峰2的電位略向正向移動,還原峰2′的電位略向負向移動,電極反應可逆性變差。
以掃描速率的平方根(ν1/2)為橫坐標,相應的苯甲酸的氧化峰電流(Ipa2)和還原峰電流(Ipc2′)為縱坐標繪圖,見圖6。
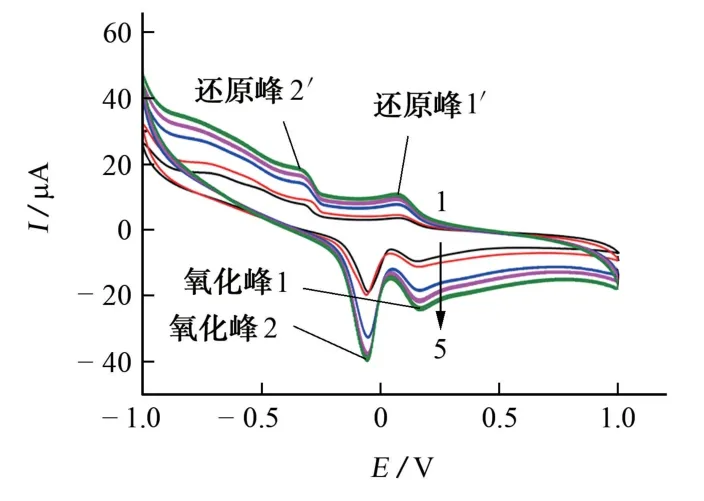
圖5 掃描速率對苯甲酸電化學行為的影響Fig.5 Effect of scan rate on electrochemical behavior of benzoic acid
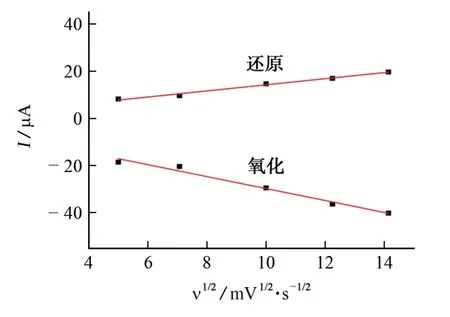
圖6 氧化還原峰電流與掃描速率的平方根的關系圖Fig.6 Relationship between redox peak current and square root of scan rate
由圖6可以看出:Ipa2~ν1/2的線性方程為Ipa2=-2.535×ν1/2-4.446,相關系數為0.987 1;而Ipc2′~ν1/2的線性回歸方程為Ipa2′=1.296×ν1/2+1.295,相關系數為0.992 3。以上結果表明,在25~200 mV·s-1內,苯甲酸在M/GCE 表面的反應受擴散控制[19]。
2.6 支持電解質對苯甲酸電化學行為的影響
試驗考察了分別以H2SO4溶液(pH 2.0)、NaOH 溶液(pH 12.0)、KCl溶液、KBr溶液、磷酸鹽緩沖溶液(pH 7.0)為支持電解質時對苯甲酸電化學行為的影響,結果見圖7。
由圖7可知:以KCl溶液為支持電解質時,有2對氧化還原峰出現,由上面分析可知,可歸屬于Cu(Ⅱ)/Cu(Ⅰ)和苯甲酸的可逆電極反應,電化學響應較好。以KBr 溶液為支持電解質時,只在-0.008,0.140 V 處出現了2個氧化峰,而沒有對應還原峰,說明在KBr溶液中,M/GCE上發生的2個電極反應不可逆;以磷酸鹽緩沖溶液為支持電解質時,在-0.346,-0.352 V 處出現了一對明顯的氧化還原峰,可歸屬于苯甲酸的可逆電極反應,而在-0.011 V 處出現一個氧化峰,沒有對應的還原峰,可歸屬于Cu(Ⅱ)/Cu(Ⅰ)的不可逆電極反應;以H2SO4溶液(pH 2.0)為支持電解質時,只在0.125 V 處出現一個氧化峰,可歸屬于Cu(Ⅱ)/Cu(Ⅰ)的不可逆電極反應;以NaOH 溶液(pH 12.0)為支持電解質,基本無電化學響應信號。因此,試驗選擇KCl溶液作為支持電解質來考察苯甲酸在修飾電極上的電化學行為。
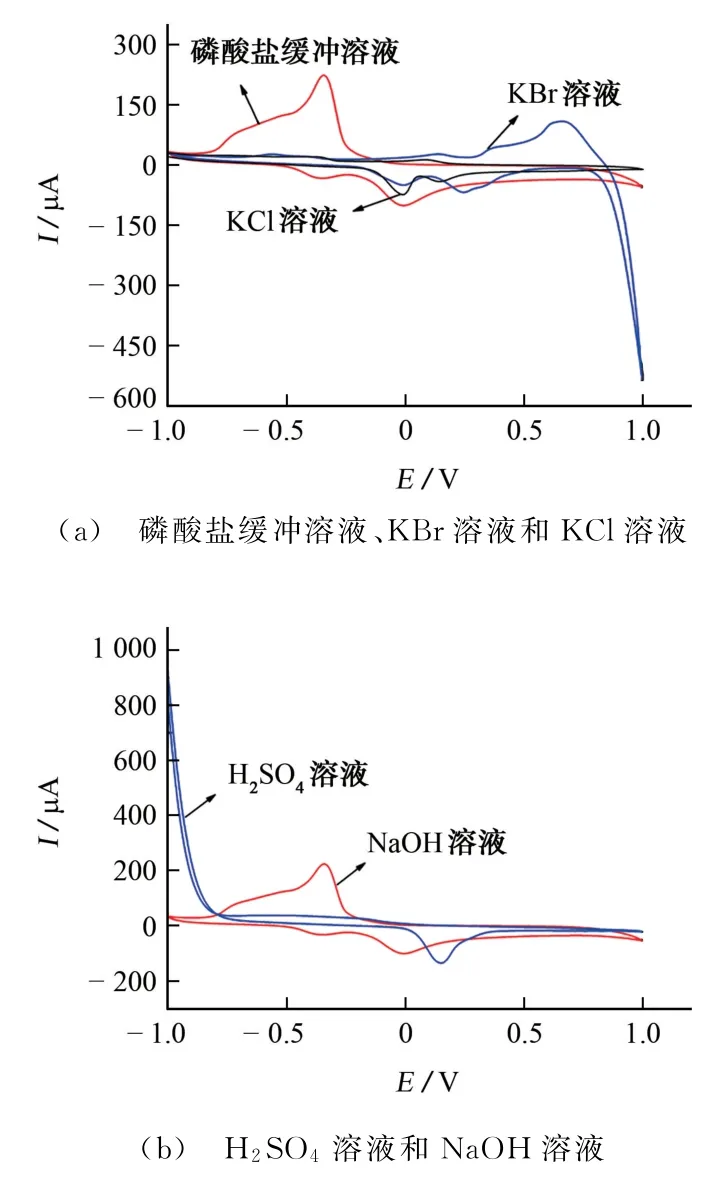
圖7 支持電解質對苯甲酸電化學行為的影響Fig.7 Effect of the support electrolyte on the electrochemical behavior of benzoic acid
2.7 標準曲線和檢出限
按照儀器工作條件對0.001 0,0.010 0,0.100 0,0.250 0,0.500 0,1.000 0,2.000 0 mmol·L-1的 苯甲酸標準溶液系列進行測定,以苯甲酸濃度為橫坐標,氧化峰2電流為縱坐標繪制標準曲線。結果表明:苯甲酸的濃度在0.001 0~2.000 0 mmol·L-1內,M/GCE 對苯甲酸的響應電流與苯甲酸濃度呈線性關系,線性回歸方程為y=-0.032 2x-0.009 8,相關系數為0.995 7。
以3倍信噪比(S/N)計算檢出限(3S/N),所得結果為0.27μmol·L-1。
2.8 M/GCE的穩定性和重現性
將M/GCE在4℃保存7 d,再按照儀器工作條件在支持電解質中進行掃描,其響應電流只比初始值下降了4.8%,表明制備的M/GCE具有良好的穩定性。
按照試驗方法制備5個M/GCE 修飾電極,每個電極在2.000 0 mmol·L-1苯甲酸標準溶液中平行測定5次,計算氧化峰響應電流的相對標準偏差(RSD)為3.2%,說明M/GCE具有良好的重現性。
2.9 干擾試驗
在苯甲酸標準溶液濃度為2.000 0 mmol·L-1時,試驗考察了L-半胱氨酸、檸檬酸、檸檬酸鈉、白砂糖等干擾物質對苯甲酸電化學行為的影響。結果發現:當存在15倍的L-半胱氨酸,50倍的檸檬酸、檸檬酸鈉,100倍的白砂糖時,苯甲酸測定值的相對誤差分別為4.6%,4.5%,3.3%,2.9%,說明以上幾種干擾物質均不影響苯甲酸的測定。
2.10 精密度和回收試驗
按試驗方法對雪碧樣品中苯甲酸的含量進行5次平行測定,并以其為基質進行了加標回收試驗,計算回收率和測定值的RSD,結果見表1。

表1 精密度和回收試驗結果(n=5)Tab.1 Results of tests for precision and recovery(n=5)
本工作建立了一種用M/GCE測定碳酸飲料中苯甲酸含量的電化學方法,該方法具有靈敏度高、準確性好、穩定性高和重現性較好等優點,可用于碳酸飲料中苯甲酸含量的測定。

