基于因子分析的疫苗臨床試驗質量管理研究
梁慶香 冉曉敏 崔雪蓮 曹芳芳 譚曉萍

【摘要】 目的 為提高疫苗臨床試驗質量管理的效率,初步構建疫苗臨床試驗現場質量管理模型。
方法 采用文獻法收集疫苗臨床試驗質量管理影響因子,編制成包括個人基本信息及影響質量管理的因子共105個條目的問卷,對柳州市和下轄6個縣疾病預防控制中心的203名疫苗臨床試驗研究者進行問卷調查,應用主成分和因子分析法對數據進行分析。
結果 建立了包含試驗方案遵循、受試者管理、疫苗管理、硬件設施、機構資質5個維度28個條目疫苗臨床試驗質量管理模型。
結論 構建的疫苗臨床試驗現場質量管理模型,為疫苗臨床試驗現場質量管理工作的推廣以及提高其管理效率提供理論依據。
【關鍵詞】 疫苗臨床試驗;質量管理;因子分析
【Abstract】 Objective To preliminarily construct vaccine clinical trials on-site quality management model,so as to improve the efficiency of vaccine clinical trial quality management.
Methods The influencing factors of vaccine clinical trial quality management were collected by literature method,and a questionnaire with 105 items including basic personal information and factors influencing quality management was prepared.The questionnaire survey was conducted among 203 vaccine clinical trial researchers from Centers for Disease Control and Prevention in Liuzhou city and 6 counties subject to its jurisdiction.The collected data was analyzed by principal component analysis and factor analysis.
Results A vaccine clinical trial quality management model with 28 items was established,which included five dimensions: protocol compliance,subject management,vaccine management,hardware facilities,and institutional qualification.
Conclusion This vaccine clinical trials on-site quality management model provides a theoretical basis for the promotion of quality management of vaccine clinical trial and the improvement of its management efficiency.
【Key words】 vaccine clinical trials;quality management;factor analysis
疫苗被認為是全球最大的衛生成就之一,疫苗的應用,每年可避免200萬至300萬人死亡[1]。隨著我國疫苗自主研發水平的提高,越來越多的創新疫苗進入臨床試驗階段,其風險控制和質量管理難度也越來越大[2]。研究者在疫苗臨床試驗質量管理方面主要集中討論疫苗臨床試驗現場核查的重點[3]、自查情況的報告[4]、經驗與體會[5]、開展疫苗臨床試驗存在的問題和面臨的挑戰以及提出相應的建議[6~7]。王白璐通過數理統計構建藥物臨床試驗質量管理模型[8],由于疫苗有別于一般藥物的特殊性,來源于活生物體、用于健康人群且以兒童為主[9],因此藥物臨床試驗的質量管理模型并不一定完全適用于疫苗。本研究通過因子分析初步構建疫苗臨床試驗現場質量管理模型,旨在專門針對疫苗臨床試驗找出與其質量相關性高的要素,在確保試驗過程規范,數據和結果科學、真實、可靠,保護受試者的權益和安全的基礎上,提高管理的效率和效益,報道如下。
1 對象與方法
1.1 研究對象
對柳州市和下轄6個縣疾病預防控制中心的疫苗臨床試驗研究者進行問卷調查,參與調查的研究者均為從事疫苗臨床試驗兩年及兩年以上的工作人員,共有211名,發放問卷211份,收回有效問卷203份,有效回收率為96.21%。
1.2 研究方法
在大量文獻研究的基礎上,對藥物臨床試驗質量管理的影響要素進行歸納整理,編制疫苗臨床試驗質量管理問卷,包括個人基本信息及影響質量管理的因子共105個條目,涉及人員、場所、設備、制度、文件、數據管理、質控體系、倫理等內容,各條目采取likert等級進行重要性評分,1~5按順序分別代表“一點也沒有關系”“關系較低”“一般”“重要”“非常重要”。
1.3 統計學方法
調查數據采用EpiData 3.0軟件建立數據庫并進行雙錄入,運用SPSS 17.0軟件進行因子分析。主要分析指標有KMO統計值、Bartlett球形檢驗值等,檢驗水準:α=0.05,雙側檢驗。
2 結 ?果
2.1 調查對象的一般情況
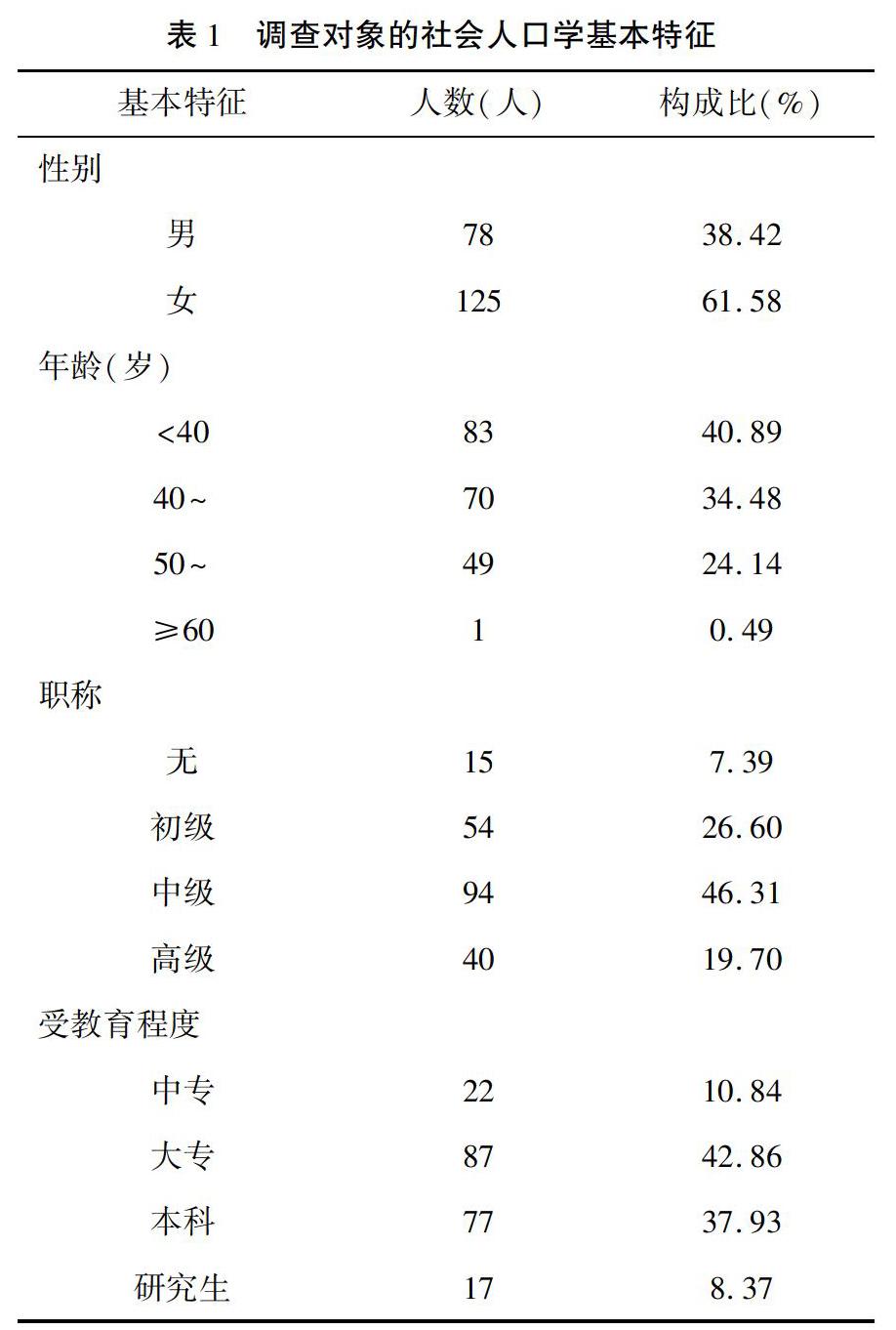
調查對象共203名,男性78人(38.42%),女性125人(61.58%),平均年齡為(41.81±8.98)歲,職稱主要集中在中級,受教育程度主要為大專和本科。見表1。
2.2 因子分析結果
通過對數據進行因子可行性分析,結果顯示:KMO統計值為0.882,Bartlett球形檢驗=23 936.095,P<0.001,顯示適合做因子分析。采用主成分分析法進行因子提取,按照特征值大于1的標準,共提取了19個因子,累計方差貢獻率為76.263%。為了便于對因子的解釋運用最大方差法(Warimax)進行旋轉,結合實際和各因子與公共因子之間的顯著程度,以因子負荷水平不小于0.7作為取舍條目的標準,經過多次迭代旋轉共提取28個條目組成的試驗方案遵循、受試者管理、疫苗管理、硬件設施、機構資質5個公因子。其中有3項旋轉因子數值超過0.8,均集中在硬件設施公因子;最低三項的旋轉公因子分別為“受試者的隱私得到尊重和保護(0.708)”“到期文件處理有流程圖(0.706)”“疫苗包裝上標簽內容(批號、生產日期、有效期、疫苗編號等)與試驗方案、藥檢報告中一致,并標明為臨床試驗專用(0.703)”,分別在受試者管理、試驗方案遵循、疫苗管理三個公因子下。見表2。
3 討 ?論
通過問卷調查,利用因子分析方法初步構建疫苗臨床試驗質量管理的模型,包括試驗方案遵循、受試者管理、疫苗管理、硬件設施和機構資質5個維度28個因子。質量管理模型的因子1是試驗方案遵循,包含了15個因子,與疫苗臨床試驗質量管理相關度高,提示在現場實施中,要嚴格遵循試驗方案,結果與GCP和《疫苗臨床試驗質量管理指導原則(試行)》的要求相符。試驗方案通常包括基本信息、研究背景資料、試驗目的、試驗設計、質量控制和質量保證、倫理學問題的考慮、試驗數據的采集與管理、實施方式(方法、內容、步驟)等內容,是臨床試驗組織實施的文件。方案中的試驗設計決定了臨床試驗的科學性和試驗數據的可靠性[10]。質量管理指導原則二十五條規定,在試驗進行期間,發生方案修訂應經過倫理委員會批準,體現了實驗方案的重要性,各試驗現場負責研究者要保證嚴格執行試驗方案。因子2體現了對受試者權益的保護,與GCP和《世界醫學大會赫爾辛基宣言》原則及相關倫理要求相符,受試者的權益和安全是考慮的首要因素,優先于對科學和社會的獲益[10]。受試者是試驗的研究對象,受試者依從性與充分的知情同意密切相關[5],疫苗管理法規定,開展疫苗臨床試驗,應當取得受試者的書面知情同意[11],本研究建立的模型中針對受試者做出知情同意決定和簽署知情同意書的旋轉因子的負荷量絕對值很高,與韋鵬翀等[5]的研究以及法規的要求相一致。因子3(疫苗管理)和因子4(硬件設施)提示在臨床試驗過程中要關注疫苗的合法性和合規性,與《疫苗臨床試驗質量管理指導原則(試行)》相符,疫苗管理全過程要符合冷鏈要求,要有符合方案要求的疫苗運輸和保存條件[12]。因子5(機構資質)體現了流行病學專業背景的重要性,具有足夠數量且符合試驗方案要求的受試者是確定現場單位的基礎。研究者負責執行臨床試驗相關職責和功能,產生可靠的數據[10],因此,研究者的能力也是臨床試驗質量的關鍵因素,倫理委員會嚴格審查研究者的資格、經驗是否符合要求;是否有充分時間參加臨床試驗;人員配備及設備條件是否符合要求。只有在符合這些要求,保證受試者安全和權益的前提下才能許可該臨床試驗,并使臨床試驗不至于因為設計不當和技術條件不夠而失敗[9]。遵循試驗方案的主體是研究者,原始資料的管理、合并用藥和不良事件的完整真實的記錄、總結報告的撰寫問題均需要研究者實施,且遵循試驗方案能降低試驗選擇性和觀察性偏倚的發生,提高試驗的質量[13]。
該研究利用主成分和因子分析構建疫苗臨床試驗評價模型,從原來眾多且相關的指標篩選出少數相互獨立的綜合指標,為疫苗臨床試驗現場質量管理工作的推廣以及提高其管理效率提供理論依據。但本研究只是探討性的因子分析,因時間、人力、物力的限制缺乏實證研究,今后還需不斷地完善疫苗臨床試驗質量管理模型,進一步提高其試驗的質量,確保試驗過程規范,結果科學可靠,更好地保障受試者的安全和權益。
參 考 文 獻
[1] ?WHO.Vaccines:A global health success story that keeps us on our toes[EB/OL].[2016-04-25].https://www.who.int/mediacentre/commentaries/vaccines/en.
[2] ?張蓉,李見明.對一次性疫苗臨床試驗機構資格認定管理規定的解讀[J].中國臨床藥理學雜志,2014,30(9):833-835.
[3] ?李見明,王佳楠,解琴,等.疫苗臨床試驗現場核查的思考[J].中國新藥雜志,2009,18(20):1935-1936.
[4] ?成曉英.我省各級疫苗接種單位疫苗質量管理調查情況結果分析[J].中國合理用藥探索,2017,14(12):69-71.
[5] ?韋鵬翀,黃林雄,黃海波.《藥物臨床試驗質量管理規范》在疫苗臨床試驗中的應用[J].應用預防醫學,2010,16(5):311-313.
[6] ?黎明強,呂榜軍,覃彥香.淺談新法規實施對疫苗臨床試驗的影響及挑戰[J].中國新藥雜志,2016,25(4):376-379.
[7] ?王文娟,孟繁岳,甘正凱,等.淺談疫苗臨床試驗質量控制[J].中國新藥雜志,2014,23(20):2411-2413.
[8] ?王白璐.藥物臨床試驗質量管理評價研究[D].濟南:山東大學,2012.
[9] ?國家食品藥品監督管理局.疫苗臨床試驗技術指導原則[EB/OL].[2004-12-03].https://www.nmpa.gov.cn/xxgk/fgwj/gzwj/gzwjyp/20041203010101968.html.
[10] ?國家藥品監督管理局,國家衛生健康委員會.《藥物臨床試驗質量管理規范》[EB/OL].(2020-04-26)[2020-04-23].http://www.nmpa.gov.cn/WS04/CL2138/376852.html
[11] ?全國人民代表大會常務委員會.中華人民共和國疫苗管理法[EB/OL].(2019-06-30)[2020-06-29]http://www.gov.cn/xinwen/2019-06/30/content_5404540.htm.
[12] ?國家食品藥品監督管理局.疫苗臨床試驗質量管理指導原則(試行)[EB/OL].[2013-10-31].http://www.gov.cn/gongbao/content/2014/content_2580994.html.
[13] ?孔雨佳.疫苗臨床試驗中統計設計與安全性分析策略[D].西安:第四軍醫大學,2015.
(收稿日期:2020-05-21 修回日期:2020-07-12)
(編輯:梁明佩)

