FOXQ1介導SHH信號通路誘導胃癌細胞凋亡
夏培 熊宇 張萬里 田愛霞 丁祥武 胡艷艷
胃癌是常見的惡性腫瘤之一,其病死率在所有惡性腫瘤中占據第二,僅次于肺癌[1]。基因的異常表達是胃癌發生發展的本質原因,包括原癌基因的激活、抑癌基因的失活等[2]。因此,從分子水平闡明胃癌的發生發展過程,探尋可靠的早期診斷標志物和新的治療策略具有重要意義。人類轉錄因子叉頭框Q1(forkhead box Q1,FOXQ1)基因屬于Fox轉錄因子家族,是一種轉錄調控因子,其編碼的蛋白質由403個氨基酸組成。FOXQ1的生物學功能已在毛囊分化中得到明確鑒定[3]。近年來研究發現FOXQ1在肺癌、結直腸癌、膠質瘤中異常表達,且與腫瘤生長、轉移及預后顯著相關[4-6]。近期研究表明,FOXQ1在胃癌組織的表達顯著高于癌旁組織,且與胃癌病理分級、臨床分期及淋巴結轉移密切相關[7],然而,FOXQ1的高表達是否有助于胃癌的發展和進展尚不清楚。SHH信號通路參與細胞分化、增殖、凋亡以及器官形成等過程[8,9]。近期發現FOXQ1基因可介導大腸癌SW480細胞血管生成與SHH信號通路有關[10]。本實驗首先檢測了胃癌細胞系中FOXQ1基因表達水平,并通過沉默胃癌SGC-7901細胞FOXQ1基因,觀察該基因對SGC-7901細胞凋亡和SHH信號通路相關蛋白的影響,探討其是否介導SHH信號通路影響胃癌細胞的凋亡。
1 材料與方法
1.1 細胞株、主要試劑 人永生化胃黏膜上皮細胞GES-1及人胃癌細胞SGC-7901、MKN-28、GC-9811和AGS購自上海中科院細胞庫,RPMI-1640培養基、胎牛血清購自美國Hyclone公司,Trizol試劑、Lipofectamine 2000轉染試劑、SYBR Green PCR Master Mix試劑盒購自美國Invitrogen公司,BCA蛋白濃度檢測試劑盒、AnnexinⅤ-FITC凋亡檢測試劑盒購自碧云天生物技術研究所,非特異性FOXQ1 siRNA和非特異性FOXQ1 siRNA購自上海吉瑪制藥技術有限公司,Bax、Cleaved Caspase3、SHH、Smo、Gli1和Gli3抗體及辣根過氧化酶標記的二抗購自美國Abcam公司,SHH信號通路的特異性激活劑2,6,9-三取代嘌呤化合物(Purmorphamine,PM)購自美國Cayman公司。
1.2 細胞培養 人永生化胃黏膜上皮細胞GES-1及人胃癌細胞SGC-7901、MKN-28、GC-9811和AGS均培養于含有100 U/ml青霉素、100 U/ml鏈霉素及100 g/L胎牛血清的RPMI-1640培養基,培養條件是37℃,5% CO2、飽和濕度培養箱。待細胞密度達80%以上時,使用2.5 g/L的胰蛋白酶消化細胞,傳代培養,每3~4天傳代1次。
1.3 細胞轉染與分組 取對數生長期的胃癌SGC-7901細胞接種于6孔板中,每孔2×105個細胞。細胞融合至60%時,按照Lipofectamine 2000轉染試劑說明書分別轉染特異性FOXQ1 siRNA、非特異性FOXQ1 siRNA至SGC-7901細胞,命名為si-FOXQ1組和si-Control組,并設置正常對照組(Normal組)。通過綠色熒光的表達程度摸索出細胞最佳轉染濃度及轉染時間。轉染時間為48 h時轉染效率最高。收集轉染48 h 的各組細胞用于后續實驗。
1.4 qRT-PCR檢測細胞FOXQ1 mRNA的表達 按照Trizol試劑說明書提取細胞中RNA,超微量蛋白核酸檢測儀測定RNA濃度和純度,根據逆轉錄試劑盒說明書將總RNA反轉錄合成cDNA,使用SYBR Green PCR Master Mix試劑盒進行實時熒光定量PCR擴增,FOXQ1上游引物:5’-CGGAAGAGGACTCCGGAAAAG-3’,下游引物:5’-GTCGTACCCTCTTCCTTCGC-3’。PCR反應條件為:94℃預變性3 min,94℃變性30 s,58℃退火30 s,72℃延伸15 s,共40個循環。采用β-actin為內參,以2-ΔΔCt法計算細胞中FOXQ1相對表達量。
1.5 Western blot檢測細胞中蛋白表達 取各組細胞,加入細胞裂解液,置冰上孵育30 min,收集細胞中蛋白,BCA蛋白檢測試劑盒對總蛋白進行定量,取50 μg蛋白樣品行12%十二烷基硫酸鈉-聚丙烯酰胺凝膠分離蛋白,轉膜至硝酸纖維素膜上,封閉1 h,加入一抗孵育,Bax一抗1∶500稀釋、Cleaved Caspase3一抗1∶500稀釋、SHH一抗1∶800稀釋、Smo一抗1∶800稀釋、Gli1一抗1∶800稀釋和Gli3一抗1∶800稀釋,4℃過夜孵育,TBST洗膜(3×10 min),加入二抗孵育(辣根過氧化酶標記的二抗1∶3 000稀釋)2 h,TBST洗膜(3×10 min),化學發光顯色,顯影、定影,在成像系統中拍照,以GAPDH為內參,統計細胞中Bax、Cleaved Caspase3、SHH、Smo、Gli1和Gli3蛋白相對表達水平。
1.6 流式細胞儀檢測細胞凋亡 取轉染48 h后的細胞,預冷的PBS洗滌,加入1×Annexin結合液重懸細胞,調整細胞濃度為1×106個/ml。取100 μl細胞懸液,加5 μl Annexin和5 μl PI,室溫避光反應15 min,加入400 μl 1×Annexin結合液,上流式細胞儀檢測。
1.7 激活SHH信號通路對SGC-7901細胞凋亡的影響 用1 μmol/L的SHH特異性激活劑PM誘導si-FOXQ1組細胞24 h,記為si-FOXQ1+PM組,以si-FOXQ1組細胞為對照。Western blot檢測細胞中Bax、Cleaved Caspase3、SHH、Smo、Gli1和Gli3蛋白相對表達水平,流式細胞儀檢測細胞凋亡率。
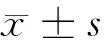
2 結果
2.1 FOXQ1 mRNA在胃癌細胞中表達 qRT-PCR檢測永生化胃黏膜上皮細胞GES-1和不同胃癌細胞系中FOXQ1基因的表達,結果顯示,GES-1、SGC-7901、MKN-28、GC-9811和AGS細胞中FOXQ1 mRNA相對表達水平分別為(1.00±0.11)、(3.16±0.33)、(2.27±0.26)、(1.92±0.21)、(2.44±0.25)。與GES-1細胞比,胃癌細胞SGC-7901、MKN-28、GC-9811和AGS中FOXQ1 mRNA表達水平顯著升高(P<0.05),并且胃癌SGC-7901細胞中的表達量最高,因此選擇SGC-7901細胞作為后續實驗研究對象。
2.2 轉染FOXQ1 siRNA對SGC-7901細胞中FOXQ1基因表達的影響 轉染si-FOXQ1、si-Control至SGC-7901細胞,qRT-PCR和Western blot檢測結果顯示,si-FOXQ1組SGC-7901細胞中FOXQ1 mRNA和蛋白表達顯著低于si-Control組(P<0.05)。si-Control組和Normal組間FOXQ1 mRNA和蛋白表達差異無統計學意義(P>0.05)。見圖1,表1。
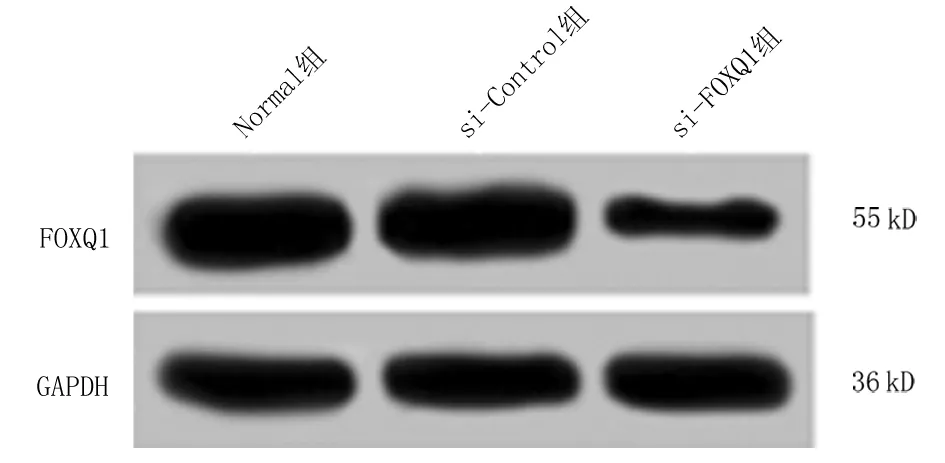
圖1 SGC-7901細胞中FOXQ1蛋白表達條帶
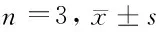
表1 SGC-7901細胞中FOXQ1mRNA和蛋白表達水平
2.3 轉染FOXQ1 siRNA誘導SGC-7901細胞凋亡 采用流式細胞儀檢測各組細胞凋亡率,Western blot檢測Bax和Cleaved Caspase3蛋白表達水平,結果顯示,與si-Control組比較,si-FOXQ1組SGC-7901細胞凋亡率、Bax和Cleaved Caspase3蛋白表達水平均顯著降低(P<0.05)。si-Control組和Normal組細胞凋亡率及Bax和Cleaved Caspase3蛋白表達水平差異無統計學意義(P>0.05)。見圖2,表2。
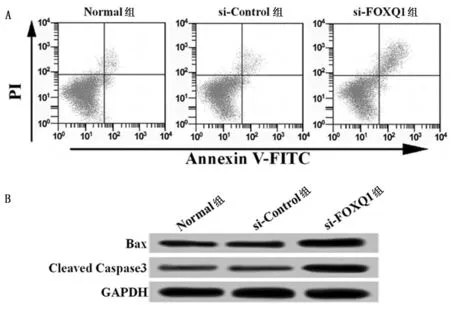
圖2 轉染FOXQ1 siRNA對SGC-7901細胞凋亡的影響;A 流式細胞儀檢測3組SGC-7901細胞凋亡;B Western blot檢測3組SGC-7901細胞中Bax和Cleaved Caspase3蛋白表達情況
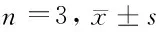
表2 SGC-7901細胞凋亡率及Bax和Cleaved Caspase3蛋白水平比較
2.4 激活SHH信號通路對胃癌SGC-7901細胞凋亡的影響 使用SHH特異性激活劑PM處理轉染si-FOXQ1的SGC-7901細胞24 h,結果顯示,si-FOXQ1組比,si-FOXQ1+PM組SGC-7901細胞中SHH、Smo、Gli1和Gli3蛋白表達水平顯著升高(t1=9.327,t2=4.287,t3=7.746,t4=6.971,P<0.05);細胞凋亡率、Bax和Cleaved Caspase3蛋白表達顯著降低(t1=6.000,t2=6.242,t3=10.651,P<0.05)。見表3,圖3。
圖3 激活SHH信號通路對胃癌細胞凋亡的影響;A 流式細胞儀檢測細胞凋亡率;B Western blot檢測細胞中蛋白表達
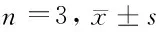
表3 2組SGC-7901細胞凋亡率及蛋白表達水平比較
2.5 轉染FOXQ1 siRNA對SHH信號通路的影響 3組細胞轉染48 h后,采用Western blot檢測SHH信號通路關鍵蛋白及下游分子表達情況,結果顯示,與si-Control組比較,si-FOXQ1組SGC-7901細胞中SHH、Smo、Gli1和Gli3蛋白表達水平均顯著降低(P<0.05)。si-Control組與Normal組比較,SHH、Smo、Gli1和Gli3蛋白表達差異無統計學意義(P>0.05)。見圖4,表4。
圖4 SHH、Smo、Gli1和Gli3蛋白表達條帶
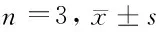
表4 3組SGC-7901細胞中SHH、Smo、Gli1和Gli3蛋白水平
3 討論
FOXQ1是一種轉錄因子,作為致癌基因在癌癥的發展和轉移中起重要作用,日益收到研究者們的關注[11]。研究表明,FOXQ1在非小細胞肺癌、結直腸癌、乳腺癌、神經膠質瘤和肝細胞癌等癌癥中表達升高,參與腫瘤的發生發展[12-14]。FOXQ1過表達通過促進膀胱癌和乳腺癌細胞的上皮間質轉化活性來增強侵襲和轉移,并且沉默FOXQ1可抑制膀胱癌和乳腺癌細胞的生長和轉移[15,16]。Zhang等[17]研究顯示,FOXQ1通過調控BCL11A/MDM2的表達誘導前列腺癌細胞的凋亡,并抑制其增殖。然而,FOXQ1對胃癌細胞凋亡的影響及其機制尚不清楚。本研究結果顯示,FOXQ1在胃癌細胞系中的表達顯著升高,提示FOXQ1基因可能在胃癌的發展中發揮致癌作用。沉默FOXQ1表達,SGC-7901細胞的凋亡率升高,提示抑制FOXQ1表達可誘導為癌細胞凋亡。鄧大煒等[18]研究顯示沉默FOXQ1表達可誘導肝癌SMMC-7721細胞凋亡,這與本研究結果一致。細胞凋亡是一種細胞程序性死亡過程,主要由Caspase介導,其中Caspase3是細胞凋亡的執行者,Caspase3激活形成Cleaved Caspase3可導致細胞發生不可逆的凋亡[19]。Bax是主要的細胞凋亡促進基因,其過度表達可使細胞趨于死亡[20]。本研究結果顯示,沉默FOXQ1表達,SGC-7901細胞中Bax和Cleaved Caspase3蛋白表達顯著上調,提示抑制FOXQ1的表達可能通過上調Bax和Cleaved Caspase3蛋白表達誘導胃癌SGC-7901細胞的凋亡。
SHH信號通路由SHH、Smo及下游轉錄因子Gli1和Gli3蛋白等組成,與腫瘤細胞的發生發展密切相關。研究顯示,特異性阻斷SHH信號通路能夠有效抑制胃癌細胞增殖,并誘導其凋亡[21]。組蛋白甲基轉移酶EZH2抑制SHH可體外誘導成神經管細胞瘤干細胞凋亡[22]。FOXQ1可通過調控SHH信號通路促進自然殺傷/T細胞淋巴瘤細胞的增殖和生長,且阻斷SHH信號通路可誘導細胞凋亡[23]。但關于FOXQ1是否介導SHH信號通路影響胃癌細胞的生物學行為還未知。本研究結果顯示,沉默FOXQ1表達后,SGC-7901細胞中SHH、Smo、Gli1和Gli3蛋白表達均顯著下調,與文獻報道結果[23]一致,提示胃癌SGC-7901細胞FOXQ1可能通過上調SHH信號通路及下游靶基因發揮作用。為驗證該結論,本研究采用SHH信號通路特異性激活劑處理沉默FOXQ1后的SGC-7901細胞,結果顯示,加入SHH信號通路特異性激活劑可部分逆轉沉默FOXQ1對SGC-7901細胞凋亡促進作用,進一步說明FOXQ可能通過介導SHH信號通路誘導SGC-7901細胞凋亡。
綜上,FOXQ1在胃癌細胞中呈高表達,沉默FOXQ1表達誘導胃癌SGC-7901細胞凋亡,其作用機制可能與SHH信號通路有關。FOXQ1基因可能成為胃癌治療的有效作用靶點,為胃癌的分子機制提供了新的見解,并為胃癌的治療提供了新的理論基礎。

