miR-30c-2-3p靶向MPO介導高糖誘導的腎小球系膜細胞凋亡及炎性反應
張娟 陳家斌 陳龍 彭沛 余鳳榮
糖尿病腎病(DN)是導致糖尿病及慢性腎衰竭死亡的重要原因之一,主要表現為腎小球系膜細胞增生小管間質擴張,腎小球系膜區和小管間質細胞外基質積聚等,最終導致腎小球硬化、腎臟纖維化[1]。DN的發病機制尚未完全闡明,研究發現多種miRNA參與系膜細胞損傷,在腎臟纖維化過程中發揮重要作用[2];還參與腎小管間質纖維化,與糖尿病腎病的發生、發展相關[3]。缺氧誘導因子HIF2α在透明細胞腎細胞癌中能增強腫瘤生長,而抑制miR-30c-2-3p表達可以增強HIF2α表達,說明miR-30c-2-3p與腎細胞癌的進展相關[4]。增加miR-30c-2-3p的表達可提高足細胞的活力,同時可增加Nephrin和Podocin蛋白的表達[5]。但miR-30c-2-3p對腎小球系膜細胞凋亡的影響還不清楚。髓過氧化物酶(myeloperoxidase,MPO)是血紅素過氧化物酶超家族成員之一,也是一種炎性指標,在炎癥的發生發展過程中具有重要作用,與多種疾病相關[6]。在高糖的人腎小球系膜細胞中MPO、蛋白的表達增加[7],MPO與空腹血糖水平呈正相關,在糖尿病微血管病變機制中起著十分重要的作用,檢測MPO及空腹血糖濃度,對于糖尿病并發微血管病變的預防和治療具有重要的意義[8]。但miR-30c-2-3p是否通過MPO影響腎小球系膜細胞的進展還不清楚,本文旨在研究miR-30c-2-3p對高糖誘導的腎小球系膜細胞凋亡及炎癥反應的影響以及是否通過MPO發揮作用,為糖尿病腎病的診斷、治療和預后提供新的思路和新靶點。
1 材料與方法
1.1 材料 人腎小球系膜細胞HMC購自中國科學院上海細胞庫;胎牛血清、DMEM培養基、胰蛋白酶、二甲基亞砜(DMSO)、BCA試劑盒、PBS緩沖液購自美國Sigma公司;Lipofectamine TM 2000轉染試劑盒購自美國Invitrogen公司;Trizol試劑、反轉錄試劑盒、熒光定量試劑盒購自日本TaKaRa公司;膜聯蛋白V-異硫氰酸熒光素(Annexin V-FITC)和碘化丙錠(PI)試劑盒、雙熒光素酶報告基因檢測試劑盒購自北京Solarbio公司;抗體均購自上海煊翎生物科技有限公司;酶聯免疫吸附試驗(ELISA)檢測試劑盒購自上海聯科生物技術有限公司;RIPA蛋白裂解液、PVDF膜、SDS-PAGE試劑盒購自上海碧云天生物技術有限公司。
1.2 方法
1.2.1 細胞培養與分組:將腎小球系膜細胞HMC在37℃、含10%胎牛血清的DMEM完全培養液中培養,每天換液一次,將融和至80%左右的細胞無血清饑餓培養24 h后進行分組,用終濃度為30 mmol/L的葡萄糖溶液刺激細胞作為高糖組(HG),培養48 h后收集細胞,同時以終濃度為5 mmol/L的葡萄糖溶液處理細胞作為正常對照組(NG)。將miR-NC,miR-30c-2-3p、anti-miR-NC、anti-miR-30c-2-3p分別轉染至未經任何處理的HMC細胞中,記為miR-NC組,miR-30c-2-3p組、anti-miR-NC組、anti-miR-30c-2-3p組。將miR-NC、miR-30c-2-3p轉染至高糖處理的HMC細胞中,記為HG+miR-NC組、HG+miR-30c-2-3p組。將miR-30c-2-3p與pcDNA3.1、pcDNA3.1-MPO分別共同轉染至高糖處理的HMC細胞中,記為HG+miR-30c-2-3p+pcDNA3.1組、HG+miR-30c-2-3p+pcDNA3.1-MPO組;轉染均采用Lipofectamine TM 2000轉染試劑盒。
1.2.2 qRT-PCR檢測miR-30c-2-3p的表達水平:收集各組細胞,研磨充分后加入Trizol試劑提取總RNA,微量核酸測定儀檢測RNA純度和濃度。使用TaKaRa反轉錄試劑盒將RNA反轉錄成cDNA,按照TaKaRa 熒光定量試劑盒使用說明配制反應體系,以β-actin為內參進行PCR擴增,每個樣品重復3次,循環條件為95℃ 30 s,60℃ 30 s;72℃ 30 s,共40個循環;72℃延長5 min。相對表達量采用2-ΔΔCt法計算。
1.2.3 Western blot檢測蛋白表達:收集各組細胞,加入RIPA裂解液裂解,4℃,12 000 g離心15 min,收集蛋白上清液,BCA試劑盒測定蛋白濃度。將蛋白樣品進行SDS-PAGE電泳后轉至PVDF膜上,5%脫脂奶粉封閉液室溫封閉1 h。分別加入一抗(1∶1 000),4℃孵育過夜,TBST洗膜;加入二抗(1∶2 000)室溫孵育2 h,TBST洗滌3次,每次10 min,后在暗室中曝光顯影,再浸入定影,最后洗去殘液晾干,將膠片用Quantity One凝膠分析軟件處理,測定各組蛋白條帶的吸光度,以目的條帶和GAPDH條帶的比值作為蛋白表達水平。每個蛋白樣品重復3次。
1.2.4 流式細胞術檢測細胞凋亡:用不含EDTA的胰酶消化各組細胞,離心收集各組細胞,PBS漂洗2次,加結合緩沖液重懸細胞。依據試劑盒說明書,先后加入Annexin V-FITC和PI避光孵育15 min。流式細胞儀檢測激發波長488 nm和發射波長530 nm處的熒光強度。實驗重復3次。
1.2.5 ELISA法檢測TNF-α和IL-6的表達:取各組細胞,離心取上清,然后按照ELISA試劑盒說明書進行檢測。
1.2.6 熒光素酶報告基因檢測實驗檢測miR-30c-2-3p對MPO的靶向調控:TargetScan數據庫顯示MPO 3′UTR區域有miR-30c-2-3p結合位點。構建野生型和突變型基因靶點MPO的3′UTR-熒光素酶表達載體(WT-MPO和MUT-MPO),取對數生長期小鼠足細胞接種于24孔板(5×104個/孔),待細胞生長至80%融合時,用LipofectamineTM 2000將WT-MPO和MUT-MPO組細胞分別轉染miR-NC和miR-30c-2-3p。依據說明書要求,使用熒光素酶報告基因檢測儀進行雙熒光素酶報告實驗測定。實驗結果以熒光素酶活性和Renilla活性的比值進行統計學分析。實驗重復3次。
2 結果
2.1 miR-30c-2-3p在高糖作用的細胞HMC中的表達 qRT-PCR檢測結果顯示,與NG組相比,HG組細胞HMC中miR-30c-2-3p的表達水平顯著降低(P<0.05)。可見,miR-30c-2-3p在高糖作用的細胞HMC中低表達。見表1。

表1 miR-30c-2-3p在高糖作用的細胞HMC中的表達
2.2 過表達miR-30c-2-3p對高糖作用的細胞HMC凋亡的影響 qRT-PCR檢測結果顯示,與HG+miR-NC組相比,HG+miR-30c-2-3p組HMC細胞中miR-30c-2-3p的表達水平顯著升高(P<0.05)。Western Blot檢測結果顯示,與HG+miR-NC組相比,HG+miR-30c-2-3p組HMC細胞中Bcl-2蛋白的表達水平顯著升高,Bax蛋白的表達水平顯著降低(P<0.05)。流式細胞儀檢測結果顯示,與HG+miR-NC組相比,HG+miR-30c-2-3p組HMC細胞的凋亡率顯著降低(P<0.05)。可見,過表達miR-30c-2-3p可抑制高糖作用的HMC細胞凋亡。見圖1,表2。

圖1 過表達miR-30c-2-3p對高糖作用的細胞HMC凋亡的影響;A 過表達miR-30c-2-3p對高糖作用的細胞HMC凋亡的影響;B 凋亡相關蛋白的表達

表2 過表達miR-30c-2-3p對高糖作用的細胞HMC凋亡的影響
2.3 過表達miR-30c-2-3p對高糖作用的細胞HMC中IL-6、TNF-α表達的影響 ELISA法檢測結果顯示,與HG+miR-NC組相比,HG+miR-30c-2-3p組HMC細胞中IL-6和TNF-α的表達水平顯著降低(P<0.05)。可見,過表達miR-30c-2-3p抑制高糖作用的細胞HMC中IL-6、TNF-α的表達。見表3。

表3 過表達miR-30c-2-3p對高糖作用的細胞HMC中IL-6、TNF-α表達的影響
2.4 miR-30c-2-3p靶向、調控MPO 通過TargetScan數據庫預測到MPO與miR-30c-2-3p存在結合位點。熒光素酶報告基因檢測實驗結果顯示,轉染野生型MPO基因表達載體WT-MPO后,相較于miR-NC組,miR-30c-2-3p組WT-MPO腎小球系膜細胞的熒光素酶活性顯著降低(P<0.05);而轉染突變型MPO基因表達載體MUT-MPO后,相較于miR-NC組,miR-30c-2-3p組MUT-MPO腎小球系膜細胞的熒光素酶活性差異不顯著。Western Blot檢測結果顯示,相較于miR-NC組,miR-30c-2-3p組腎小球系膜細胞中MPO蛋白的表達水平顯著降低;相較于anti-miR-NC組,anti-miR-30c-2-3p組腎小球系膜細胞中MPO蛋白的表達水平顯著升高(P<0.05)。可見,miR-99a-3p可靶向調控MPO的表達。見圖2,表4、5。

表4 雙熒光素酶報告實驗

表5 miR-30c-2-3p調控MPO的表達
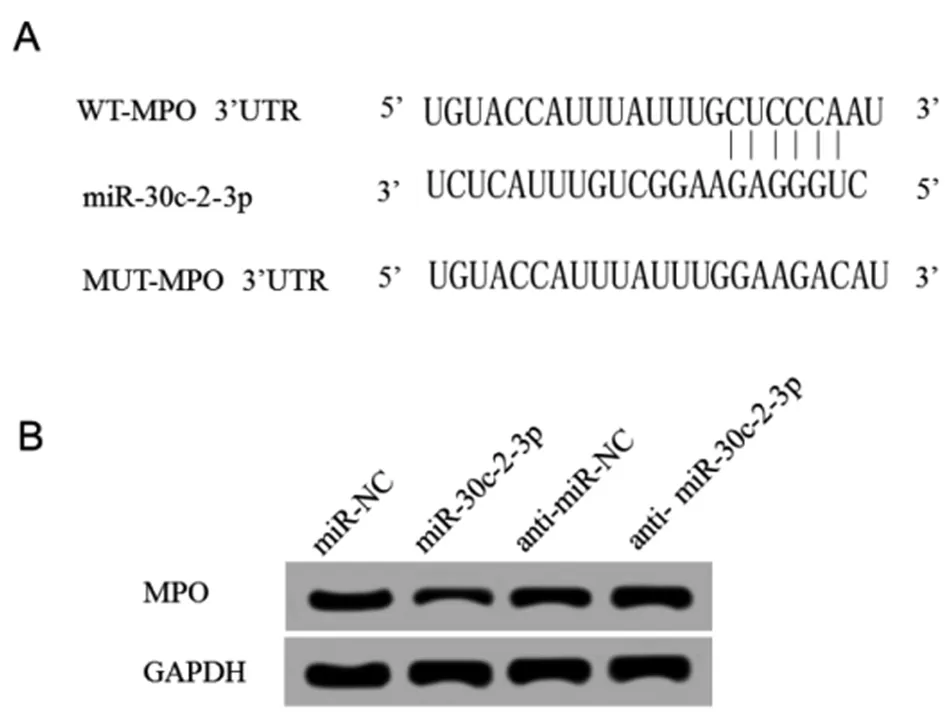
圖2 miR-30c-2-3p靶向、調控MPOA:MPO的3’UTR含有miR-30c-2-3p的互補序列 B:miR-30c-2-3p調控MPO的表達
2.5 過表達MPO能逆轉miR-30c-3p對高糖作用的細胞HMC凋亡及IL-6、TNF-α表達的影響 Western Blot檢測結果顯示,與HG+miR-NC組相比,HG+miR-30c-2-3p組HMC細胞中Bcl-2蛋白的表達水平顯著升高,Bax、MPO蛋白的表達水平顯著降低;與HG+miR-30c-2-3p+pcDNA3.1組相比,HG+miR-30c-2-3p+pcDNA3.1-MPO組HMC細胞中Bcl-2蛋白的表達水平顯著降低,Bax、MPO蛋白的表達水平顯著升高(P<0.05)。流式細胞儀檢測結果顯示,與HG+miR-NC組相比,HG+miR-30c-2-3p組HMC細胞的凋亡率顯著降低;與HG+miR-30c-2-3p+pcDNA3.1組相比,HG+miR-30c-2-3p+pcDNA3.1-MPO組HMC細胞的凋亡率顯著升高(P<0.05)。ELISA法檢測結果顯示,與HG+miR-NC組相比,HG+miR-30c-2-3p組HMC細胞中IL-6和TNF-α的表達水平顯著降低;與HG+miR-30c-2-3p+pcDNA3.1組相比,HG+miR-30c-2-3p+pcDNA3.1-MPO組HMC細胞中IL-6和TNF-α的表達水平顯著升高(P<0.05)。可見,過表達MPO能逆轉miR-30c-3p對高糖作用的細胞HMC凋亡及IL-6、TNF-α表達的抑制作用。見圖3,表6、7。

圖3 過表達MPO能逆轉miR-30c-3p對高糖作用的細胞HMC凋亡蛋白表達的影響

表6 過表達MPO能逆轉miR-30c-3p對高糖作用的細胞HMC凋亡的影響

表7 過表達MPO能逆轉miR-30c-3p對高糖作用的細胞中IL-6、TNF-α表達的影響
3 討論
DN最終導致的終末期腎功能衰竭是糖尿病患者死亡率高的原因之一,嚴重威脅著人類的健康,腎小球系膜細胞的異常增殖是早期DN的重要特征,研究其具體的作用機制有助于早期診斷和預防[9]。研究發現許多miRNAs在腎臟發育、進展和相關疾病中扮演重要角色[10],且在DN中異常表達,參與DN的發病機制[11]。研究發現miR-30c-2-3p在大鼠心肌細胞缺氧/復氧損傷模型中高表達,且抑制miR-30c-2-3p可通過上調XBP1表達減輕心肌細胞缺氧/復氧損傷[12]。miR-30c-2-3p還通過下調乳腺癌中的TRADD和CCNE1負調節NF-κB信號傳導和細胞周期進程[13];有研究通過對原發性局灶節段硬化性腎小球腎炎患者血漿和正常人血漿進行miRNA芯片分析,發現miR-30c-2-3p在腎炎患者中低表達[14]。本實驗結果顯示,miR-30c-2-3p在高糖誘導的腎小球系膜細胞中低表達,過表達miR-30c-2-3p表達可抑制高糖作用的HMC細胞凋亡,抑制IL-6、TNF-α的表達。
MPO主要是由中性粒細胞和單核細胞分泌的一種過氧化物酶,作為一種新型炎癥細胞因子與機體免疫有關,可能通過炎癥反應和免疫應答等誘發疾病的發生[15]。MPO可能通過急性期炎性反應和氧化應激參與終末期腎病的病理過程[16]。研究發現MPO抑制體外培養的內皮細胞的生長和增殖,促進內皮細胞凋亡[17];MPO和IL-6在急性心肌梗死患者中高表達,可作為急性心肌梗死的早期診斷標記物[18]。高糖能使腎小球系膜細胞上清液中MPO活性增加,導致人腎小球系膜細胞氧化失衡[19]。抗MPO抗體可作為腎炎臨床鑒別診斷的參考指標[20]。IL-6、TNF-α也是炎癥相關因子,在糖尿病患者中含量較高,TNF-α可反映糖尿病患者腎臟損傷程度[21]。本實驗結果顯示,miR-30c-2-3p靶向調控MPO的表達,過表達MPO能逆轉miR-30c-2-3p過表達對高糖作用的HMC細胞凋亡及IL-6、TNF-α表達的抑制作用。
綜上所述,miR-30c-2-3p能抑制高糖作用的HMC細胞凋亡,其機制主要是下調MPO及炎性因子IL-6、TNF-α的表達。可為糖尿病腎病的治療提供新思路和新靶點。

