SPE 柱法測定畜產品中29 種二英及其類似物
饒欽雄,張其才,劉 星,王獻禮,李華璽,宋衛國,趙志輝
(上海市農業科學院農產品質量標準與檢測技術研究所,上海201403)
饒欽雄,張其才,劉星,等.SPE 柱法測定畜產品中29 種二英及其類似物[J].上海農業學報,2020,36(4):103-107
1 材料與方法
1.1 試劑與儀器
Trace 1310 高分辨氣相色譜(美國Thermo 公司);DFS 高分辨質譜儀(美國Thermo 公司);Dionex ASE300 加速溶劑萃取儀(美國戴安公司);冷凍干燥儀(北京博醫康);氮氣吹干儀(美國Organomation 公司);R-215 旋轉蒸發儀(瑞士Buchi 公司)。
1.2 HRGC-HRMS 儀器條件
1.2.1 PCDD∕Fs 的色譜參考條件
色譜柱:BPX-DXN 柱,60 m×0.25 mm(內徑) ×0.10 μm;進樣口溫度:270 ℃;進樣方式:不分流模式;傳輸線溫度:280 ℃;升溫程序柱溫:初始溫度為140 ℃,保持1 min,以20 ℃∕min 的速度升到200 ℃,保持1 min,以5 ℃∕min 的速度升到220 ℃,保持16 min,以5 ℃∕min 的速度升到235 ℃,保持7 min,再以5 ℃∕min的速度升到310 ℃,并保持10 min;載氣:高純氦氣( >99.999%);流速:1.0 mL∕min。
1.2.2 DL-PCBs 的色譜條件
色譜柱:BPX-DXN 柱,60 m×0.25 mm(內徑) ×0.10 μm;進樣口溫度:290 ℃;進樣方式:無分流模式;傳輸線溫度:270 ℃;升溫程序:初始溫度為80 ℃,保持3 min,以15 ℃∕min 的速度升到150 ℃,保持2 min,以2.5 ℃∕min 的速度升到270 ℃,保持3 min,再在以15 ℃∕min 的速度升到330 ℃,并保持5 min;載氣:高純氦氣( >99.999%);流速:1.0 mL∕min。
1.2.3 PCDD∕Fs 和DL-PCBs 的質譜條件
電離模式:電子轟擊(EI+);電子能量:45 V;分辨率:≥10 000;源溫:260 ℃;掃描模式:離子模式(SIM);質譜采集質量碎片類型:參考GB 5009.205—2013 標準附表。
1.3 樣品前處理
1.3.1 樣品預處理
將豬和牛等畜產品均質化,冷凍干燥,再將樣品粉碎后存儲于鋁箔袋中,備用。
1.3.2 樣品的提取
稱取試樣10.0 g,與10 g 無水硫酸鈉或硅藻土混合均勻,轉移至加速溶劑提取儀的不銹鋼萃取池中,加入10 μL PCDD∕Fs 和DL-PCBs 的13C 標記定量內標,利用加速溶劑萃取儀進行提取。
提取條件如下,萃取溶劑:正己烷∶二氯甲烷=1∶1(v∕v);壓力:10.3 MPa(1 500 psi);溫度:120 ℃;加熱時間:6 min;靜態提取時間:8 min;吹掃時間2 min;循環3 次。 樣品收集至250 mL 加速溶劑萃取儀接收瓶中。
1.3.3 脂重的測量
將樣品提取液轉移到平底燒瓶中,并用10 mL 正己烷對接收瓶進行洗滌,將洗滌液一并加入到平底燒瓶中,重復3 次;最后將提取液用旋轉蒸發器濃縮至近干,用氮氣吹至恒重,計算前后平底燒瓶重量差,計為脂重。
1.3.4 凈化及濃縮
1.3.4.1 酸性硅膠凈化除脂
使用100 mL 正己烷復溶后,加入50 g 高配比酸性硅膠(硅膠∶濃硫酸=56∶44,質量比),用旋轉蒸發器在55 ℃下旋轉濃縮20 min;靜置8—10 min,將提取液轉移到另一個平底燒瓶中;用50 mL 正己烷洗平底燒瓶中的硅膠,收集正己烷于第二個平底燒瓶中,重復3 次(如果酸性硅膠顏色較深,則應該重復上述過程,直至酸性硅膠為淺黃色)。 最后,將收集液旋轉蒸發濃縮至3—5 mL,供下一步凈化。
1.3.4.2 復合硅膠SPE 柱和活性炭SPE 柱凈化
用30 ml 正己烷負壓預淋洗復合硅膠SPE 柱,當液面降至無水硫酸鈉層上方約2 mm 時,關閉負壓,棄去淋洗液;復合硅膠SPE 柱流出端串聯上活性炭SPE柱(圖1),用10 ml 正己烷淋洗;當液面降至無水硫酸鈉層上方約2 mm 時,關閉負壓,棄去淋洗液;柱下放置梨形瓶準備上樣接收。 此過程應檢查凈化柱,如果出現溝流、斷層現象應更換新柱。
用70 mL 正己烷洗脫串聯色譜柱DL-PCBs,洗脫液全收集;取下活性炭SPE 柱,在流入端串聯上玻璃空SPE 柱,再用30 mL 甲苯洗脫串聯色譜柱PCDD∕Fs,洗脫液全收集;將收集的洗脫液旋轉蒸發濃縮至3—5 mL,供下一步濃縮用。
1.3.4.3 微量濃縮及溶劑置換
將上述濃縮液轉移至球型濃縮器中,濃縮至0.2—0.3 mL,轉移至帶有襯管的棕色進樣小瓶中,在氮氣流下吹至約剩20 μL,加入20 μL 壬烷溶液,分別加入10 μL PCDD∕Fs 和DL-PCBs 回收率內標溶液,上HRGC∕HRMS 分析檢測。
1.4 方法準確度和精密度驗證
于豬肉和牛肉樣品中,添加適量的PCDD∕Fs 和DL-PCBs 標準品,2378-TCDF 和2378-TCDD 添加水平為20 pg∕g,OCDF 和OCDD 添加水平為200 pg∕g,其他25 種二英類化合物添加水平為100 pg∕g,設置4個平行、1 個樣品空白和1 個系統空白樣品,按1.3 進行樣品前處理,上HRGC-HRMS 儀器測定。
2 結果與分析
2.1 色譜柱的選擇
選用Thermo TR-DIOXIN-5MS(60 m×0.25 mm ×0.25 μm)(簡稱TR 柱)和SGE BPX-DXN[60 m ×0.25 mm(thickness)](簡稱BPX 柱)兩款毛細管柱進行PCDD∕Fs 和DL-PCBs 的分析。 在色譜分離上,2,3,3′,4,4′,5-HxPCB 和2,3,3′,4,4′,5′-HxPCB 兩個化合物在TR 和BPX 這兩款色譜柱上的分離度分別為1.89 和2.69。 在建立標準曲線時, TR 柱PCDD∕Fs 的RSD 在0.7%—18.7%,PCBs 的RSD 在1.3%—9.7%,BPX 柱PCDD∕Fs 的RSD 在2.8%—6.6%,PCBs 的RSD 在0.4%—9.4%。 綜上,BPX 色譜柱在分析PCDD∕Fs 和DL-PCBs 時分離度以及定量準確性更高,更加適用于二英類化合物的測定。
2.2 SPE 凈化柱洗脫條件的摸索
通過加標洗脫的方式確定SPE 凈化柱的洗脫條件。 加入10 μL PCDD∕Fs 混標和10 μL DL-PCBs 混標,同時加入定量內標,過復合硅膠和活性炭SPE 柱,凈化分離。 采用正己烷100 mL 洗脫DL-PCBs,每20 mL 收集1 次;采用30 mL 甲苯洗脫PCDD∕Fs,每10 mL 收集1 次。 結果表明,使用20—40 mL 正己烷,DL-PCBs 洗脫效率最高,使用60 mL 正己烷DL-PCBs 的洗脫率達到95.2%以上,為保證方法的穩定性,確定DL-PCBs 的正己烷洗脫體積為70 mL;20 mL 甲苯對PCDD∕Fs 洗脫率已經達到91.1%以上,為了充分洗脫出17 種PCDD∕Fs,最終確定PCDD∕Fs 的洗脫體積為30 mL。
2.3 方法準確度和精密度

表1 豬肉中添加回收結果(n=4)Table 1 The results of fortified recovery in pork(n=4)

表2 牛肉中添加回收結果(n=4) Table 2 The results of fortified recovery in beef(n=4)
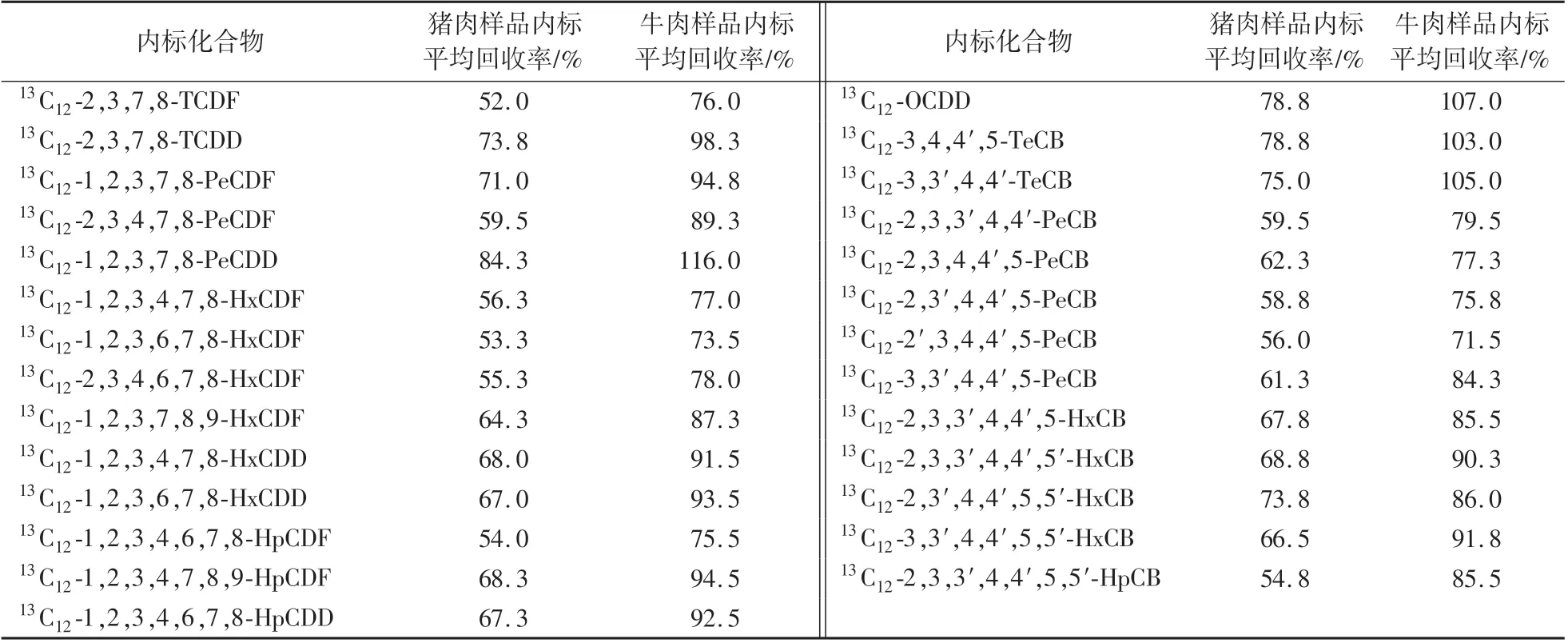
表3 同位素內標回收率(n=4)Table 3 The recovery of isotopic internal standard(n=4)
2.4 實際應用
3 結論與討論
本文采用SPE 負壓的模式進行樣品的凈化,相比于GB 5 009.205—2013[6]中的玻璃層析柱重力過柱的方法,效率較高,并可減少有機溶劑約40%;張莉娜等[8]采用濃硫酸除脂,多段混合硅膠柱和氧化鋁柱凈化植物油樣品,其流程較為復雜,且多次操作濃硫酸較為危險;任曼等[9]經酸性硅膠床、多段混合硅膠柱和凝膠滲透色譜柱(GPC)凈化后,再用硅藻土柱分離的方法,凈化步驟較多。 本研究建立的二英類化合物檢測技術,雖未在凈化原理上有較大突破,但在提高效率并減少有機溶劑使用量等方面具有良好的實際應用價值,適用于我國畜產品中二英類化合物的檢測。

