旋轉式生物反應器培養細胞因子誘導的殺傷細胞研究
許小婷,汪 月,王 琳,曾憲卓
隨著世界人口日趨老齡化,癌癥正在成為引起人類非正常死亡的最重要原因,目前在全球每年有大約1 000萬人死于各種癌癥[1]。傳統的治療癌癥手段如放療、化療和手術治療等已逐漸進入平臺期。近年來,腫瘤免疫療法研究取得了重要進展,腫瘤免疫細胞治療受到越來越多的關注,預示著免疫細胞治療有望成為繼手術、化療、放療、靶向治療后惡性腫瘤治療領域的又一場革新[2]。基于免疫細胞的臨床應用越來越廣泛,如何有效的大規模培養免疫細胞也顯得尤為重要。但目前大多數的免疫細胞培養都是采用傳統的實驗室培養瓶培養法,具有無法實現單次培養單元滿足一個患者的細胞使用量、占地面積大、無法監控導致細胞培養批次產生顯著差異、培養周期長、勞動強度大及人力成本高等缺陷。與傳統的實驗室培養瓶培養相比,使用生物反應器的細胞培養具有自動化、全程條件可控、動態培養可以提供一個更加穩定和均勻的培養環境和具有大規模工業化潛力的優點,可以從根本上解決傳統細胞培養數量少、穩定性差、易污染、工作量大及周期長等問題[3]。本研究選用旋轉式生物反應器(rotating wall-vessel bioreactor,RWV)培養細胞因子誘導的殺傷(cytokine-induced killer,CIK)細胞,與傳統的實驗室培養瓶培養法進行比較,驗證各培養組CIK細胞的增殖能力、細胞因子分泌情況及腫瘤殺傷活力。
1 材料與方法
1.1 材料
1.1.1 樣本采集 8名男性健康成年人志愿者外周血標本,50 mL/份,EDTA抗凝,無菌采集。
1.1.2 RWV RWV(自主研發;專利號:ZL201520729703.8),包括具有容納凹部的底座以及與該底座相適配的頂蓋;底座的容納凹部內設有可拆卸的細胞培養盒,且細胞培養盒內具有階梯柱形的細胞培養空間;底座上還設有用于驅動該底座以底座中軸線為軸進行自轉的驅動裝置。圖1。
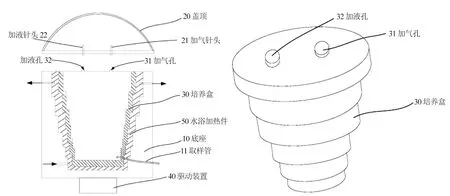
圖1 RWV示意圖
RWV可通過培養盒滿足不同個性化個體細胞培養的要求,培養過程從小量到大量的過度。常規的電機或馬達等驅動裝置很容易的使底座進行自轉攪拌,RWV避免了常規發酵罐用渦輪式旋流或者是攪拌棒攪拌等方式產生的機械沖擊和剪切力造成的細胞損傷[4]。RWV的主要優點是沒有攪拌剪切力,可以為細胞的生長提供一個相對溫和的三維環境;另一個特點是具有隨機化的重力向量,可能直接影響細胞基因的表達,或者間接促進細胞的自分泌/旁分泌,從而影響細胞的增殖分化和組織器官形成。RWV可用于當前十分熱門的組織工程研究,也可用于探索微重力環境對細胞生長、分化等的影響[5]。
1.1.3 主要試劑 RPMI-1640、PBS(美國Gibco公司);肝素(美國Sigma-Aldrich公司);Ficoll淋巴細胞分離液(北京索萊寶科技有限公司);IL-2,IFN-γ,TNF-α因子ELISA試劑盒(美國Sigma-Aldrich公司);FITC標記的CD3、CD4、CD8單抗,PE標記的CD56單抗(美國Sigma-Aldrich公司)。
1.2 方法
1.2.1 外周血單核細胞分離 取外周血20 mL(20 mg/L肝素抗凝),按1∶1的比例,用1xPBS稀釋外周血。另取一支離心管中加入Ficoll,將血樣沿離心管壁緩慢注加于Ficoll表面(Ficoll:稀釋血=1∶1),20 ℃,1 500 r/min,離心30 min。吸取外周血單個核細胞(peripheral blood mononuclear cell,PBMC)層(中間白膜層)移入另一支試管,加入5倍體積PBS,1 800 r/min,離心5 min,棄上清,再次加入5倍體積PBS,1 800 r/min,離心5 min,棄上清。RPMI1640洗滌1次5 min。以RPMI-1640培養基和10% AB型血清重懸,37 ℃,5% CO2培養箱培養2 h去貼壁細胞,吸取懸浮細胞,備用。
1.2.2 體外誘導CIK細胞 利用成人外周血提取的PBMC以RPMI1640和10% AB型血清重懸并調節細胞濃度為1×106/mL的細胞懸液,加入IFN-γ 1 000 U/mL,置于37 ℃,5% CO2培養箱培養24 h,第1天加入抗CD3mAb終濃度為50 μg/L的IL-1β和IL-2,終濃度分別為105U/L和3×105U/L,37 ℃、5% CO2培養箱繼續培養,隔日進行細胞計數,補充新鮮的培養基以維持適當的細胞密度[(0.5~1.5)×106/mL],培養數天后,在無菌操作的條件下將細胞轉入生物反應器中進行培養。
1.2.3 分組 將CIK細胞以0.6×107/mL的密度接種到RWV中,設置反應器的溫度為37℃、轉速7~10 r/min及培養基的循環率為5 r/min,作為RWV組。同時以相同的密度接種到T-Flask培養瓶中培養(放置于37 ℃,5% CO2飽和濕度培養箱中培養),作為傳統實驗室培養瓶組(CTRL組)。
1.2.4 培養體系效能評價
1.2.4.1 活細胞計數 分別從T-Flask培養瓶中和RWV取樣口中取樣1 mL細胞懸液,調整細胞密度為1.0×106/mL,取9滴細胞懸液移入小試管,加入1滴0.4%臺盼藍溶液,混勻。在3 min內用血球計數板分別計數活細胞和死細胞,鏡下死細胞被染成淡藍色,活細胞拒染。在誘導培養后第4、8、10、12、14、17、21和24天取培養的CIK細胞懸液,用臺盼藍拒染法計數活細胞數,除以初始細胞數,得出實際擴增倍數。并繪制各組細胞的生長曲線圖,記錄各組間的細胞增殖情況。
1.2.4.2 細胞因子分泌水平檢測 各實驗組在培養的第0、4、8、10、12、14、17、21和24天分別取1 mL CIK細胞懸液,充分洗滌,調整細胞濃度為2×106/mL培養24 h后,收集上清,用ELISA法定量測定免疫細胞培養上清中IL-2,IFN-γ,TNF-α變化情況,設4個平行孔。
1.2.4.3 細胞毒性檢測 細胞毒活性的分析,采用乳酸脫氫酶(lactate dehydrogenase,LDH)法。選擇K562作為靶細胞,將5 mL/dL小牛血清與RPMI1640混合后的培養液調整靶細胞濃度為1×105/mL;將混合液加至96孔板中,每孔100 μL,每組設定3個復孔,設置陰性對照組(靶細胞自然釋放孔不加效應細胞)加100 μL培養液;陽性對照組各加入100 μL 1g/dL NP40;在每孔中加入100 μL效應細胞,效靶比設置為5∶1、10∶1、20∶1;陰性對照組中的3個復孔用100 μL培養液替代效應細胞;將孔板放置于37 ℃,5% CO2培養箱培養4~6 h;用自動生化分析儀檢測LDH數值計算細胞殺傷活性。殺傷率(%)=(實驗組A值-靶細胞的自然釋放A值-效應細胞的自然釋放A值)/(靶細胞的最大釋放A值-靶細胞的自然釋放A值)。
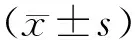
2 結果
2.1 CIK細胞的增殖能力比較 對2組分別在培養的第0、4、8、10、12、14、17、21和24天進行臺朌藍染色后,對活細胞進行計數并繪制生長曲線(圖2)。結果顯示在第4天以后,RWV組的細胞增殖速度開始超過CTRL組。CTRL組的細胞從第4天開始增殖,增殖高峰在第17天,增殖平臺為第14~17天,隨后細胞數量減少。RWV組的細胞也在第4天開始增殖,增殖高峰在第21天。從生長曲線中可以看出,在第4天各組的細胞開始出現增殖后,RWV組以后的每個時間段的細胞增殖數量都多于CTRL組。
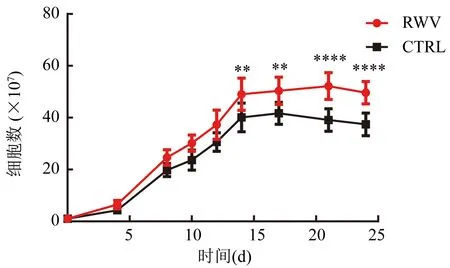
注:CIK細胞數量增殖變化,與CTRL組比較,在培養的第14天(t=3.55,**P<0.01)、第17天(t=3.451,**P<0.01)、第21天(t=5.197,****P<0.000 1)、第24天(t=4.856,****P<0.000 1);組間比較,F=12.85,P=0.007 1圖2 CIK細胞生長曲線變化趨勢
2.2 細胞因子分泌水平比較 結果顯示(圖3),2組細胞在第4天分泌IL-2因子的水平開始升高,RWV組在第21天IL-2因子分泌水平達到高峰(151.27±2.65)pg/mL,CTRL組在第17天達到高峰(138.33±2.10)pg/mL。RWV組在第10天之前與CTRL組的IL-2因子分泌水平無差異。但在第14天以后RWV組的CIK細胞分泌IL-2因子量一直高于CTRL組。
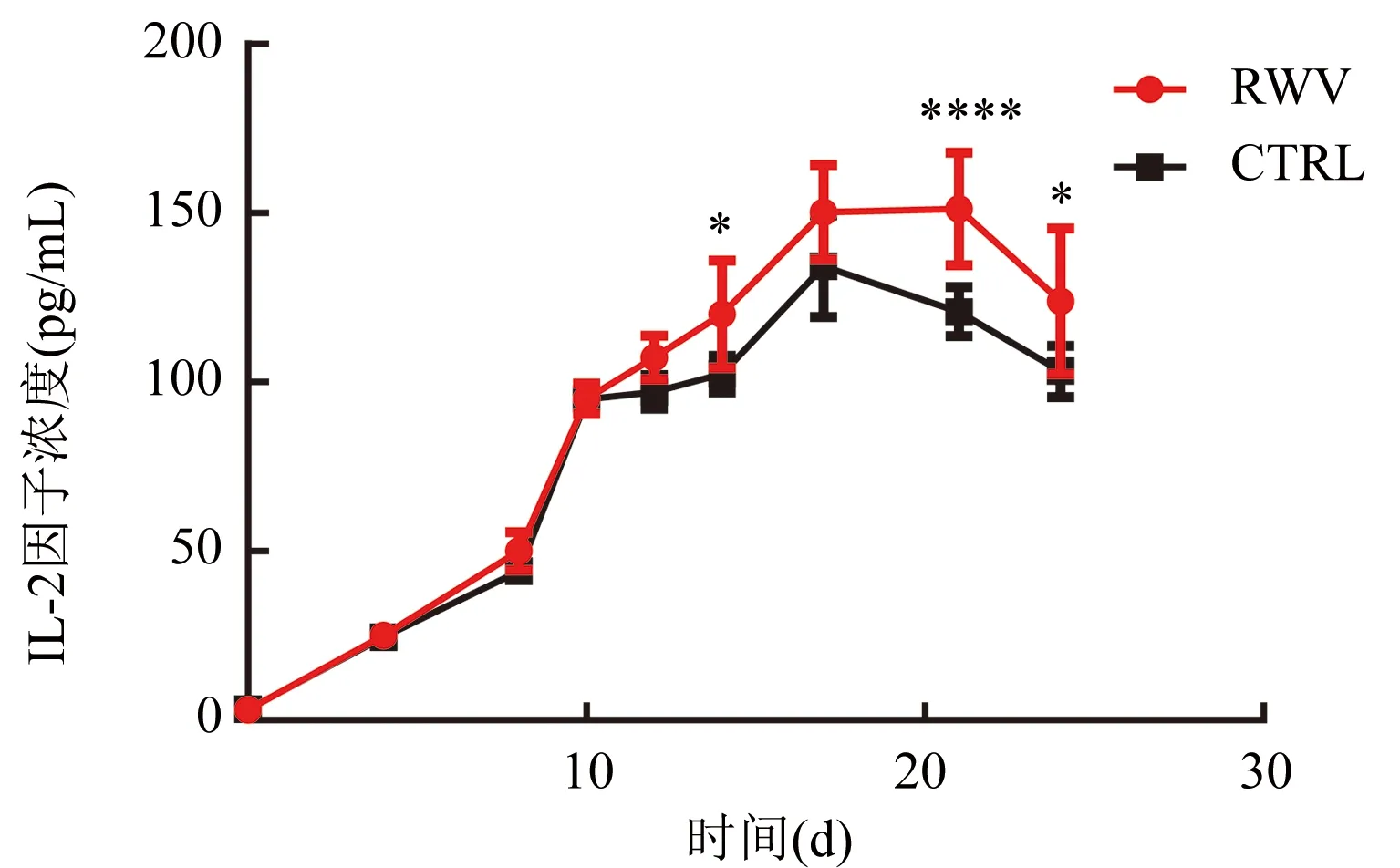
注:CIK細胞分泌IL-2因子濃度,與CTRL組比較,在培養的第14天(t=2.878,*P<0.05)、第21天(t=4.939,****P<0.000 1)、第24天(t=3.358,*P<0.05);組間比較,F=14.87,P=0.004 8圖3 CIK細胞分泌IL-2因子水平表達情況
CTRL組CIK細胞分泌的IFN-γ在第21天達到高峰(209.00±2.58)pg/mL,RWV組也是在第21天達到高峰(252.80±4.07)pg/mL。在CIK細胞培養的第10天RWV組的CIK細胞分泌IFN-γ開始高于CTRL組(圖4)。
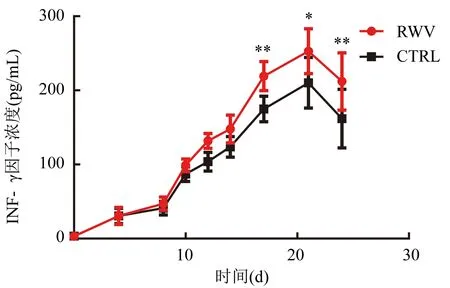
注:CIK細胞分泌IFN-γ因子濃度,與CTRL組比較,在培養的第17天(t=3.514,**P<0.01)、第21天(t=3.371,*P<0.05)、第24天(t=3.973,**P<0.01);組間比較,F=18.27,P=0.002 7圖4 CIK細胞分泌IFN-γ因子水平表達情況
CTRL組分泌的TNF-α因子在第17天前都高于RWV組,第20天后則反之。CTRL組的TNF-α因子分泌在第17天達到高峰(251.25±3.02)pg/mL,RWV組則在第21天達到高峰(274.00±4.11)pg/mL(圖5)。
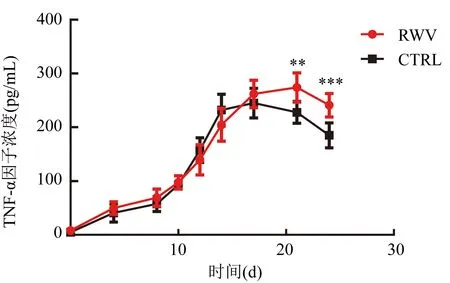
注:CIK細胞分泌的TNF-α因子濃度,與CTRL組比較,RWV組在培養的第21天(t=3.518,**P<0.01)、第24天(t=4.265,***P<0.001);組間比較,F=11.01,P=0.010 6圖5 CIK細胞分泌TNF-α因子水平表達情況
2.3 CIK細胞毒性比較 結果顯示(表1),在不同效靶比條件下,RWV組的殺傷率明顯優于CTRL組,差異比較具有統計學意義(P<0.05)。在不同的效靶比下,2組殺瘤率隨著效靶比的增大而加大,但RWV組的殺瘤率都大于CTRL組。
表1 細胞毒性檢測結果
3 討論
隨著科學技術的進步,細胞治療作為繼手術、放療和化療后發展的第4類腫瘤治療方法,在各種癌癥等難治性疾病的治療中發揮越來越重要的作用。免疫細胞可通過調控激發機體的免疫反應來對抗、抑制和殺滅癌細胞。多項研究與臨床驗證表明[6],免疫細胞具有較好的擴增性能和強的殺瘤活性,并對自身組織沒有細胞毒性等優勢。因此,其應用價值日益受到重視。1986年,Lanier等[7]第一次報道了CIK細胞,具有3種非MHC限制性細胞毒性的細胞亞群,即CD3+CD16-CD56+、CD3-CD16+CD56+和CD3-CD16-CD56bright細胞。CIK細胞在外周血中僅占不到5%。研究發現[8],CIK細胞的免疫表型主要是CD3+CD56+細胞。CIK細胞是將PBMC用多種細胞因子共刺激,體外培養后獲得的一群異質細胞[9],能同時表達CD3和CD56兩種膜蛋白分子[10],兼有T淋巴細胞強大的抗瘤活性和NK細胞的非MHC限制性殺瘤優點[11]。尤其對手術后或放化療后患者效果顯著,能消除殘留微小的轉移病灶,防止癌細胞擴散和復發,提高機體免疫力。多項臨床試驗已經顯示[12],CIK細胞能夠提高腫瘤患者生活質量,延長患者生存期。
基于免疫細胞的臨床應用越來越廣泛,如何有效的大規模培養免疫細胞也顯得尤為重要。目前免疫細胞體外擴增的難點是如何確保細胞批次間的質量穩定。使用生物反應器擴增免疫細胞技術可以從根本上解決傳統細胞培養數量少[13]、穩定性差、易污染、工作量大及周期長等問題[14],有效地降低臨床治療成本。
本研究中使用自主研發的RWV對免疫細胞進行大規模培養研究。以傳統的體外擴增培養為對照組,對各組進行細胞增殖檢測、細胞因子分泌水平檢測和細胞毒性檢測。結果都顯示了RWV培養具有較長的CIK細胞生長周期,細胞增殖數量大大提高;對于CIK細胞分泌的IL-2、IFN-γ、TNF-α進行濃度檢測,2組間差異比較具有統計學意義(P<0.05),RWV組的CIK細胞因子分泌水平明顯高于CTRL組。研究結果表明,RWV的CD3+CD56+細胞增殖高峰在培養的第21天,IL-2、IFN-γ、TNF-α因子的表達高峰在第17~21天,這提示在CIK細胞的回輸治療中,應在生物反應器培養的第17天后回輸,治療效果更佳。LDH法檢測細胞毒性結果顯示經RWV培養后的CIK細胞具有更強的腫瘤殺傷活力。
本研究一定程度上解決了免疫細胞培養中細胞活性喪失、細胞擴增數量不足的難題。除此之外,研究小組還開發了具有高效擴增免疫細胞并有效維持其免疫活性的培養體系,并與RWV相結合應用,實現了大規模自動化細胞培養的雛形,一定程度上滿足了臨床的細胞質量要求。但因各個生物反應器存在差異,其控制系統還不夠穩定,難免培育出的細胞會存在質量上的差異,因此,需要進一步對生物反應器進行調試組裝升級,才能實現量產機的生產與使用,加快進入“工廠式”的大規模化自動培養工業級標準化的臨床級細胞。
經過幾十年來的研究與實踐,雖然生物反應器大規模培養細胞的技術還存在著不少問題,但較之前已是質的飛躍,隨著這一技術的進一步發展,我們需將不斷努力,研制出更理想的生物反應器,以獲得更高密度、高活力的細胞;開發新的無血清培養基,使細胞的生長狀態更好,生物制品更安全;建立細胞培養與產物分離的渦合系統,充分利用培養液,以降低生產成本等,從而使細胞培養技術在生物制品制備和基因工程等領域得到更廣泛的轉化應用。

