人造血干細胞在不同氧濃度下生長、凋亡狀況觀察研究*
葉 果,楊 鑫
(重慶大學附屬腫瘤醫院頭頸腫瘤中心,重慶 400030)
人造血干細胞(HSCs)在不同因素直接影響下增殖、分化成各種細胞,如骨髓組織細胞、淋巴組織細胞、白細胞、紅細胞、上皮組織細胞等。HSCs具備不停自我更新和變異的潛力。1988年THOMSON等[1]在實驗室成功建立了胚胎干細胞系。從此以后,HSCs在實驗室被進一步培養為多種細胞,包括骨細胞、軟骨細胞[2]、血細胞、神經細胞、肌肉細胞、胰島細胞等[3-4]。基于HSCs優良的不斷增殖和多向分化能力,在組織損傷重建的研究中HSCs表現出突出的作用[5]。與此同時,在臨床修復治療中HSCs的多向分化性也獲得了廣泛應用。在干細胞的培養條件中環境因素至關重要,不同的環境因素包括氧濃度、pH值、溫度、滲透壓等,均能影響干細胞的增殖與分化。氧濃度對干細胞的生長和凋亡有至關重要的影響,JOBIN等[6]的研究發現,在體外培養的低氧環境下,干細胞的生長受到明顯干預。本研究主要觀察HSCs在人體外培養的狀況下,在不同氧濃度中的生長和凋亡情況,為將來的基礎性試驗與臨床應用提供一定依據。
1 材料與方法
1.1材料 HSCs由上海拜沃生物科技有限公司提供。RPMI1640培養液(上海鈺森生物技術有限公司)、Metho CultTMHCC4230培養基(加拿大Stem cell Technologies Inc公司)、IMDM培養基(上海北諾生物科技有限公司)、二氧化碳培養箱(長沙長錦科技有限公司)、Annextin V(美國Becton,Dickinson and Company)、微氧手套箱(COY Laboratory Products公司)、6孔培養板(廣州潔特生物過濾股份有限公司)、Annexin V-FITC細胞凋亡檢驗試劑盒(杭州昊鑫生物科技股份有限公司)、CKC-TR-2W型倒置顯微鏡(Olympus,Japan)、YJ-875型超凈化工作臺(蘇州安泰凈化設備廠)、BD-CAN7型流式細胞儀(美國Becton,Dickinson and Company)。
1.2方法
1.2.1細胞培養 HSCs用10%胎牛血清的RPMI1640培養液培養。
1.2.2不同氧濃度的細胞培養處置方式 將HSCs分為實驗組和對照組。實驗組細胞在微氧手套箱中培養的氧濃度分別設定為:3%、5%、15%;對照組細胞在微氧手套箱中培養的氧濃度設定為20%。
1.2.3紅系集落形成單位(CFU-E)集落培養 采用Metho CultTMHCC4230培養基,0.9 mL培養基加入0.1 mL的細胞懸液(細胞密度2×109個/升),用IMDM培養基補足為1 mL,充分混勻后轉移至35 mm的6孔培養板,每份標本重復5孔,置不同氧濃度,37 ℃飽和濕度的培養箱內,培養4、7、10 d時分別計數CFU-E集落數。
1.2.4流式細胞儀檢測HSCs凋亡率 采用10%胎牛血清的RPMI1640培養基,0.9 mL培養基加入0.1 mL的細胞懸液(細胞密度2×109個/升),用IMDM培養基補足為1 mL,將HSCs在不同氧濃度下分別培養6、12、24 h,使用Annexin V-FITC細胞凋亡檢驗試劑盒,通過BD-CAN7型流式細胞儀檢測HSCs凋亡率。
1.2.5相關性分析 氧濃度為3%、5%、15%、20%分別記作3%氧濃度組、5%氧濃度組、15%氧濃度組、對照組。培養4、7、10 d時研究不同氧濃度和CFU-E集落數的相關性;培養6、12、24 h時研究不同氧濃度和HSCs凋亡率的相關性。

2 結 果
2.1人造血干細胞 倒置顯微鏡下觀察分離培養的人血干細胞,見圖1。

圖1 人造血干細胞(HE×400)
2.2CFU-E集落數結果 培養4、7、10 d,5%氧濃度組CFU-E集落數最高,3%和5%氧濃度組與對照組CFU-E集落數比較,差異均有統計學意義(P<0.05)。見表1。
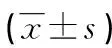
表1 各組CFU-E集落數比較
2.3不同氧濃度組HSCs凋亡率比較 培養6 h,5%氧濃度組HSCs凋亡率最低,3%和5%氧濃度組與對照組HSCs凋亡率比較,差異均有統計學意義(P<0.05);培養12 h,5%氧濃度組HSCs凋亡率最低,5%和15%氧濃度組與對照組HSCs凋亡率比較,差異均有統計學意義(P<0.05);培養24 h,5%氧濃度組HSCs凋亡率最低,3%和5%氧濃度組與對照組HSCs凋亡率比較,差異均有統計學意義(P<0.05)。見圖2。

圖2 流式細胞儀測定HSCs凋亡率
2.4不同氧濃度和CFU-E集落數、HSCs凋亡率相關性分析
2.4.1分別培養4、7、10 d,不同氧濃度和CFU-E集落數相關性分析 培養4、7、10 d氧濃度變化與CFU-E集落數均呈正相關(r=0.486、0.848、0.813,P<0.05)。
2.4.2分別培養6、12、24 h,不同氧濃度和HSCs凋亡率相關性分析 培養6、12、24 h后氧濃度變動與HSCs凋亡率均呈正相關(r=0.743、0.785、0.773,P<0.01)。
3 討 論
HSCs在增殖、分化、凋亡過程中受不同環境因素的影響,包括溫度、氧濃度、滲透壓、pH值等,其中至關重要的一項因素就是氧濃度,而最容易忽視的一項因素也是氧濃度。在不同氧濃度下,HSCs的生物學行為顯現出多種多樣。有科學研究推測出HSCs在人體內最適宜生存的微環境不是常氧狀態,而是低氧狀態[7-8]。低氧狀態是人體內普遍存在的一種生理環境,因此,也促進了人體內細胞的發育及多種病變的轉變[9]。目前,國際和國內對于HSCs的體外培養,普遍采用常氧狀態,而體內低氧狀態與實驗室中的常氧狀態有巨大差異,卻較少有研究關注低氧狀態下HSCs的增殖、分化、凋亡情況。因此,本研究選用不同氧濃度培養HSCs,可更為真實地模擬人體內不同的真實生存環境狀態。
HSCs在自我修復、更新及分化方面有明顯優勢。同時,HSCs的增殖、復制、歸巢后重建造血、多向分化、凋亡等生物學方面的功能也受周圍各種環境因素的廣泛制約[10-11]。在人體內骨髓環境中為低氧狀態,而這正是HSCs主要的生存區域[12-13]。人體內的這種低氧狀態,對于HSCs生物學方面的基本功能的持續保持起關鍵作用[14-16]。有研究發現,低氧狀態會促進神經干細胞的增殖,與此同時神經干細胞的凋亡卻出現明顯抑制效果[17]。人體內部的低氧誘導因子(HIF)-1是細胞在低氧狀態下適應與應答調節中的主要轉錄因子,HIF-1在細胞的生長、增殖、分化、凋亡等生物學活動中起舉足輕重的作用。HIF-1有α和β 2個亞基,常氧狀態下,因為被蛋白酶系統降解的原因,HIF-1α在細胞質內處于失活狀態。而在低氧狀態下,HIF-1α大量聚集活化,同時轉移到細胞核內,與細胞核內的HIF-1β相結合構成HIF-1分子,進而辨識、結合其中包含有低氧化學反應元件的DNA序列,從而介導、調節和管控與低氧反應所涉及基因的表達[18]。在人體內骨髓中平均氧濃度為5%,靜脈血平均氧濃度為12%~15%,動脈血平均氧濃度為20%。本研究將體外培養環境中各組氧濃度分別設定為3%、5%、15%、20%,正是要模擬HSCs在人體內不同氧濃度下的生長、凋亡狀況。而這方面的研究工作國際和國內的報道相對較少。
4 結 論
本研究發現,HSCs分別培養4、7、10 d,其中5%氧濃度組CFU-E集落數最高;分別培養6、12、24 h,其中5%氧濃度組HSCs凋亡率最低。由此推測,不同氧濃度對HSCs的生長和凋亡有直接影響,而其中5%氧濃度能促進HSCs的生長,同時也能抑制HSCs的凋亡,可為今后的臨床應用和實驗室研究提供一定理論依據。

