多重耐藥鮑曼不動桿菌中ponA表達及其對碳青霉烯類抗生素誘導反應觀察
魏星,游德紅,鄭蘭,龐博,余爽,陳思,龔大彩,徐革
1成都市郫都區人民醫院,成都611730;2彭州市中醫院
多重耐藥鮑曼不動桿菌(MDR-AB)是臨床最常見的耐藥菌之一,其耐藥機制主要包括碳青霉烯酶的產生、膜孔蛋白丟失或表達降低、藥物外排泵活性增加和青霉素結合蛋白(PBPs)的改變等[1]。對鮑曼不動桿菌耐藥機制的研究中,PBPs改變導致細菌耐藥的相關研究較少。PBPs是細菌肽聚糖合成過程中的重要蛋白質,在細菌細胞壁合成過程中起關鍵作用。β-內酰胺類抗菌藥物因與天然D-丙胺酰-D-丙胺酸的結構相似,可通過共價鍵與PBPs中的活性位點結合,抑制轉糖基酶和轉肽酶活性,進一步抑制肽聚糖的合成,導致細菌細胞壁破壞,將細菌殺死[2]。細菌PBPs結構及數量的改變是其產生耐藥的重要因素。鮑曼不動桿菌含有7種PBPs[3](PBP1a、PBP1b、PBP2、PBP3、PBP5/6、PBP6、PBP7),其中ponA編碼的PBP1a蛋白主要功能是維持細胞形態,是β-內酰胺類抗菌藥物作用的主要靶點之一。研究發現,ponA基因位點突變可以改變抗生素作用靶點,導致細菌對抗菌藥物敏感性降低而產生耐藥[4]。目前,有關ponA在鮑曼不動桿菌耐藥中作用的研究較少。2018年6~12月,本研究觀察了MDR-AB中ponA表達情況,及ponA對三種碳青霉烯類抗生素(亞胺培南、美羅培南、多尼培南)誘導的反應,從基因水平對PBPs改變導致細菌耐藥的機制進行初步了解,現報告如下。
1 材料與方法
1.1 菌株與主要實驗材料
1.1.1 菌株來源 收集2018年6~12月成都市郫都區人民醫院臨床分離的MDR-AB,剔除重復菌株,共19株。其中13株來源于痰液、2株來源于血液、2株灌洗液、1株來源于分泌物、1株來源于尿液。19株菌對大多數抗菌藥物耐藥,對頭孢哌酮/舒巴坦的耐藥率為47.37%。未發現對多黏菌素B耐藥的菌株(見表1)。質控菌株為大腸埃希菌ATCC25922和銅綠假單胞菌ATCC27853。
1.1.2 主要實驗材料 亞胺培南、美羅培南、多尼培南購于北京索萊寶科技有限公司,總RNA提取試劑盒、SYBR Premix Ex TaqTMⅡ、PrimeScriptTMRT reagent Kit購于大連TaKaRa公司。PCR儀器為上海宏石SLAN-48P/96S全自動定量PCR儀,菌株鑒定及藥敏試驗采用美華MA120微生物鑒定及藥敏分析儀,電泳儀購于北京六一儀器廠,凝膠成像儀購自上海復日科技有限公司。
1.2 MDR-AB中ponA基因表達及突變觀察
1.2.1 基因表達檢測 將菌株取出,劃線培養于巧克力平板上,37 ℃培養18~20 h,第2天挑取單菌落于含200 μL無菌超純水的離心管中,用細菌基因組DNA提取試劑盒(北京索萊寶技術有限公司)按說明書步驟提取細菌DNA。ponA基因長度約2 500 bp,采用分段PCR擴增的方法。通過Genbank和NCBI查找鮑曼不動桿菌ponA基因序列,由上海生工公司合成引物序列。ponA-1上游引物序列為5′-CTCACTTCCGATGGGATTCTA-3′,下游引物序列為5′-TTGATGGTAGAACCTGGCTGA-3′,產物長度1 320 bp;ponA-2上游引物序列為5′CAAATGAAGCTAAAACTGCGTG-3′,下游引物序列為5′-AGGTGTTGTCTTGGAAGGAATC-3′,產物長度1 265 bp。反應條件:預變性95 ℃ 3~5 min,變性94 ℃ 30 s,退火55~60 ℃ 25~30 s,延伸72 ℃ 30~50 s,共35個循環。PCR產物取5 μL的1%瓊脂糖凝膠電泳,電泳參數:150 V,100 mA,10~20 min。

表1 19株MDR-AB耐藥情況
1.2.2 基因測序分析 將目的PCR條帶切膠回收,送上海生工公司進行測序分析(3730XL測序儀,美國ABI公司)。根據所測得基因序列,經用DNAMAN軟件拼接成ponA基因全長序列,通過Chromas軟件讀取,作BLAST Search比對。對照抗生素敏感株(SDF)為鮑曼不動桿菌SDF(NC_010400.1),ponA基因序列下載自基因組數據庫(www.biocyc.org)。
1.2.3 耐藥菌株與SDF ponA編碼蛋白結構比較 將耐藥株與SDF ponA基因翻譯的氨基酸序列遞交給Swiss-Model Workplace進行同源建模(模板為PDB.3udi亞單位),用分子可視化工具軟件Swiss-Pdb Viewer4.0作結構相似性分析。
1.3 碳青霉烯類抗生素誘導后MDR-AB的ponA基因表達及突變觀察
1.3.1 碳青霉烯類抗生素誘導 將冷凍保存的19株耐藥菌株解凍后轉入5 mL的營養肉湯中置于35 ℃過夜復蘇,肉湯接種于哥倫比亞血瓊脂平板(CBA),于35 ℃培養18~24 h,待生成典型的“珍珠樣”菌落。從CBA平板上挑取單個菌落洗脫至10 mL的LB液體培養基中35 ℃振蕩培養16~18 h至對數生長期,取菌液5 mL轉入12孔細菌培養板中。分別加入碳青霉烯類抗生素(亞胺培南、美羅培南、多利培南)誘導,調整抗生素最終濃度為1 mg/L,誘導時間1 h。將菌液吸入離心管,15 000 r/min離心10 min棄去上清液,收集細菌。
1.3.2 ponA檢測 采用qRT-PCR法檢測誘導前后MDR-AB中的ponA mRNA。將誘導前后的菌液使用生理鹽水制成懸液,使用比濁儀調節濁度至2 McF。按試劑盒操作說明書提取菌株RNA。取模板5 μL加入反應體系及引物,總體積為20 μL,在PCR儀上進行擴增。內參基因為16s RNA,上游引物序列為5′-CAGCTCGTGTCGTGAGATGT-3′,下游引物序列為5′-CGTAAGGGCCATGATGACTT-3′。反應條件為42 ℃逆轉錄1 h,95 ℃預變性1 min,94 ℃變性30 s,56 ℃退火20 s,72 ℃延伸30 s,80 ℃收集熒光8 s,共設定35個循環。以2-ΔΔCt表示目的基因相對表達量。
1.3.3 ponA基因測序 提取細菌DNA,通過PCR擴增、瓊脂糖電泳檢測、膠回收等步驟,對擴增的PCR產物進行測序,委托上海生工公司完成。測序結果以DNAman軟件進行分析。
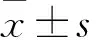
2 結果
2.1 MDR-AB中ponA基因表達及突變情況
2.1.1 基因表達情況 19株菌均表達ponA基因。部分菌株凝膠電泳結果見圖1、2。

注:1~9泳道分別為編號1~9菌株。

注:1~9泳道分別為編號1~9菌株。
2.1.2 基因測序分析結果 ponA基因測序結果與Genbank中ATCC 17978標準菌株ponA(登錄號為CP000521.1)序列進行比較,結果顯示98%同源(圖3)。

圖3 ponA基因測序結果(部分)
2.1.3 ponA編碼蛋白構象分析結果 19株MDR-ABponA基因序列基本一致,選取菌株MDR-AB-1為研究對象,將MDR-AB-1株的ponA基因序列翻譯成氨基酸序列,與SDF株序列相比較,發現存在4處氨基酸變異,為第23位絲氨酸>丙氨酸、第47位丙氨酸>天冬氨酸、第110位異亮氨酸>亮氨酸、第128位谷氨酸>天冬氨酸。將翻譯成的氨基酸序列遞交給Swiss-Model Workplace進行同源建模,Swiss-Pdb Viewer4.0軟件分析顯示,MDR-AB-1菌株ponA編碼蛋白的空間結構(深色)與SDF菌株(淺色)存在明顯差異(圖4)。
2.2 碳青霉烯類抗生素誘導后MDR-AB的ponA基因表達及突變情況 亞胺培南組、美羅培南組、多尼培南組和未處理組ponA基因相對表達量分別為0.56±0.13、0.78±0.15、0.72±0.21、1.02±0.01,亞胺培南組、美羅培南組、多尼培南組ponA基因相對表達量均低于未處理組(P均<0.05)。用DNAMAN軟件對碳青霉烯誘導前后的菌株ponA基因測序序列進行比對分析,結果未發現有基因突變菌株。

圖4 MDR-AB-1株與SDF株ponA編碼蛋白構象比較
3 討論
鮑曼不動桿菌是一種臨床常見的革蘭陰性菌,在我國各級醫院臨床標本中的分離率逐年增加。鮑曼不動桿菌不僅對多種青霉素類及頭孢菌素類抗生素天然耐藥,而且在使用敏感藥物治療過程中極易產生獲得性耐藥,導致可用于臨床治療的抗生素種類越來越少。根據近年相關文獻報道,鮑曼不動桿菌對包括碳青霉烯類在內的幾乎所有抗生素耐藥率均保持上升趨勢,對常用青霉素類及頭孢類抗生素耐藥率為80%~99%,對碳青霉烯類及一些新型復合制劑耐藥率也在20%~50%,僅對多黏菌素及米諾環素有較敏感(耐藥率在10%以下)。2017年CHINET結果顯示,鮑曼不動桿菌碳青霉烯類藥物耐藥率為70.5%,在有些省份甚至大于80%[5]。
PBPs是位于細菌細胞膜上的膜蛋白,具有轉肽酶、羧肽酶和轉糖基酶活性,參與細菌肽聚糖生物合成的末端反應、形態維持和糖肽結構的調整等功能,在細菌生長繁殖過程中起重要作用[6,7]。根據它們在SDS-PAGE中的分子質量、氨基酸序列及細胞功能分為兩組[8],即高分子量(HMM)和低分子量(LMM)的PBP。而HMM PBP又可分為A型和B型,A型是一類具有雙重酶活性的PBPs,其N末端具有糖基轉移酶的活性,C末端具有肽基轉移酶的活性;B型僅具有肽基轉移酶的活性,但其一定程度上可以維持細胞形態。研究發現,β-內酰胺類抗生素主要與HMM PBPs結合而抑制酶活性從而殺死細菌[9,10]。
鮑曼不動桿菌PBPs表達異常是其產生耐藥性的主要原因之一[11~13]。目前的研究顯示,鮑曼不動桿菌含有7種PBPs,與耐藥相關的主要是PBP1a、PBP1b、PBP2、PBP3[3,14]。PBPs介導鮑曼不動桿菌耐藥的機制主要有兩個方面,一是PBPs編碼基因突變導致與β-內酰胺類的親和力降低,二是編碼PBPs的基因表達下調[15]。PBP1a作為β-內酰胺類抗菌藥物作用的靶點之一,在鮑曼不動桿菌耐藥機制中研究較少。本課題通過對鮑曼不動桿菌PBP1a編碼基因ponA進行研究,發現19株MDR-AB均攜帶ponA基因,檢出率100%。19株菌ponA基因測序發現,與SDF株相比,其翻譯氨基酸序列有4處存在差異,即第23位絲氨酸>丙氨酸、第47位丙氨酸>天冬氨酸、第110位異亮氨酸>亮氨酸、第128位谷氨酸>天冬氨酸。Swiss-Model Workplace同源建模更直觀地反映出耐藥株與SDF株PBP1a蛋白空間結構存在差異。這說明,MDR-AB的PBP1a結構與SDF株不同,這可能是其耐藥的一個重要因素。
近年來,不斷有研究發現,不同種類抗菌藥物在亞MIC濃度可影響細菌生物特性變化,包括耐藥性、毒力、運動力及生物膜形成等,最終使細菌的適應性更強[16,17]。由于在抗感染治療過程中,體內抗菌藥物分布不同,藥物濃度在亞MIC的階段不可避免,加上臨床高MIC值的耐藥菌(如MDR-AB)的大量出現,使得抗菌藥物處于亞MIC的時間更長,細菌更容易產生高耐藥。本實驗中19株菌在亞MIC濃度的亞胺培南、美羅培南、多尼培南誘導下,ponA基因表達均不同程度下降。誘導效果以亞胺培南最明顯。現已證實亞胺培南能夠在體外誘導鮑曼不動桿菌PBP基因(ponA、ftsI、dacC)異常表達[18],本實驗進一步證明美羅培南、多尼培南也能誘導ponA表達下調。三種碳青霉烯類抗生素誘導效果不同,可能是因為各自分子結構不同、主要靶點不同導致[19]。此前,有學者[20]通過對使用抗生素時間較長的肺炎鏈球菌PBP1a的序列和晶體結構進行分析發現,PBP1a存在突變熱點,此突變可導致PBP1a活性位點的極性和可達性改變。但是,本實驗中19株MDR-AB在碳青霉烯類抗生素誘導后并沒有發現ponA基因突變,可能是本實驗抗菌藥物誘導時間不夠長或碳青霉烯類誘導僅對ponA基因表達有影響,這需要進一步實驗論證。
總之,本實驗發現,MDR-AB攜帶ponA基因,ponA編碼氨基酸序列及蛋白構象均與SDF存在明顯差異。亞MIC濃度碳青霉烯類抗生素誘導可導致MDR-AB中ponA表達下調,細菌適應性增強,耐藥性增加。臨床治療鮑曼不動桿菌感染過程中應盡量避免亞MIC濃度的碳青霉烯類抗菌藥物的暴露,減少耐藥菌株的產生。

