油棕EgNAC33基因的克隆與逆境響應表達分析
周麗霞,曹紅星
(中國熱帶農業(yè)科學院 椰子研究所/海南省熱帶油料作物生物學重點實驗室,海南 文昌 571339)
當植物受到低溫、干旱及鹽堿等非生物逆境脅迫時,細胞會發(fā)生一系列的基因調控,產生一系列的逆境響應機制來適應逆境[1]。轉錄因子在基因調控過程中起到效應基因開關的作用,常見的轉錄因子,如WRKY、AP2、bZIP及NAC等[2-4],都在植物逆境響應過程中發(fā)揮調控作用,其中,NAC轉錄因子廣泛參與植物對逆境的響應過程。NAC轉錄因子的N端存在1個比較保守的NAC結構域,其C端有1個轉錄調控結構域,當接收到逆境脅迫信號后,NAC通過轉錄調控結構域來調控下游基因的表達[5]。
NAC轉錄因子最初是從矮牽牛分生組織中分離出來的[6],當缺少該基因時,葉片無法正常發(fā)育。近年來,隨著對NAC轉錄因子調控功能的不斷挖掘,發(fā)現NAC在植物生長發(fā)育、代謝衰老、植物對抗生物及非生物脅迫等多方面都起到表達調控的作用,如Kusano等[7]研究發(fā)現NAC在水稻根、莖和花的發(fā)育早期及水稻成熟韌皮部的維管束組織中均有所表達。Guo等[8]研究發(fā)現AtNAC基因在衰老葉片中的表達量上調,且過表達的AtNAC基因會加速葉片的衰老。Zhang等[9]發(fā)現當水稻受稻瘟菌侵染后,28個OsNAC基因的表達量上調,19個OsNAC基因的表達量下調。Ochiai等[10]在水稻中篩選出1個NAC基因Boronexcesstolerant1,該基因可以負調控水稻的耐硼毒性。Yokotani[11]發(fā)現水稻中至少有5個NAC基因在干旱及鹽脅迫中的表達量上調,SNAC1基因的過量表達會促進水稻葉片氣孔的關閉,減少水分流失,提高抗旱能力。Xue等[12]通過轉基因克隆小麥的TaNAC基因,發(fā)現該基因在干旱和低溫脅迫下的表達量上調,以提高小麥對環(huán)境的抗逆性。孫麗娟等[13]通過分析巨桉的基因EgrNAC1在低溫、干旱和高鹽脅迫下的表達量,發(fā)現該基因在上述3種非生物脅迫下的表達量均上調,該基因對這3種脅迫均會產生響應。
我國從馬來西亞、印度尼西亞等油棕傳統(tǒng)種植區(qū)引進油棕試種近90年,主要種植在海南、廣西等熱區(qū)。近年來,隨著棕櫚油消費量的增大,油棕的種植面積急需擴大,但我國冬季的低溫天氣嚴重限制了油棕的擴大種植,低溫是限制我國油棕產業(yè)發(fā)展的瓶頸之一,研究油棕EgNAC33基因的表達特征和功能,對油棕的抗逆尤其是抗寒育種具有重要意義。目前,關于油棕NAC基因受非生物脅迫誘導表達的研究鮮有報道。筆者借助分子技術,克隆了油棕的EgNAC33基因,應用生物信息學方法分析了其序列結構特征,通過熒光定量PCR方法檢測了該基因在低溫條件下被誘導表達的規(guī)律,同時初步探索了此基因對干旱及高鹽脅迫的響應,旨在為進一步的基因功能鑒定工作提供試驗依據,同時為油棕分子輔助育種提供候選基因。
1 材料與方法
1.1 試驗材料
供試油棕材料來自中國熱帶農業(yè)科學院椰子研究所油棕品種試種示范園。選取9株同一批培育、植株大小相近,長勢良好、莖高約45 cm的幼苗,將其分為3個重復,每個重復為3株,放入可控植物三色光培養(yǎng)箱中,進行8 ℃低溫(光照14 h/黑暗10 h)處理,分別在處理后1、4、8、24和48 h時進行葉片采樣;以28 ℃室外生長條件下的幼苗為對照組。分別用7、5、3、2和1 d不澆水的植株作為干旱處理組;以正常澆水組為對照組,進行葉片采樣。高鹽處理:將油棕幼苗置于不同塑料容器內,處理組容器中保持植株栽培盆1/2高度的300 mmol/L NaCl溶液,對照組則用清水保持同樣液面高度,并分別在處理后0、4、12、24、48及72 h時進行葉片采樣。取樣樣品均為幼苗的中間嫩葉,用液氮冷凍,用于RNA的提取。
主要試劑:大腸桿菌Escherichiacoli5α為湖南大學分子育種實驗室保存;T4 DNA連接酶、Taq DNA polymerase、RNA逆轉錄試劑盒購自海口瓊山萊客(海南)科技服務中心;克隆載體pGEM-T Easy Vector購自Promega公司; RT-PCR試劑盒、RACE試劑盒購自Invitrogen公司;熒光定量試劑盒[FastStart Universal SYBR Green Master (Rox)]購自羅氏公司;引物合成及測序由深圳華大基因科技服務有限公司完成。
主要儀器設備: Mx3000P型實時熒光定量PCR儀、SYNGENE GBOXHR 凝膠成像分析系統(tǒng)、三色光培養(yǎng)箱(LED-30HL1,美國)、超速冷凍離心機(Eppendorf Centrifuge 5810 R型,德國)、超微量核酸蛋白檢測儀(Thermo Nanodrop 2000)。
1.2 RNA的提取及cDNA的合成
采用Trizol法[14]提取油棕嫩葉的RNA。稱取約2 g油棕嫩葉,利用液氮將其研磨至粉末狀,置于2 mL EP離心管中,向管中加入1 mL RNA提取液,充分振蕩并靜置10 min;再向其中加入0.2 mL氯仿,充分振蕩混勻后靜置7 min;然后在4 ℃超速冷凍離心機中以10000 r/min離心10 min;吸取600 μL上清液至新的1.5 mL無RNase的離心管中,加入等體積冰凍的異丙醇,輕輕搖勻后冰上放置10 min,在4 ℃超速冷凍離心機上以10000 r/min離心10 min;去上清,加入1 mL 75%乙醇,在4 ℃超速冷凍離心機上以8000 r/min離心5 min;去上清,在超凈工作臺上靜置至酒精完全揮發(fā),加入20 μL RNase-free水,用槍頭吹打混勻得RNA。用1%瓊脂糖凝膠電泳檢測所提取RNA的完整性,利用超微量核酸蛋白檢測儀檢測RNA的純度及濃度。
取1 μL上述檢測過的質量和純度較好的RNA,應用海口瓊山萊客(海南)科技服務中心的RNA逆轉錄試劑盒進行cDNA合成。
1.3 EgNAC33基因的克隆和序列分析
首先,從GenBank數據庫中獲得NAC基因的編碼序列,通過Clustal X進行多序列比對,根據序列的保守性設計兼并性引物NAC-F:5′-GGACAAAGAATTGCTTAATGC-3′;NAC-R:5′-CACAACAGCTGAACTTGATATC-3′。以cDNA為模板進行PCR擴增,利用獲得的片段以T載體法克隆PCR產物,將陽性克隆送深圳華大基因科技服務有限公司進行測序。
根據RT-PCR片段的序列測定結果,合成RACE-PCR所需的特異引物GSP1:5′-CTGGTTTCCGTTTCCATCCC-3′;GSP2:5′-CGAACCGAGCAGCCAACA-3′,分別用于克隆cDNA的5′端序列和3′端序列,具體步驟均按RACE試劑盒說明書執(zhí)行;PCR產物回收后經T載體克隆、測序,并與已克隆的NAC基因編碼拼接,從而獲得全長cDNA序列。以拼接得到的基因全長cDNA設計引物NAC-F:5′-CTCAAAGATTAGAGGCTCCCC-3′;NAC-R:5′-AGTGATAAGCTCCTCGTCGGT-3′,通過PCR擴增和測序,驗證所獲基因全長的準確性。
1.4 EgNAC33基因的表達分析
應用實時熒光定量PCR考察EgNAC33基因在油棕葉片中的表達量變化情況,以Actin1為內參基因,引物為Actin1-F:5′-GTTGTCGCTCCACCCG-3′;Actin1-R:5′-GCAGGACCACATTCATCATA-3′[15]。應用Primer 5軟件設計EgNAC33基因的定量引物EgNAC33-F:5′-ACGCTTTCCGCGACACTG-3′;EgNAC33-R:5′-CCGGAGTGCCGTGAACAA-3′。定量PCR分別進行3個生物學重復和3個技術重復,反應體系為10 μL:5 μL FastStart Universal SYBR Green Master緩沖液、0.5 μL上引物(10 μmol/L)、0.5 μL下引物(10 μmol/L)、0.2 μL Rox、1 μL cDNA模板、2.8 μL ddH2O。反應條件為:95 ℃預變性10 min;95 ℃變性15 s,60 ℃復性30 s,72 ℃延伸20 s,共35個循環(huán)。
1.5 數據分析
應用SMART軟件預測EgNAC33的保守結構域;通過NCBI網站blast油棕EgNAC33與其他植物NAC蛋白序列的同源性;同時應用MEGA 6.06軟件構建油棕與其他植物NAC蛋白的進化樹,分析進化關系。
2 結果與分析
2.1 EgNAC33基因的克隆與測序分析
在RACE后通過拼接、驗證和再測序,獲得了1條NAC的全長cDNA序列,該序列大小約為1952 bp,含1個長約735 bp的開放閱讀框,可編碼245個氨基酸殘基。在NCBI網站上blast (http://blast.ncbi.nim.nih.gov/blast)對比后,發(fā)現該基因靠近N端的位置具有NAC保守結構域。將EgNAC33基因編碼的蛋白序列與其他植物的同源蛋白序列進行比對,結果如圖1所示,在不同植物間蛋白序列N端約11個氨基酸的同源性較低,第47~143氨基酸序列相對保守。通過分析不同植物間NAC基因的系統(tǒng)進化樹(圖2),發(fā)現大致分為2個亞族,其中油棕NAC33與CnNAC同源蛋白的親緣關系最近,其同源氨基酸相似度高達93%,且與椰棗和檳榔同屬1個亞族,該亞族中的植物均為木本植物;而擬南芥、大豆和花生作為草本植物聚類在一起,與其他木本植物的親緣關系較遠。在進化上,EgNAC33與CnNAC的親緣關系最近。

At為擬南芥;Cn為椰子;Gm為大豆;Os為水稻;Dp為椰棗;Ac為檳榔。圖1 油棕EgNAC33蛋白序列與其他植物同源蛋白序列的比對
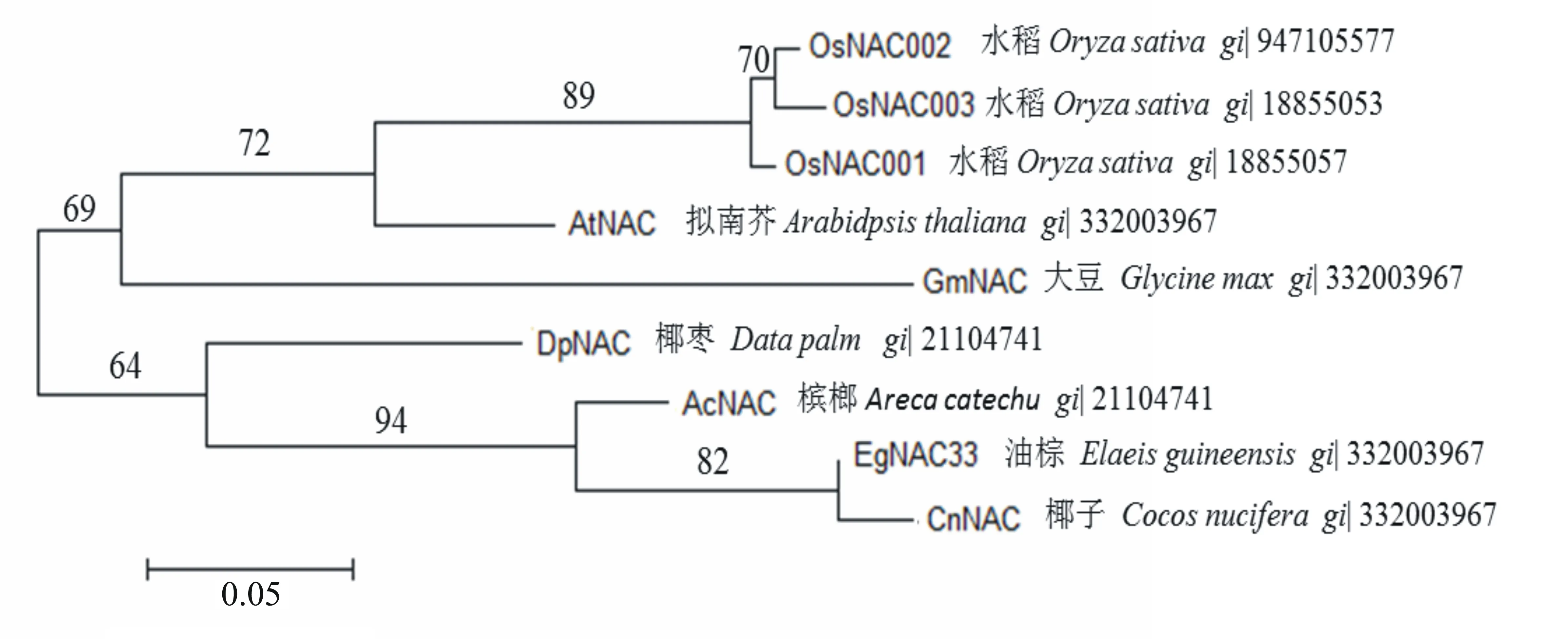
圖2 不同植物間NAC基因的進化樹分析
2.2 在低溫脅迫下EgNAC33基因的表達
由圖3可知,油棕幼苗經過8 ℃低溫處理后,EgNAC33在各時間點的表達明顯受到低溫誘導,且在各低溫脅迫時間點的相對表達量均比對照組的表達量高,顯示該基因受到了低溫脅迫的誘導。其中在低溫脅迫的0~8 h期間,EgNAC33的表達量逐漸變大,在8 h時其相對表達量達到最高水平;隨著低溫脅迫時間的增加,其表達量先降低,然后又增加;從整體上看,在8 ℃低溫條件下,EgNAC33的表達在不同處理時間下均被強烈誘導,與對照相比,該基因的表達量在1 h時即被誘導增加了4.42倍,在4 h時增加了7.83倍,在8 h時增加了9.88倍,在24 h時增加了2.91倍,在48 h時增加了5.98倍。由此可見,在不同的脅迫時間段內,EgNAC33基因的表達量存在一定的波動性。這說明EgNAC33基因參與了調控油棕的抗寒響應,但又體現了其對低溫脅迫響應調控的復雜性,一方面該基因的表達與溫度有關,另一方面,它還可能受到植物其他生理因子的影響[16]。

圖3 在低溫脅迫下EgNAC33基因的相對表達量
2.3 在高鹽脅迫下EgNAC33基因的表達
從圖4可以看出:油棕幼苗經過300 mmol/L NaCl溶液處理后,EgNAC33在各脅迫時間點的表達量明顯受到高鹽誘導,且在各脅迫時間點的相對表達量均高于對照組的表達量,初步表明該基因受到了高鹽脅迫的誘導。具體來說,在脅迫的0~24 h期間,EgNAC33的表達量逐漸變大,其中,在24 h時的相對表達量達到最高水平,高達4.3倍;隨著脅迫時間的延長,其表達量逐漸降低。由此可見,EgNAC33基因對高鹽脅迫做出了應答,參與了調控油棕的耐鹽機制。
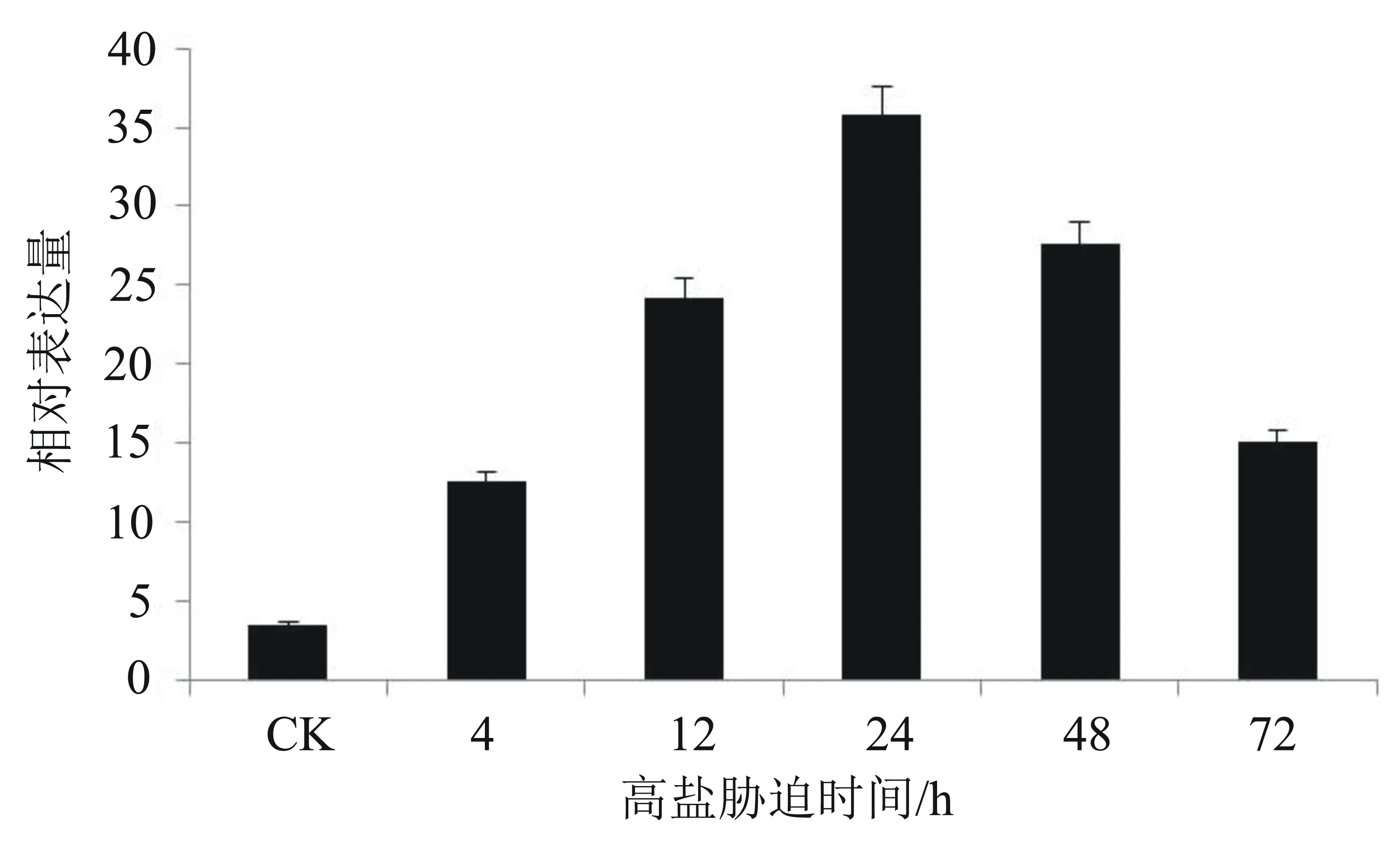
圖4 在高鹽脅迫下EgNAC33基因的相對表達量
2.4 在干旱脅迫下EgNAC33基因的表達
從圖5可以看出,在干旱脅迫條件下,在各時間點EgNAC33基因的相對表達量與對照組相比無明顯差異。推測EgNAC33不能被干旱脅迫誘導,該基因不參與干旱逆境的應答信號途徑。
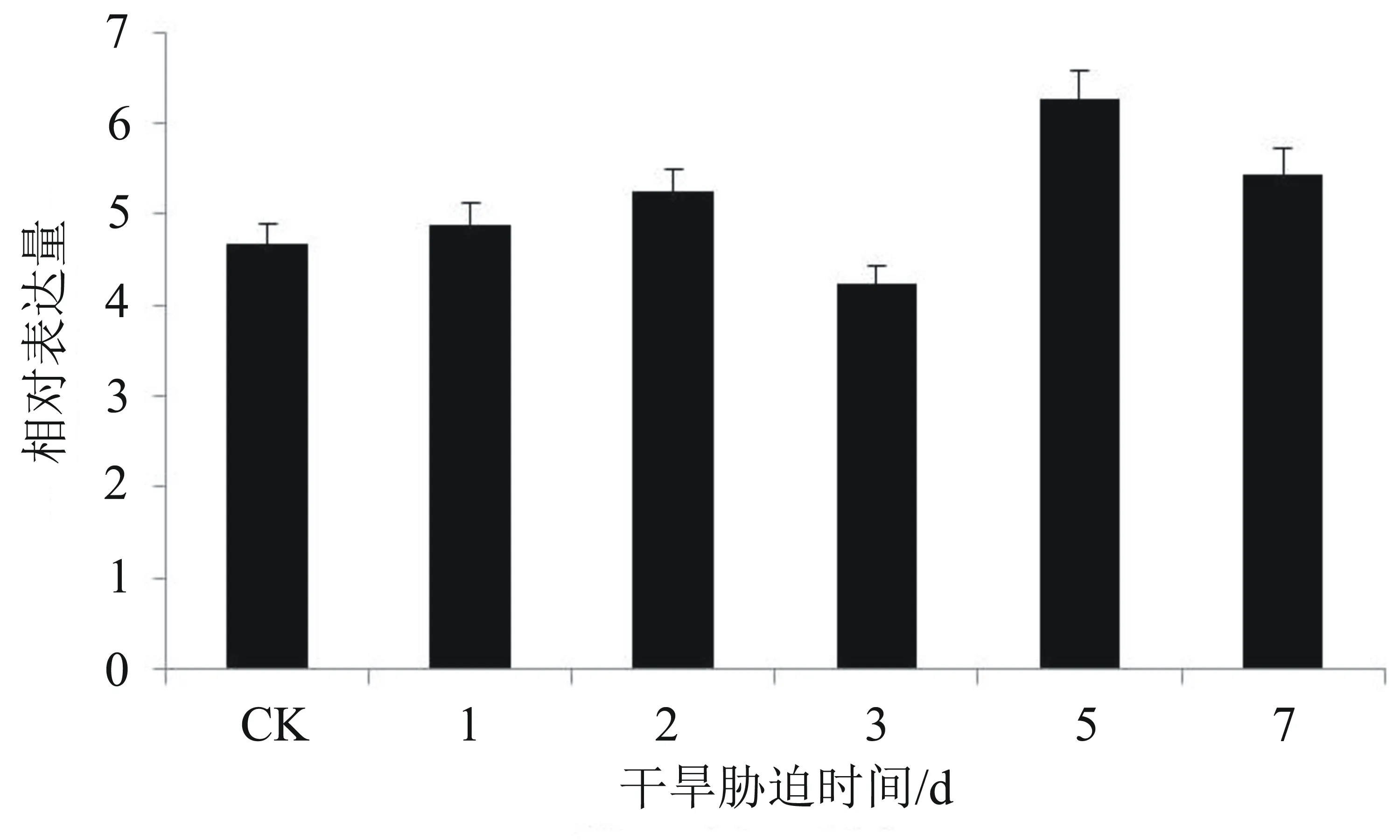
圖5 在干旱脅迫下EgNAC33基因的相對表達量
3 討論與結論
NAC基因家族是植物特有的一類轉錄因子,在植物生長發(fā)育中具有重要的調控作用,而且也參與植物對干旱、高鹽、低溫等非生物脅迫的抗逆反應,其中有20%~25%的家族成員參與至少1種以上逆境因子的響應[17]。本研究通過分析EgNAC33蛋白的生物信息學特性,發(fā)現EgNAC33基因的長度為1952 bp,含有1個長約735 bp的開放閱讀框,編碼245個氨基酸;EgNAC33蛋白質的N端具有NAC保守結構域;在系統(tǒng)進化上,該基因與椰子NAC的親緣關系最近,且與椰棗和檳榔同屬一個亞族。該結果表明棕櫚科植物中NAC蛋白的氨基酸序列具有高度的保守性。
很多研究表明,NAC基因受多種逆境因子的影響,并能啟動多個逆境反應調控途徑,參與植物的多種抗逆響應,例如:棉花的GhSNAC5和GhSNAC8基因會不同程度地被高鹽、干旱及黃萎病脅迫誘導[18];番茄的TNAC基因同時受高鹽和低溫逆境的誘導[19];大豆的GmNAC基因受鹽脅迫的誘導[21]。本研究發(fā)現,EgNAC33對干旱脅迫沒有明顯響應,但對低溫和高鹽脅迫均表現出典型的誘導表達效應,且在不同處理時間點均表現出誘導表達的特點,同時由EgNAC33介導的冷脅迫及高鹽脅迫響應與干旱脅迫響應途徑沒有交叉反應。
基因的表達調控是一個復雜的過程。本研究只初步考察了油棕受到低溫、高鹽及干旱脅迫時EgNAC33基因的表達量變化,雖然可以為研究NAC基因家族調控油棕抗逆反應機制提供一定的試驗依據,但對該基因家族的具體表達調控機制及其在油棕對抗外界脅迫時發(fā)揮的具體作用還需更深入的探索。

