鋅指抗病毒蛋白抑制HEV體內復制
紀漢斌,何秋霞,龔石林,王文靜,龍飛燕,楊臣臣,禹文海,黃 芬
戊型肝炎病毒(Hepatitis E virus,HEV)屬肝炎病毒科,正肝炎病毒屬,是一種經腸道傳播的病毒性肝炎病原體[1-2]。HEV是一種單股正鏈RNA病毒,基因組大小約為7.2 kb,包含3個開放式閱讀框架(Open reading frames,ORFs)[3]。ORF1編碼病毒復制相關的結構蛋白;ORF2編碼病毒衣殼蛋白;ORF3與ORF2部分重疊,與病毒顆粒的釋放有關。其5′非翻譯區(UTR)被7-甲基鳥嘌呤覆蓋,3′ UTR以多聚(A)尾巴結束[4]。HEV感染是世界范圍內肝病發生的主要原因之一。據WHO報道,全球每年約有2 000萬人感染HEV,約7萬人死亡,其中東南亞地區HEV感染率和死亡率占全球的60.6%和64.7%[5]。近年來,我國戊型肝炎發病率持續上升,已成為戊型肝炎的高發國家[6]。
由于HEV缺乏有效的培養模型,目前HEV尚無有效的治療藥物。臨床治療主要采用利巴韋林(ribavirin,RBV)和聚乙二醇干擾素(pegylated interferon alpha,peg-IFN)。RBV在腺苷酸激酶作用下被磷酸化為5′-單磷酸利巴韋林(PRV)。PRV抑制次黃嘌呤磷酸脫氫酶(IMPDH),從而使宿主細胞內鳥嘌呤核苷酸的水平降低,進而發揮抗病毒作用[7]。此外,長期大劑量服用RBV極易導致患者產生貧血等副作用[8-10]。IFN-α是治療慢性乙肝和丙肝的常用藥,在天然免疫反應中發揮重要作用[11-12]。它能夠通過激活干擾素誘導基因(interferon-stimulated gene, ISG)表達,抑制HEV復制[13-15]。但IFN-α治療會使患者出現外周血白細胞和血小板減少等不良反應,增加腎臟移植接受者急性排斥反應風險[16-17]。目前,RBV和IFN-α聯合使用在能在一定程度上治療慢性戊型肝炎。然而,對于大部分患者聯合用藥的療效有限,治療周期長,毒性較大,其有效性和安全性仍有待研究[18]。
先天性免疫是機體防御病毒入侵的第1道防線。病毒入侵機體后可被細胞的模式識別受體(pattern-recognition receptors,PRRs)識別,刺激機體產生干擾素和白介素等物質,從而消滅病毒[19-24]。宿主限制因子有潛在的抗病毒活性,例如: Trim5α和APOBEC3G都會通過特定的方式在HIV復制階段阻斷HIV復制[25-26]。2002年高光俠等人發現了一種重要的宿主限制因子:鋅指抗病毒蛋白(zinc finger antiviral protein,ZAP),ZAP參與天然免疫干擾素途徑,是PRRs中的一員,能夠識別并消除細胞質內的病毒RNA[27-28]。ZAP作為反式作用因子,直接作用于病毒RNA中的ZAP敏感元件(ZAP-responsive element, ZRE),利用細胞poly(A)特異性核酸酶(poly(A)-specific ribonuclease,PARN)切除病毒的poly(A)尾,從而利用RNA外切酶加工復合體exosome降解病毒RNA[27, 29-31]。ZAP還能利用輔因子RNA解螺旋酶p72招募細胞脫帽復合體Dcp1/2去除病毒5′帽子結構,從而利用5′外切酶XrnI降解病毒RNA[32]。這表明ZAP在病毒感染的先天防御中發揮著重要作用。
目前已經證實ZAP能夠抑制逆轉錄病毒、絲狀病毒、嗜肝DNA病毒和披膜病毒的復制[27, 33-35],但ZAP與HEV的關系尚不清楚。本實驗經BALB/c小鼠尾靜脈注射ZAP真核表達質粒,過表達ZAP后接種HEV,結果表明ZAP抑制HEV的復制,為HEV的預防與治療提供新的方法和思路。
1 材料與方法
1.1細胞、毒株和質粒 基因Ⅳ型HEV(strain KM01,GenBank No.KJ155502)(1×104copies/mL)、18T-ZAP、pcDNA3.1-N1以及pcDNA3.1-ZAP均由昆明理工大學病毒感染與免疫實驗室提供。
1.2主要試劑 限制性內切酶、T4 DNA連接酶、 MLV逆轉錄試劑、DNA marker DL15000 購自寶生物工程(大連)有限公司;DNA 聚合酶和 dNTP 購自天根生化科技(北京)有限公司;Trizol購自美國 Invitrogen 公司;質粒小量快速提取試劑盒和 DNA 膠回收試劑盒購自北京莊盟生物技術有限公司; HEV ORF2抗體購自美國Millipore公司(MAB8003); ZAP多克隆抗體購自美國 Proteintech 公司;HRP 標記的山羊抗兔和山羊抗小鼠的 IgG購自北京天德悅公司。
1.3引物設計及合成 根據GenBank中ZAP的基因序列(GenBank No.BC025308),經Oligo軟件分析設計引物,序列如下,上游5′-CGGATCCG atggcggacccggaggtgtgc,下游5′-CAAGCTTG gtaga-gtttactgagcagttc,擴增片段大小約為2 740 bp,引物由上海捷瑞生物工程有限公司合成。
1.4RT-PCR擴增ZAP片段 以5 μL 的18T-ZAP為模板,RT-PCR擴增ZAP基因,PCR擴增條件為:94 ℃ 3 min,94 ℃ 30 s;50 ℃ 30 s;72 ℃ 3 min 共35個循環,72 ℃ 10 min。擴增產物用1%瓊脂糖凝膠電泳鑒定,用DNA膠回收試劑盒進行片段回收,得到擴增的ZAP片段。
1.5真核表達質粒pcDNA3.1-ZAP的構建 將pcDNA3.1載體和ZAP的RT-PCR 產物分別經BamH I和Hind III雙酶切,膠回收載體和目的基因,以T4 DNA 連接酶16 ℃連接過夜,反應體系如下:pcDNA3.1載體骨架(200 ng/μL) 5 μL,目的片段(100 ng/μL)12 μL,10× T4 DNA Ligase Buffer 2 μL,total 20 μL。利用大腸桿菌DH5α感受態細胞轉化,篩選陽性克隆,提取質粒。質粒用BamH I和Hind III雙酶切鑒定,并送至生工生物工程(上海)股份有限公司測序,測序正確的質粒命名為pcDNA3.1-ZAP。pcDNA3.1-ZAP示意圖見圖1。
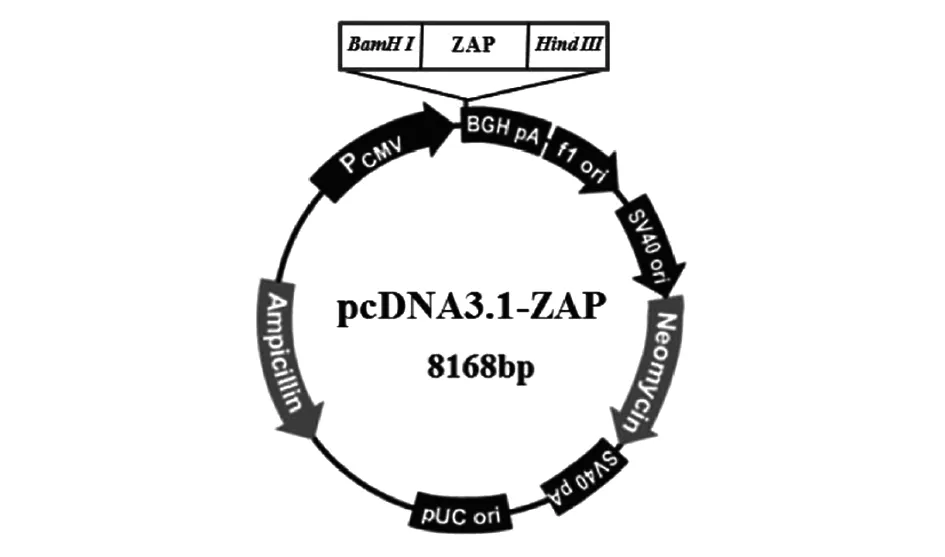
圖1 pcDNA3.1-ZAP載體圖譜Fig.1 pcDNA-ZAP vector map
1.6ZAP抵抗HEV復制的體內實驗 將BALB/c小鼠分為6組,共18只,每組3只。對其中4組(G1、G2、G3和G4)分別尾靜脈注射不同濃度pcDNA3.1-ZAP質粒(20 ng、40 ng或60 ng)或pcDNA3.1-N1質粒(60 ng)。24 h后,對以上4組接種200 μL HEV病毒懸液。剩余兩組分別設置為HEV單純感染組G5(接種200 μL HEV病毒懸液)和正常對照組G6(Mock)。HEV感染24 h后,對各組小鼠進行安樂處死,采血并收集肝臟組織。
1.7HEV RNA的提取及RT-qPCR檢測 取小鼠血清200 μL,利用 Trizol 試劑盒提取細胞總RNA,按照MLV逆轉錄試劑盒說明書進行逆轉錄合成cDNA。以cDNA為模板進行RT-qPCR檢測,反應體系為:cDNA 2 μL、2× ChamQ SYBR Color qPCR Mix 5 μL及上下游引物各0.2 μL,ddH2O補齊至10 μL。反應條件為:95 ℃ 3 min,95 ℃ 10 s;60 ℃ 31 s共40循環。內參基因(GAPDH)用作對照。目的基因的差異表達倍數采取2-△△Ct法進行相對定量分析。
1.8免疫組化 將保存于4%多聚甲醛中的小鼠肝臟組織進行石蠟包埋、切片、脫蠟、脫水、乙醇復水和Tris-EDTA修復。3% H2O2室溫孵育10 min;5%脫脂奶封閉30 min;HEV(ORF2一抗1∶200,4 ℃孵育過夜,鼠HRP二抗,1∶250,37 ℃孵育1 h)。ZAP(ZAP一抗1∶200, 4 ℃孵育過夜,兔HRP二抗,1∶250,37 ℃孵育1 h),DAB染色,蘇木精染色8 min,1%鹽酸乙醇分化8 s,0.5%氨水反藍8 s,脫水,中性樹膠封片后顯微鏡下觀察。
1.9統計分析 使用Image-Pro Plus 6.0 (IPP) 軟件進行積分光密度分析。采用GraphPad Prism 5.01軟件進行統計分析。采用Student-t檢驗分析兩組間的差異。P<0.05為差異有統計學意義。
2 結 果
2.1ZAP片段的擴增 以18T-ZAP為模板進行RT-PCR體外擴增,將擴增產物經1%瓊脂糖凝膠電泳分析,在2 740 bp左右出現特異性條帶。結果表明,ZAP目的片段擴增成功,見圖2。
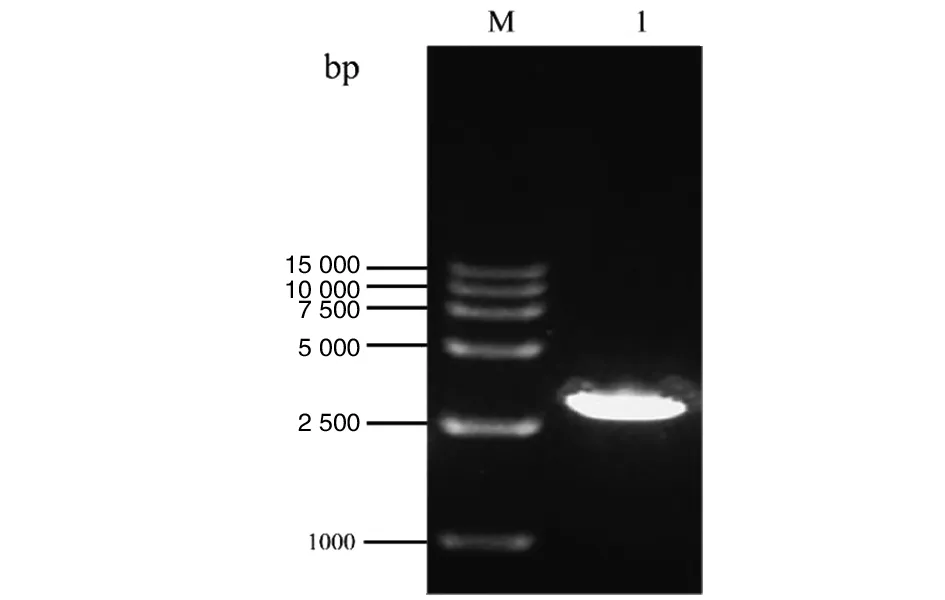
M為15000 marker;1為PCR擴增ZAP目的片段圖2 RT-PCR擴增ZAP目的片段Fig.2 RT-PCR products of ZAP target fragment
2.2真核表達質粒pcDNA3.1-ZAP的構建及鑒定 將ZAP目的片段進行膠回收,經連接轉化后挑選陽性菌落,擴大培養后提取質粒。瓊脂糖凝膠電泳鑒定結果顯示質粒提取成功。將真核表達質粒pcDNA3.1-ZAP采用BamH I和Hind III雙酶切鑒定,可見2 740 bp的目的片段,與預期結果一致,見圖3。
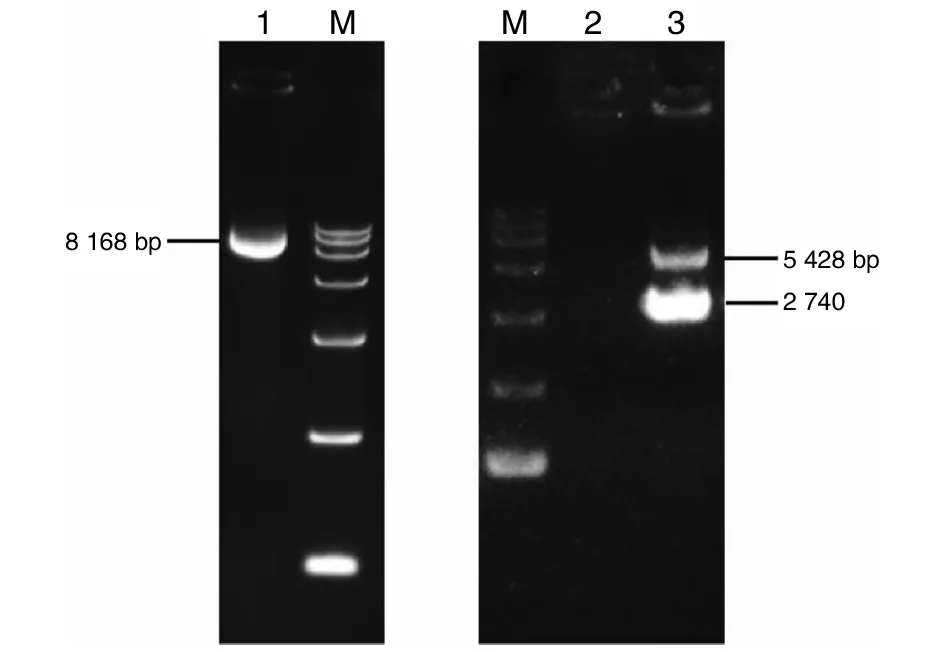
M為15000 marker;1為未酶切pcDNA3.1-ZAP質粒;2為空白對照;3為pcDNA3.1-ZAP質粒雙酶切產物圖3 真核表達質粒雙酶切產物的鑒定Fig.3 Identification of pcDNA3.1-ZAP eukaryotic expression vector
2.3ZAP在BALB/c小鼠體內成功過表達 為了驗證BALB/c小鼠注射pcDNA3.1-ZAP質粒后體內ZAP能否成功過表達,通過免疫組化檢測小鼠肝臟組織中ZAP的表達,并進行積分光密度分析。結果表明,與正常對照組 G6相比,注射pcDNA3.1-ZAP后小鼠肝臟中ZAP表達升高5.8倍(t=29.47,P=0.001 1<0.05),表明ZAP過表達成功,見圖4和圖5。
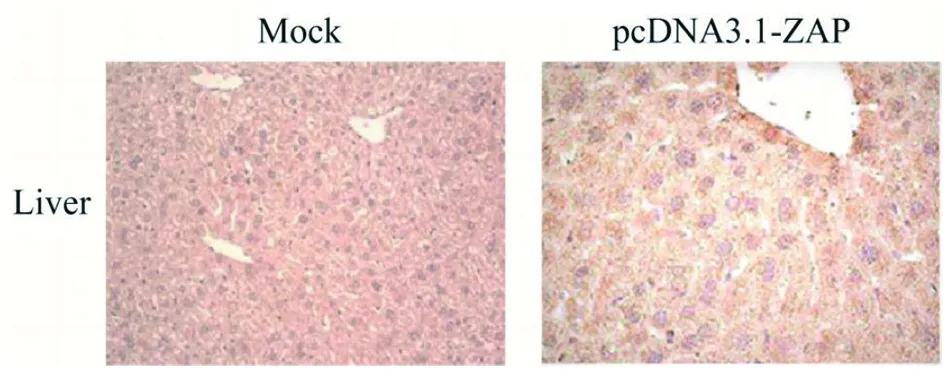
圖4 免疫組化檢測ZAP的變化Fig.4 Detection of ZAP by Immunohistochemical
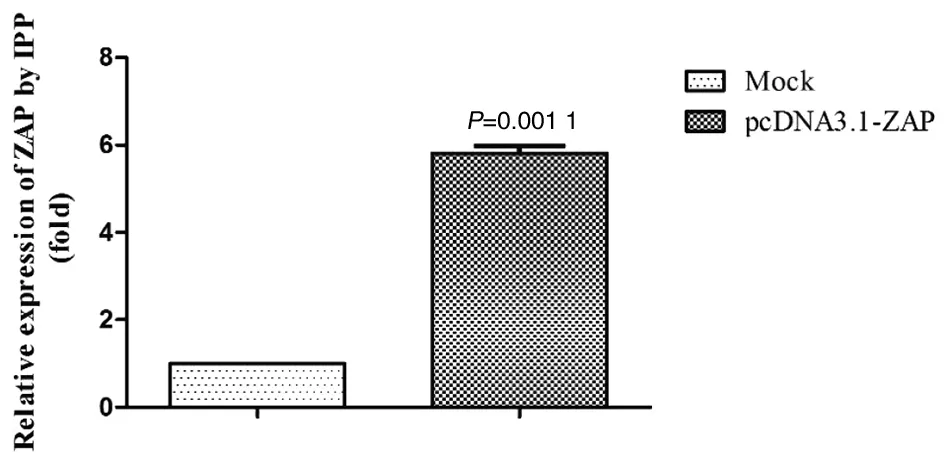
圖5 積分光密度分析ZAP表達的變化Fig.5 Change of ZAP expression by Integral Optical Density Analysis
2.4ZAP抑制BALB/c小鼠體內HEV復制 為了探究ZAP對HEV復制的影響,我們對BALB/c小鼠注射pcDNA3.1-ZAP質粒,24 h后接種HEV,感染后24 h對小鼠肝臟進行免疫組化檢測及積分光密度分析。結果顯示,與HEV單純感染組G5相比,小鼠體內過表達ZAP后肝臟中HEV陽性顆粒數降低82%(t=23.44,P=0.001 8<0.05),見圖6和圖7,說明ZAP能夠抑制體內HEV的復制。
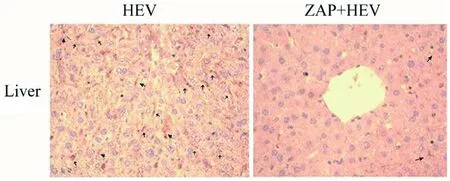
圖6 免疫組化檢測HEV的變化Fig.6 Detection of HEV by Immunohistochemical
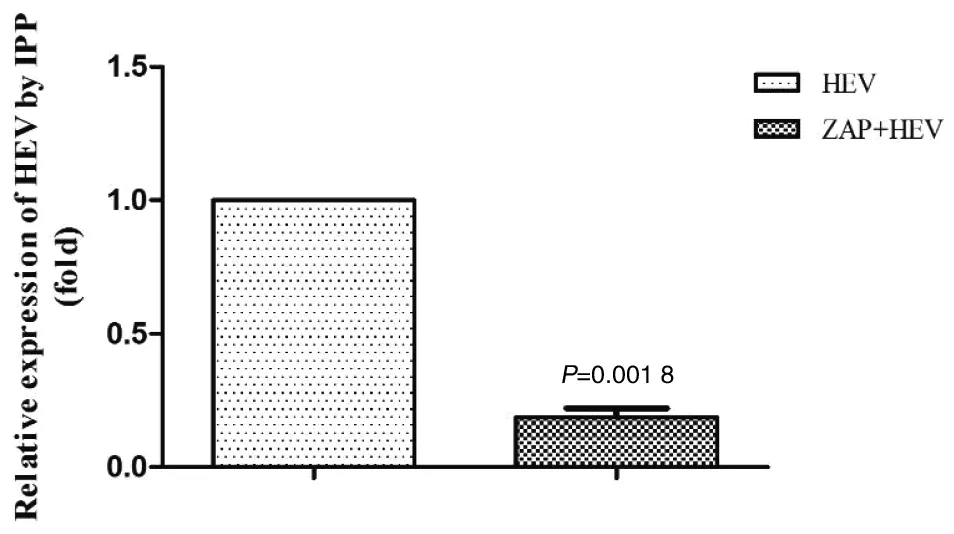
圖7 積分光密度分析HEV表達的變化Fig.7 Change of HEV expression by Integral Optical Density Analysis
為進一步驗證ZAP對HEV復制的影響,我們對BALB/c小鼠分別注射不同濃度的pcDNA3.1-ZAP質粒,24 h后接種HEV,感染后24 h對小鼠血清中HEV進行定量分析。結果表明,與單純注射HEV和注射了pcDNA3.1-N1的小鼠相比,注射pcDNA3.1-ZAP的小鼠能夠抑制HEV在血液中的復制,見圖8。且隨著ZAP濃度增加,HEV在血液中的拷貝逐漸降低,說明ZAP對HEV的抑制效果與劑量相關。
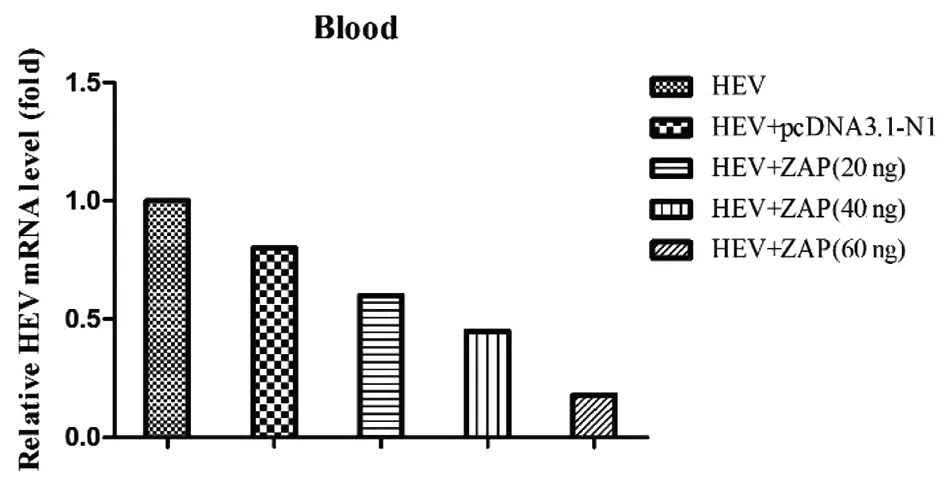
圖8 RT-qPCR檢測HEV的變化Fig.8 Detection of HEV by RT-qPCR
3 討 論
HEV是全球腸道傳播病毒性肝炎的主要病因。本研究證明了ZAP在體內具有抗HEV的作用。ZAP最初是作為表達抗莫洛尼氏鼠白血病病毒(Moloney Murine Leukemia Virus,MMLV)復制蛋白而分離出來的,包含4種CCCH型鋅指結構,與負調控RNA穩定性的RNA結合蛋白功能相似[36-37]。ZAP可能直接與病毒RNA相互作用,影響其穩定性。ZAP還可能通過影響蛋白-蛋白或核酸-蛋白相互作用,進而影響病毒復制。
ZAP的抗病毒活性部分取決于病毒基因組中ZREs的存在,其作為宿主抗病毒因子,可通過降解病毒mRNA或抑制病毒mRNA的翻譯,從而抑制病毒在細胞質中的積累來阻止獼猴輪狀病毒和委內瑞拉馬腦炎病毒的復制,并能夠通過靶向L基因序列抑制埃博拉病毒的復制活性。但ZAP不具備廣譜抗病毒活性。它不能抑制黃熱病病毒、泡狀口炎病毒和單純皰疹病毒1型。Stefanie 等人的研究表明,ZAP在細胞質中發揮作用,僅在細胞質中復制的RNA病毒會受ZAP影響[34-35]。而本研究結果表明,HEV作為胞質中復制的RNA病毒,其在小鼠體內的復制能被ZAP顯著抑制。這可能也是通過抑制HEV的mRNA水平實現的。
與逆轉錄病毒、絲狀病毒、嗜肝DNA病毒和披膜病毒不同的是,HEV很難在體外成功培養,致使抗戊型肝炎病毒藥物的研制受阻。2011年,一種針對戊型肝炎病毒的重組基因疫苗(p239)在中國上市[38]。 但p239疫苗是針對基因1型HEV設計,但中國目前主要以基因4型為主,p239是否能達到有效的保護作用,還有待進一步的觀察。 目前,尚無有效治療HEV的藥物。臨床常用的RBV和IFN不適用于器官移植患者,會導致患者嚴重貧血和并發性腎功能損傷。并且RBV對胎兒有致畸性,且會導致大量HEV耐藥株(G1634R突變株)產生[8-10, 40-41]。因此,RBV和IFN治療范圍有限,對慢性肝病及免疫力低下患者的長期療效和安全性仍有待進一步臨床確認。
ZAP作為一種天然宿主抗病毒蛋白,不僅易于表達,且能夠靶向作用于病毒基因組,在轉錄和翻譯水平抑制病毒復制,在天然免疫抗病毒過程中起到了至關重要的作用。本研究已證實ZAP能夠有效抑制HEV在動物體內的復制,為今后實現ZAP有效治療HEV提供了重要的前期基礎。
綜上所述,ZAP在機體抗HEV感染過程中發揮著重要作用。這表明ZAP可成為抗HEV藥物開發的靶標,突出開發靶向作用HEV基因組藥物的重要性。為有效治愈孕婦、免疫缺陷患者及其他脆弱人群提供可能,以及為進一步研究宿主與HEV相互作用機制提供實驗基礎及為篩選抗HEV新型藥物提供新思路。
利益沖突:無

