miR-381靶向HMGB1抑制子宮內膜癌細胞增殖、侵襲和遷移
趙臨瀟,于東升,劉 希,王 雷,左博云
(1.延安大學咸陽醫院 病理科,陜西 咸陽712000;2.西安交通大學第一附屬醫院 病理科,陜西 西安710000)
子宮內膜癌(endometrial cancer,EC)是常見的婦科癌癥,好發于絕經后婦女,以陰道異常出血和絕經后出血為癥狀,大多數患者可在早期被診斷,預后良好,5年生存率可達80%-85%[1,2];隨著人們生活方式的改變,在肥胖和高血糖等因素影響下,子宮內膜癌的發病率越來越高,也更趨于年輕化[3]。外科手術是EC治療的主要手段,包括子宮切除術、雙側輸卵管及卵巢切除術和淋巴結切除術等,主要取決于子宮頸、卵巢及淋巴結累及程度[2-4]。微小RNA(MicroRNA,miR)是一類在真核細胞中均存在的、內源性、非編碼小RNA分子,能負性調控基因表達,進而參與細胞增殖、凋亡、癌變等生物過程[5,6]。既往研究表明,在多種腫瘤組織中,miR-381表達水平明顯降低,如乳腺癌、胃癌、膠質瘤和乳頭狀甲狀腺癌[7-10]。高遷移率族蛋白B1(high mobility group box 1,HMGB1)在腫瘤組織中高表達,能降低癌細胞的放療敏感性,增加腫瘤細胞的增殖和遷移能力[11-12]。但miR-381與HMGB1的關系及兩者對EC的作用鮮有報道。本研究通過上調子宮內膜癌細胞中miR-381表達水平,探討其對細胞增殖、侵襲和遷移的影響,擬為EC的靶向治療提供實驗依據。
1 材料與方法
1.1 主要材料
正常子宮內膜細胞株EM-E6/E7/TERT和子宮內膜細胞癌細胞(Ishikawa、KLE、AN3CA、HEC1A和RL95-2)均購自美國典型培養物保藏中心;胎牛血清(貨號:10437028)、DMEM(貨號:11965092)、DEME/F-12(貨號:11320082)和MEM培養基(貨號:11575032)均購自美國Gibco公司;實驗所用引物購自上海生工;CCK8試劑盒(貨號:C0037)購自碧云天生物技術公司;Trizol(貨號:10296028)總RNA提取試劑盒購自美國Invitrogen;E-cadherin(貨號:14472)、N-cadherin(貨號:4061)、Vimentin(貨號:3932)、Ki67(貨號:9449)、PCNA(貨號:2586)、基質金屬蛋白酶-2 (metalloproteinase-2,MMP-2)(貨號:4022)、MMP-9(貨號:3852)一抗購自美國Cell Signaling Technology,二抗(貨號:ab40772、ab18203、ab92547、ab197234、ab29、ab37150、ab38898)購自英國Abcam;Transwell小室(貨號:3477)購自美國Costar公司。
1.2 實驗方法
1.2.1細胞培養
將5種子宮內膜癌細胞和正常子宮內膜細胞株分別培養在含有10%胎牛血清的培養基中,在37 ℃、含5% CO2的恒溫細胞培養箱中培養。一般2天更換1次培養液,當細胞融合度達到80%時可進行傳代。
1.2.2細胞轉染
接種細胞待細胞融合至90%,利用Lipofectamine 2000進行轉染。細胞在含有10%血清的培養基中于37 ℃、5% CO2條件下培養2 d進行后續實驗。
1.2.3實時定量PCR(Quantitative real-time reverse transcription PCR,qRT-PCR)收集細胞,采用Trizol法提取細胞總RNA,并反轉錄合成cDNA,之后進行qRT-PCR。反應程序:95 ℃預變性30 s,95 ℃變形10 s,60 ℃退火30 s,35個循環。以β-actin 為內參,按照2-ΔΔCT法計算相對表達量。引物序列見表1。

表1 qRT-PCR的引物序列
1.2.4熒光素酶報告實驗
采用生物信息學預測軟件TargetScan檢測發現miR-381和HMGB1存在連續的結合位點,再將HMGB1上該結合位點片段進行擴增,隨后克隆至熒光素報告酶載體pcDNA中,構建HMGB1野生型(WT)質粒。再利用基因位點突變技術將結合位點片段中部分核苷酸進行突變,構建HMGB1突變型(MUT)質粒。
將細胞分為4組(HMGB1 WT組、HMGB1 WT+miR-381 mimic組、HMGB1 MUT和HMGB1 MUT+miR-381 mimic組),作相應轉染48 h后,根據試劑盒說明書裂解細胞并測定熒光素酶活性。
1.2.5細胞計數試劑盒(cell counting kit-8,CCK-8)檢測細胞增殖能力
將細胞分為4組(HEC1A組、miR-381 mimc組、pc-HMGB1組和mimic+pc-HMGB1組),作相應轉染后分別培養24、48和72 h,再加入CCK-8溶液,于37 ℃恒溫培養箱中繼續培養4 h,最后檢測450 nm處吸光值(A),計算細胞增殖倍數。以HEC1A細胞增殖的倍數來表示其它各組細胞增殖能力。
1.2.6Transwell實驗
將1×105個細胞接種于Transwell 小室上層,加入無血清培養基,在小室下層加入含20%胎牛血清的培養基作為化學誘導物,細胞分成4組(HEC1A組、miR-381 mimc組、pc-HMGB1組和mimic+pc-HMGB1組),于37 ℃、5% CO2的恒溫細胞培養箱中孵育24 h。取出Transwell小室用棉簽小心拭去基質膠及上室細胞,4%多聚甲醛固定10 min,結晶紫室溫染色25 min。顯微鏡下選5個視野進行拍照計數,計算平均每個視野的細胞數。
1.2.7細胞劃痕實驗
將1×105個細胞接種于培養板中,當細胞融合度達到90%時,用10 μl槍頭盡量垂直作線性劃痕,吸去培養基,PBS洗滌去除脫落細胞,加入無血清培養基培養,細胞分成4組(HEC1A組、miR-381 mimc組、pc-HMGB1組和mimic+pc-HMGB1組),繼續培養24 h后取出細胞培養板,拍照記錄并測量劃痕寬度。劃痕閉合率=(0 h劃痕寬度-24 h劃痕寬度)/0 h劃痕寬度×100%。
1.2.8Western blot檢測相關蛋白表達水平
將1×105個細胞接種于培養板中,細胞分成4組(HEC1A組、miR-381 mimc組、pc-HMGB1組和mimic+pc-HMGB1組),培養細胞48 h后,用RIPA裂解液提取各組細胞總蛋白,BCA法檢測蛋白質濃度并調平,每組取30 μg蛋白用10%十二烷基硫酸鈉聚丙烯酰胺凝膠電泳(sodium dodecyl sulfate polyacrylamide gel electrophoresis,SDS-PAGE)分離蛋白并轉移到聚偏二氟乙烯(polyvinylidene fluoride,PVDF)膜上,再用5%脫脂奶粉室溫封閉2 h,加入一抗(1∶500)于4 ℃封閉過夜。第2天洗膜后加入二抗(1∶2 000)室溫孵育1 h后,加入顯色液曝光顯影。
1.2.9統計學方法
2 結果
2.1 miR-381在正常子宮內膜細胞株和癌細胞系中的差異表達
與正常子宮內膜細胞株相比,miR-381在5個子宮內膜癌細胞系中均存在低水平表達(P<0.01),見圖1。
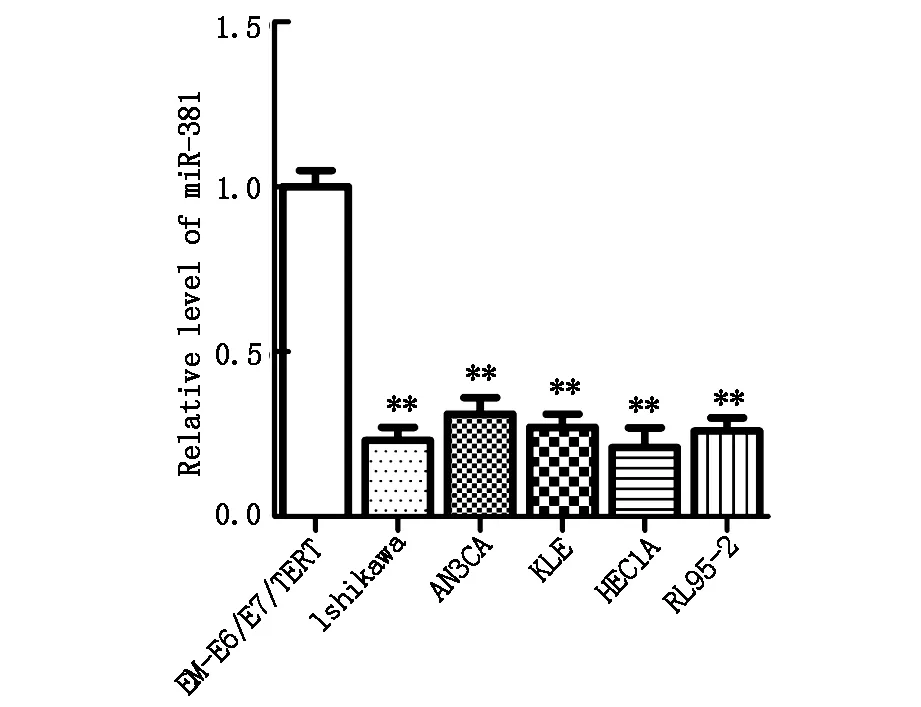
圖1 miR-381表達水平
2.2 HMGB1是miR-381的直接靶點
生物信息學預測結果發現,miR-381-3p序列與HMGB1的3′-UTR端第358-364位點存在連續的互補片段(圖2A)。為了驗證兩者的靶向關系,采用熒光素酶報告實驗進一步確定,結果發現,與HMGB1 WT組相比,HMGB1 WT+miR-381mimic組熒光素酶活性明顯降低(P<0.01,圖2B),而HMGB1 MUT組和HMGB1 MUT+miR381 mimic熒光素酶活性無明顯改變(P>0.05,圖2B)。
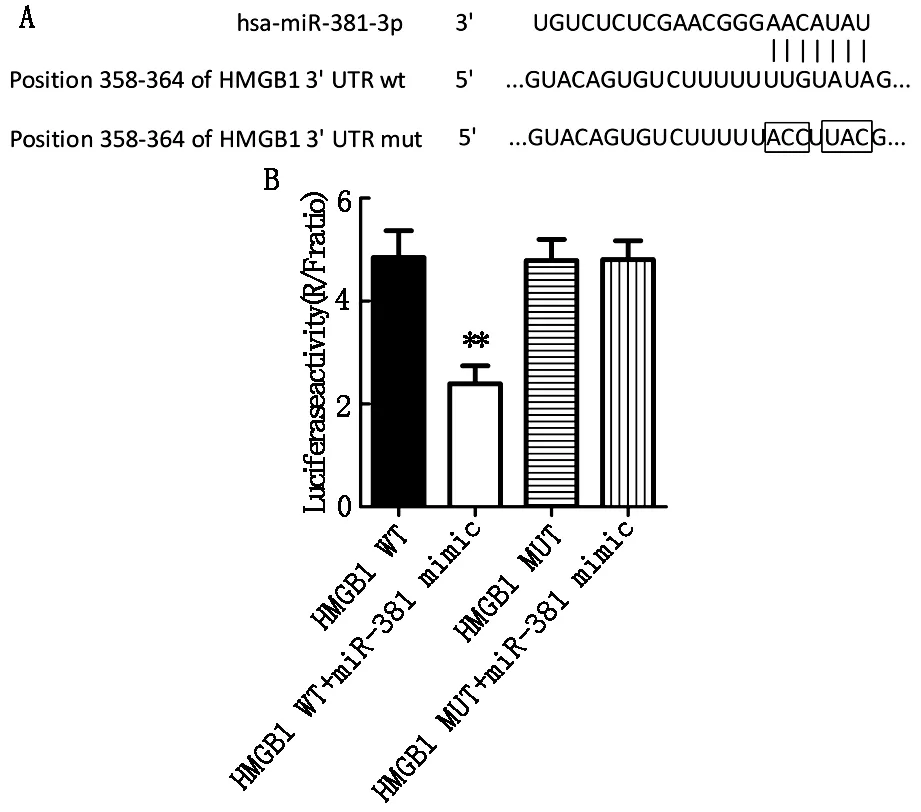
圖2 miR-381與HMGB1具有靶向關系
注:與HMGB1 WT組比較,**P<0.01。A:miR-381與HMGB1生物信息學預測結果;B:熒光素酶報告實驗證明miR-381與HMGB1存在靶向關系。
2.3 miR-381靶向抑制HMGB1表達
與HEC1A組相比,轉染miR-381 scramble后miR-381表達水平未見明顯改變(P>0.05,圖3A),而轉染miR-381 mimic可顯著增加miR-381在HEC1A細胞中的表達水平(P<0.01,圖3A);此外,轉染miR-381 mimic后,HMGB1的mRNA表達水平在HEC1A細胞中顯著降低(P<0.01,圖3B)。
蛋白印跡實驗結果表明,與HEC1A組相比,miR-381 mimic組HMGB1蛋白表達水平顯著降低(P<0.01,圖3C和3D),pc-HMGB1組其表達則顯著增加(P<0.01,圖3C和3D);而與pc-HMGB1組相比,mimic+pc-HMGB1組HEC1A細胞中HMGB1蛋白表達水平得到部分逆轉(P<0.01,圖3C和3D)。
2.4 miR-381靶向HMGB1抑制HEC1A細胞增殖
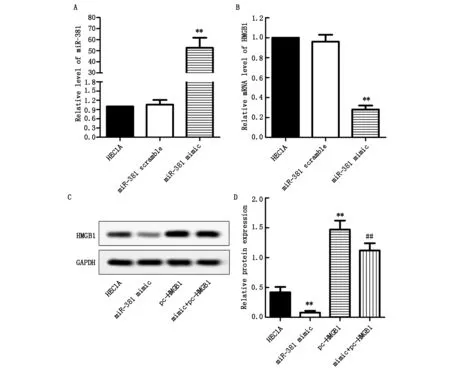
圖3 miR-381 mimic對HMGB1表達水平的影響
注:與HEC1A組比較,**P<0.01;與pc-HMGB1組比較,##P<0.01。A:miR-381表達水平;B:HMGB1的mRNA表達水平;C:HMGB1蛋白條帶圖;D:HMGB1的蛋白表達水平。
CCK8實驗檢測miR-381靶向HMGB1對HEC1A細胞增殖能力的影響,結果顯示:與HEC1A組相比,miR-381 mimic組細胞增殖倍數顯著降低(P<0.01,圖4A),pc-HMGB1組細胞增殖倍數則顯著增加(P<0.01,圖4A);與pc-HMGB1組相比,mimic+pc-HMGB1組細胞增殖倍數降低(P<0.01,圖4A)。此外,蛋白印跡實驗進一步檢測影響HEC1A細胞增殖能力的分子機制,結果顯示:與HEC1A組相比,miR-381 mimic組增殖相關蛋白Ki67和PCNA表達水平顯著降低(P<0.01,圖4B和4C),pc-HMGB1組兩種蛋白表達水平則顯著增加(P<0.01,圖4B和4C);與pc-HMGB1組相比,mimic+pc-HMGB1組細胞中Ki67和PCNA表達水平降低(P<0.01,圖4B和4C)。
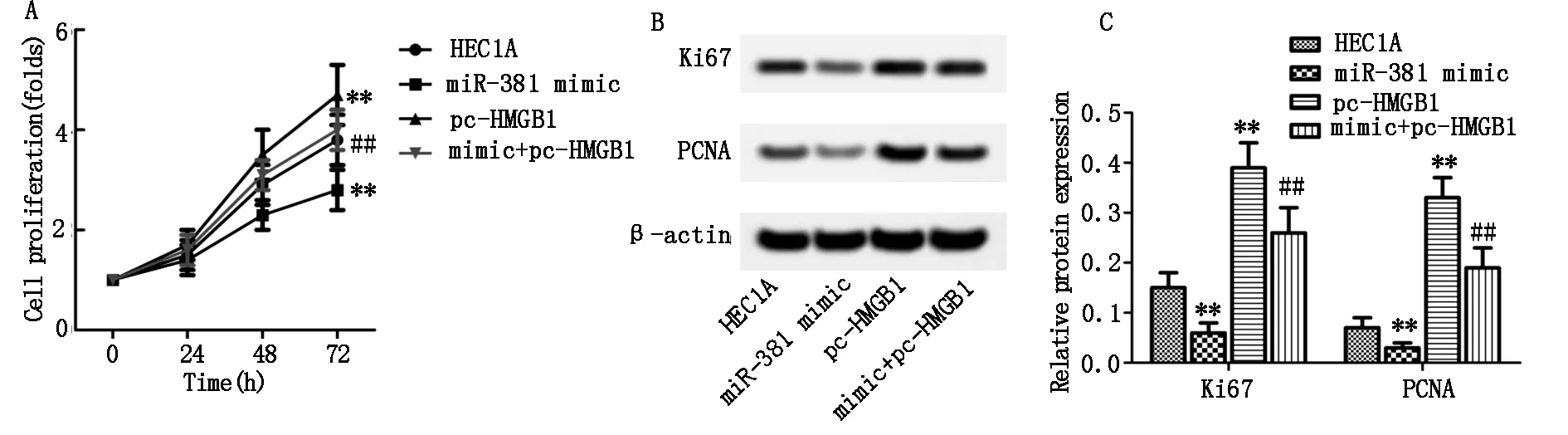
圖4 HEC1A細胞增殖倍數和相關蛋白表達
注:與HEC1A組比較,**P<0.01;與pc-HMGB1組比較,##P<0.01。A:HEC1A細胞增殖倍數;B:增殖相關蛋白條帶;C:增殖相關蛋白表達結果。
2.5 miR-381靶向HMGB1抑制HEC1A細胞侵襲遷移和上皮間質轉化
Transwell實驗和劃痕閉合實驗分別檢測miR-381靶向HMGB1對HEC1A細胞侵襲遷移能力的影響,結果顯示:與HEC1A組相比,miR-381 mimic組侵襲細胞數量和劃痕閉合率均顯著降低(P<0.01,圖5A和5B),pc-HMGB1組侵襲細胞數量和劃痕閉合率則均顯著增加(P<0.01,圖5A和5B);與pc-HMGB1組相比,mimic+pc-HMGB1組侵襲細胞數量和劃痕閉合率均降低(P<0.01,圖5A和5B)。此外,蛋白印跡實驗檢測影響HEC1A細胞侵襲遷移和EMT能力的分子機制,結果顯示:與HEC1A組相比,miR-381 mimic組細胞低表達N-cadherin、Vimentin、MMP-2和MMP-9而高表達E-cadherin(P<0.01,圖5C),pc-HMGB1組則高表達N-cadherin、Vimentin、MMP-2和MMP-9而低表達E-cadherin(P<0.01,圖5C);與pc-HMGB1組相比,mimic+pc-HMGB1組5中蛋白表達水平均全部逆轉(P<0.01,圖5C)。
3 討論
在世界范圍內,EC均是最常見婦科惡性腫瘤,在我國發病率僅次于宮頸癌;目前,臨床上對絕經后陰道出血的婦女需經陰道超聲檢查,評估子宮內膜厚度以決定內膜活檢的必要性,通常以5 mm為標準,但對無癥狀子宮內膜增厚患者并不適用[13]。目前,EC的早期篩查和診斷依然存在困難,其治療主要以手術切除為主,但為了保留生育能力,保守治療仍是年輕女性的選擇之一。因此,尋找新的非手術治療方法是非常必要的。miRNAs是一種高度保守的非編碼RNA,長度約為18-22個核苷酸,在轉錄后水平上可負向調控目的基因表達[14]。大量研究均表明,miRNAs在子宮內膜癌發展進程中發揮著重要作用,可通過靶向調節目的基因實現抑制或促進癌細胞生長[15-18]。且研究發現,HMGB1與EC發展呈負相關,抑制HMGB1表達能降低EC發生EMT轉變,從而阻止癌細胞的侵襲和轉移[19]。基于此,本研究首先檢測了miR-381在正常子宮內膜細胞和多種子宮內膜癌細胞系的表達差異,確定其在子宮內膜癌細胞中低表達。之后,通過生物信息學預測miR-381和HMGB1的靶向關系并采用熒光素酶報告實驗加以證實。證明,miR-381過表達能靶向抑制HMGB1的mRNA和蛋白表達水平。
既往研究表明,miR-381可抑制癌細胞的增殖水平,如miR-381靶向成纖維細胞因子II型受體基因,從而抑制口腔鱗狀細胞癌的增殖能力[20]。Ki67和PCNA均是存在于增殖細胞核中的核蛋白,兩者高表達是細胞處于增殖水平的標記[21,22]。本實驗研究發現,過表達miR-381抑制HEC1A細胞的增殖倍數,同時降低細胞內增殖相關蛋白Ki67和PCNA的蛋白表達水平,而共同轉染miR-381 mimic和pc-HMGB1部分逆轉了上述表現。綜合實驗結果表明,過表達miR-381對HEC1A細胞增殖能力的抑制作用,可能是通過靶向抑制HMGB1表達有關。而Tu等人[23]則認為miR-381抑制子宮內膜癌細胞增殖的作用,是通過靶向抑制胰島素樣生長因子受體1(insulin-like growth factor receptor 1,IGF-1R)實現的。
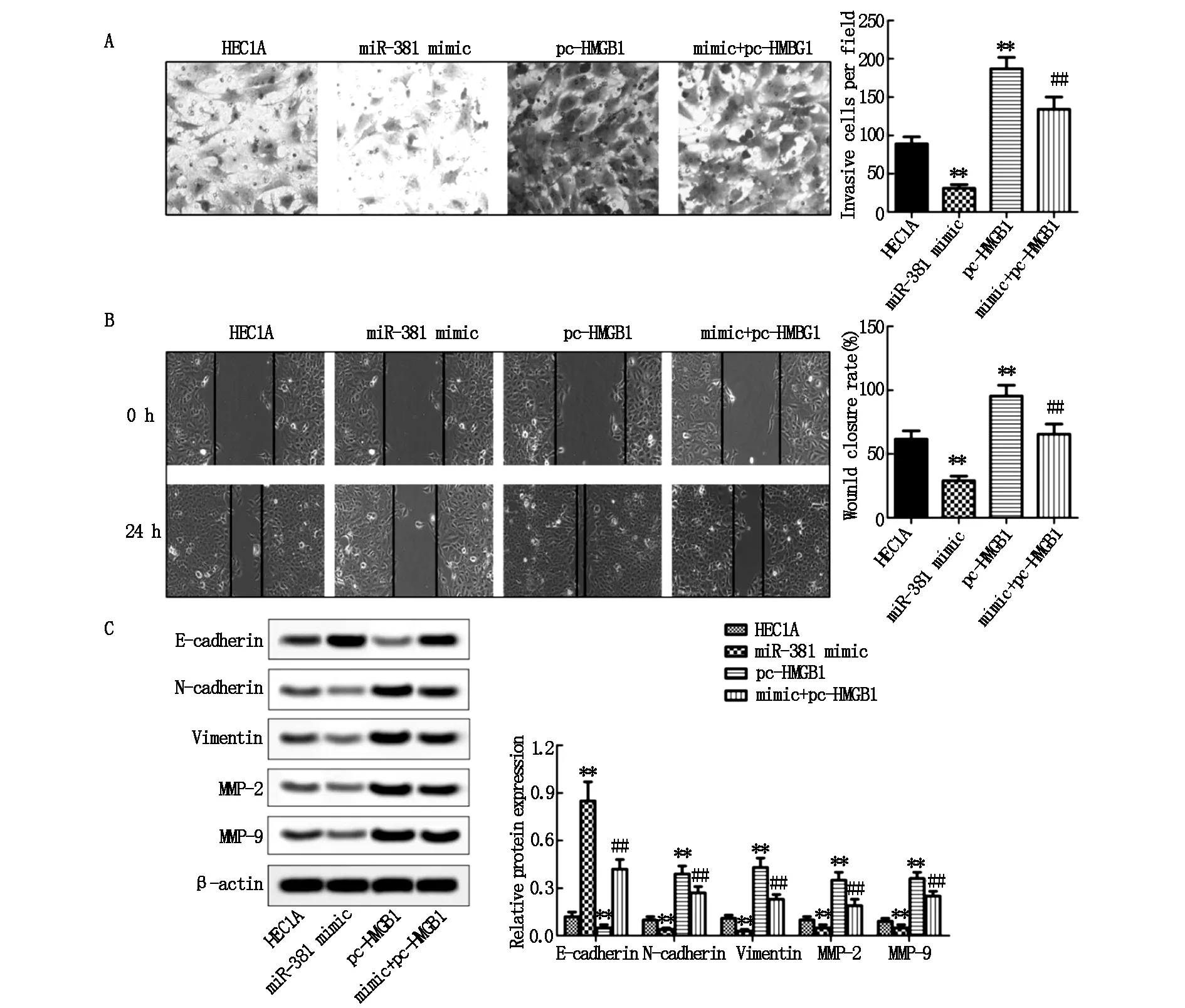
圖5 HEC1A細胞侵襲、遷移能力和相關蛋白表達
注:與HEC1A組比較,**P<0.01;與pc-HMGB1組比較,##P<0.01。A:Transwell實驗檢測HEC1A細胞侵襲能力;B:劃痕實驗檢測HEC1A細胞遷移能力;C:蛋白印跡實驗檢測相關蛋白表達水平。
此外,miR-381可抑制癌細胞的侵襲、遷移和上皮間質轉化,如增加miR-381表達可通過靶向調控Twist1而抑制結腸癌細胞的侵襲與遷移[24];而靶向CXC 趨化因子受體4(CXC chemokine receptor 4,CXCR4)能抑制乳腺癌細胞上皮間質轉化和轉移[1]。當腫瘤細胞發生EMT時,上皮標記蛋白E-cadherin的表達明顯下調,而間質標記蛋白N-cadherin和Vimentin的表達則明顯上升[25]。此外,MMP-2和MMP-9在腫瘤侵襲轉移過程中起著重要作用,有利于腫瘤細胞侵襲轉移的發生[26]。本實驗研究發現,過表達miR-381能抑制HEC1A細胞的侵襲和遷移能力,同時調節侵襲、遷移和EMT相關蛋白表達水平,而過表達HMGB1則正好相反,且共同轉染miR-381 mimic和pc-HMGB1部分逆轉了過表達HMGB1對腫瘤細胞侵襲、遷移和EMT的影響。綜合實驗結果顯示,miR-381可能通過靶向抑制HMGB1表達水平,從而抑制HEC1A細胞的侵襲、遷移和EMT能力。但是,過表達miR-381對子宮內膜癌細胞的抑制作用是否還存在其他靶基因的表達改變,還需要進一步篩查和研究。
綜上所述,HMGB1是miR-381的直接靶點;過表達miR-381能抑制HMGB1的mRNA和蛋白表達水平;抑制細胞增殖能力和相關蛋白Ki67、PCNA的表達;降低細胞侵襲、遷移能力,并調節相關蛋白E-cadherin、N-cadherin、Vimentin、MMP-2和MMP-9的表達。表明,miR-381的表達上調通過靶向調控HMGB1的表達,抑制了子宮內膜癌HEC1A細胞的增殖、侵襲和遷移。下一步將研究過表達miR-381靶向HMGB1對子宮內膜癌細胞的體內生長和轉移作用,以期為子宮內膜癌的治療提供思路。

