宮頸癌細胞培養上清液誘導THP-1巨噬細胞M2表型
竇曉青,溫明曉,朱迎萍,張淑珍,徐獻麗,許江燕
(浙江中醫藥大學附屬第一醫院,浙江杭州310000,1.婦產科;2.檢驗科)
宮頸癌是發展中國家女性癌癥第三大死亡原因[1]。雖然治療宮頸癌的手術、腫瘤免疫治療等多種方法已取得初步成果,但仍有部分患者存在復發風險,這與癌組織局部的腫瘤微環境密切相關。在宮頸癌的腫瘤微環境中,巨噬細胞占所有細胞比例高達30%~50%,預示其對于腫瘤發生發展的關鍵作用[2]。根據巨噬細胞表型可將其分為M1及M2型,其中M1型巨噬細胞發揮殺傷細胞內病原體、破壞腫瘤、促進Th1免疫反應的作用;而M2型巨噬細胞可通過表達血管內皮生長因子(vascularendothelialgrowthfactor,VEGF)、程序性死亡配體1等促進腫瘤的發生發展,與癌癥不良預后密切相關[3-4]。研究發現,宮頸癌組織中浸潤的巨噬細胞以M2型為主,且宮頸癌可通過分泌IL-4、IL-10來促進巨噬細胞向M2極化[3],但這些細胞因子是否在誘導或維持M2巨噬細胞表型中發揮重要作用尚未明確。為此,本研究探討宮頸癌細胞系(HeLa)培養上清液是否可誘導并維持THP-1巨噬細胞M2表型,以明確HeLa細胞培養上清液對THP-1巨噬細胞分化的影響。
1 材料和方法
1.1 材料 流式抗體CD206-FITC、CD163-FITC、HLA-DR-APC、STAT1-PE、pSTAT1-PE、STAT6-PE和pSTAT6-PE購自美國BioLegend公司;IL-2、IL-4、IL-6、IL-10 細胞因子檢測試劑盒購于深圳達科為公司;HumanGrowthFactorPanelMulti-analyteFlowAssay試劑盒購自美國BioLegend公司;硝酸全氮/亞硝酸鹽比色法試劑盒購自美國R&D公司。抗pSTAT6抗體購于美國BioLegend公司。
1.2 方法
1.2.1 HeLa細胞培養上清液收集及細胞因子檢測:將HeLa細胞系以1×105個/孔接種于6孔板中,培養體系為DMEM的完全培養基(含10%的FBS,1%的雙抗)。細胞培養至第3天時,收集細胞并離心收集上清液,分裝后凍存于-80℃冰箱。使用深圳達科為公司的細胞因子檢測試劑盒和美國BioLegend公司的HumanGrowthFactorPanelMulti-analyteFlowAssay試劑盒測定細胞因子和生長因子,操作按說明書進行。
1.2.2 實驗分組及處理:實驗分組:空白對照組(Mθ組)、M2細胞誘導組(M2組)、HeLa細胞培養上清液處理組(Mθ+sHeLa組)。THP-1細胞系以1×106個/孔接種于12孔板中,培養體系為RPMI-1640完全培養基(含10%的FBS,1%的雙抗)。待細胞培養至對數生長期,收集THP-1并用無菌PBS洗滌3遍后進行如下處理。Mθ組:不做刺激處理的基礎狀態;M2組:20ng/mLIL-4、20ng/mLIL-10 處理3d;Mθ+sHeLa組:加入50%HeLa細胞培養上清液處理培養3d。
1.2.3 流式細胞術檢測巨噬細胞CD163、CD206和HLA-DR的表達:離心收集1.2.2中的巨噬細胞并用PBS洗滌3 次,加入Fc受體阻斷劑于37℃封閉阻斷人Fc受體30min;PBS洗滌3次后,加入CD163-FITC、CD206-FITC或HLA-DR-APC抗體1mL,4℃孵育30min,PBS洗滌3次后,調整終體積至300mL,流式儀上機檢測。
1.2.4 HeLa細胞培養上清液處理后的巨噬細胞產生細胞因子、生長因子、TGF-β3水平檢測:用HeLa細胞培養上清液處理THP-1巨噬細胞3d后,500r/min離心收集細胞上清液。使用流式細胞術檢測細胞因子和血管生成素-2(angiopoietin-2,ANG-2)、肝細胞生長因子(hepatocytegrowthfactor,HGF)、VEGF。利用Bio-PlexProTMTGF-β3-Plex試劑盒分析TGF-β3的產生。細胞因子、生長因子和TGF-β3濃度以pg/mL表示,以上操作均按說明書進行。
1.2.5 去除HeLa細胞培養上清液48h后THP-1巨噬細胞產生生長因子能力變化:為評估在去除HeLa細胞上清液后,巨噬細胞分泌細胞因子及生長因子情況。先用HeLa細胞培養上清液處理THP-1巨噬細胞3d,隨后用新鮮的DMEM完全培養基替換HeLa細胞上清液后繼續培養48h。最后,500r/min離心收集細胞上清液并檢測細胞因子、生長因子、TGF-β3的濃度。
1.2.6 JAK-STAT6信號通路影響HeLa細胞培養上清液對THP-1的分化效果:離心收集并用PBS洗滌各組處理3d后的巨噬細胞,用破膜固定液于冰上處理細胞20min,隨后用BD染色緩沖液洗滌細胞3次,最后加入STAT6-PE或pSTAT6-PE抗體1μL,4℃避光孵育30min。用PBS洗滌并重懸細胞后上機檢測。使用FlowJo對結果進行分析,以平均熒光強度(meanfluorescenceintensity,MFI)展示實驗結果。提取THP-1細胞蛋白,采用BCA法進行定量,SDS-PAGE電泳后電轉移至硝酸纖維素膜,5%脫脂奶粉室溫封閉1h,加入pSTAT6 一抗4℃孵育過夜,TBST洗膜3次,加入相應HRP標記的二抗室溫孵育2h,滴加ECL發光,顯影,使用ImageJ進行灰度分析。
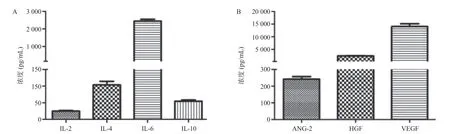
圖1 HeLa細胞培養基中細胞因子(A)及生長因子(B)的檢測
1.3 統計學處理方法 采用GraphPad5軟件進行數據分析。計量資料采用表示,多組比較采用單因素方差分析,采用Student’st 檢驗分析組間差異。P<0.05為差異有統計學意義。
2 結果
2.1 HeLa細胞分泌的細胞因子 HeLa細胞分泌的細胞因子如圖1所示,HeLa分泌的代表性細胞因子(IL-4、IL-6、IL-10)及生長因子(ANG-2、HGF、VEGF)表達的水平。在細胞因子方面,HeLa細胞分泌IL-6較多;在生長因子方面,則以HGF、VEGF含量較多。見圖1。
2.2 HeLa細胞培養上清液對巨噬細胞表面受體和轉錄因子表達的影響 為探討HeLa細胞培養上清液對巨噬細胞極化的影響,用HeLa細胞培養上清液處理巨噬細胞3d后,收集細胞分析M1和M2表型表面受體的表達水平,結果見圖2。與Mθ組比,M2組及Mθ+sHeLa組的M1型細胞極化相關的細胞表面標記物(HLA-DR)表達差異無統計學意義(P>0.05),而M2型細胞極化相關的細胞表面標記物(CD163和CD206)含量升高,差異有統計學意義(P<0.05)。
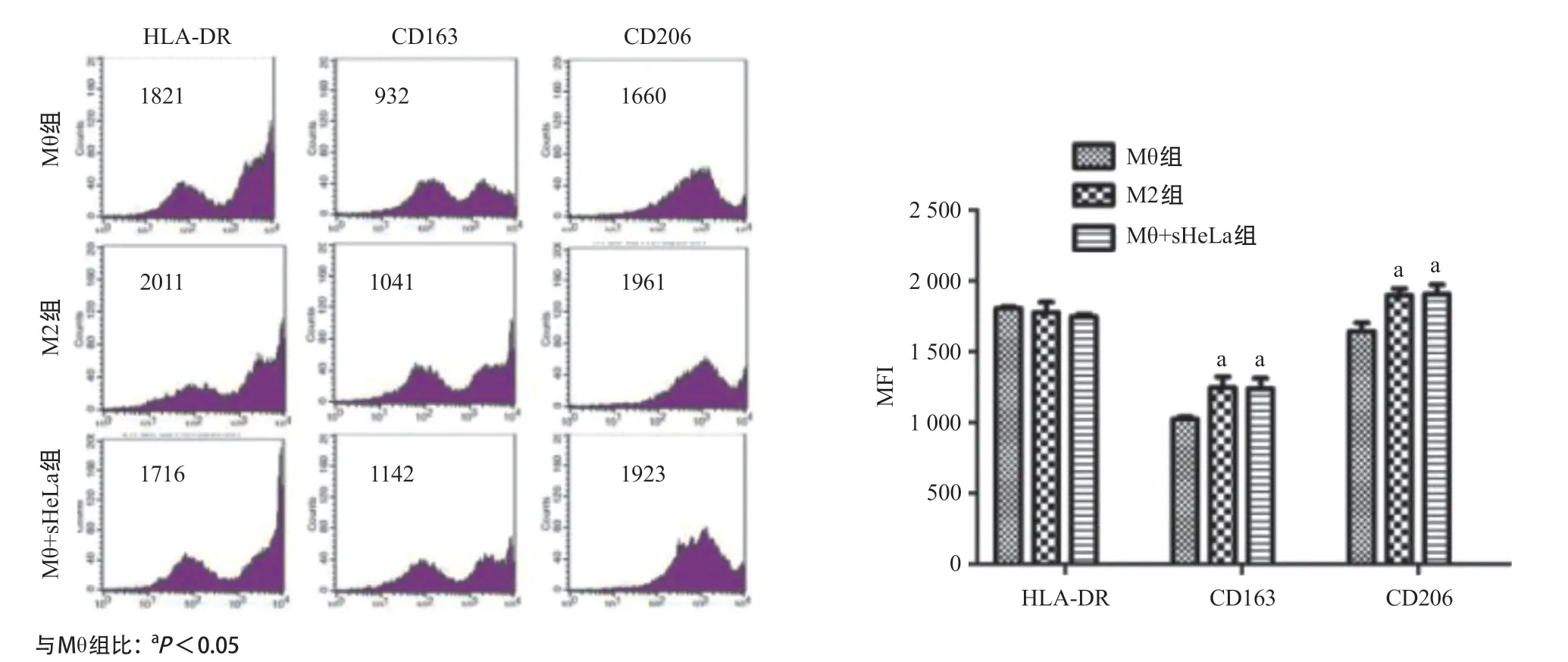
圖2 HeLa細胞培養上清液處理的THP-1巨噬細胞膜受體HLA-DR、CD163和CD206的檢測
2.3 HeLa細胞培養上清液處理后的巨噬細胞產生細胞因子、生長因子水平 為探討HeLa細胞培養上清液對巨噬細胞釋放細胞因子、生長因子的影響,用HeLa細胞培養上清液處理巨噬細胞3d,流式細胞術檢測胞內細胞因子,收集細胞上清液檢測生長因子水平,結果見圖3。與Mθ組比,M2組及Mθ+sHeLa組細胞因子(IL-4、IL-6、IL-10)表達水平明顯升高,差異有統計學意義(P<0.05)。與Mθ組比,M2組及Mθ+sHeLa組的HGF、ANG-2和VEGF明顯升高,差異有統計學意義(P<0.05)。與Mθ組比,M2組及Mθ+sHeLa組的TGF-β3分泌增加,差異有統計學意義(P<0.05)。
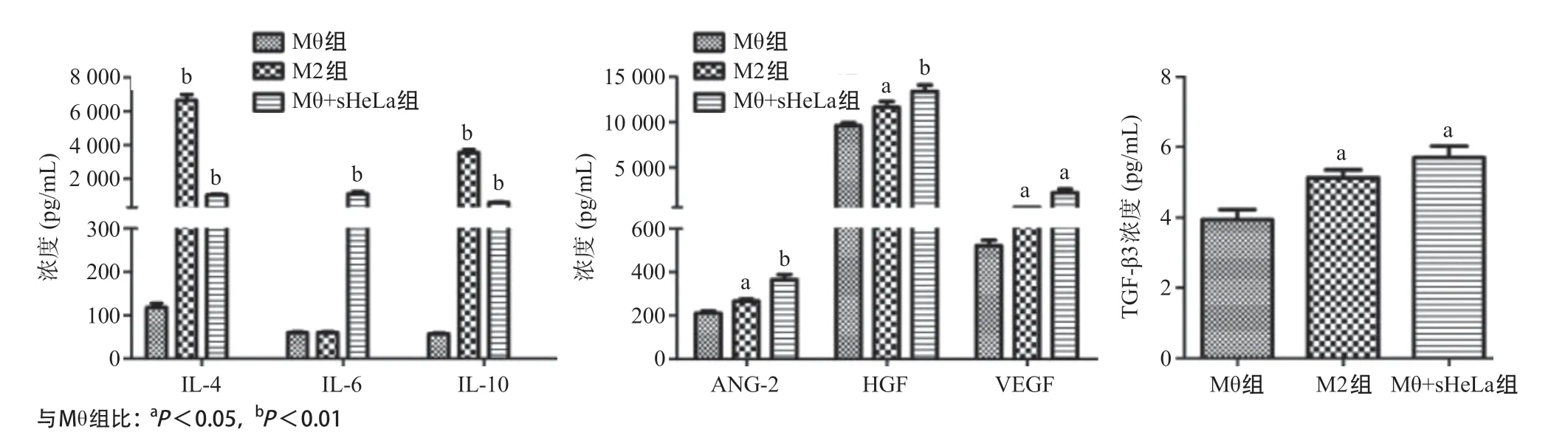
圖3 HeLa細胞培養上清液處理后的THP-1巨噬細胞分泌細胞因子、生長因子、TGF-β3水平的檢測
2.4 去除HeLa細胞培養上清液48h后巨噬細胞細胞因子、生長因子及TGF-β3水平 與Mθ組比,去除HeLa細胞培養上清液48h的巨噬細胞(Mθ+sHeLasHeLa組)分泌IL-4、IL-6、IL-10、Ang-2、HGF、VEGF濃度增加(P<0.05);同時,與Mθ組比,Mθ+sHeLa-sHeLa組TGF-β3增加(P<0.05),見圖4。
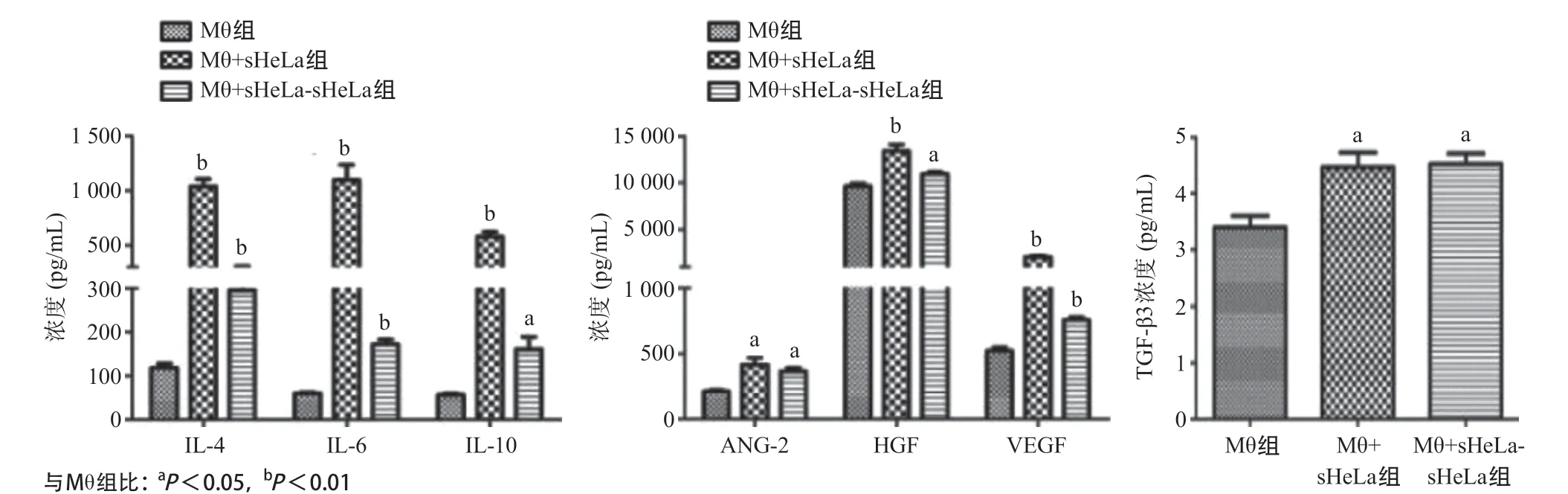
圖4 去除HeLa細胞培養上清液48h后THP-1巨噬細胞中細胞因子、生長因子、TGF-β3蛋白水平
2.5 JAK-STAT6信號通路參與HeLa細胞培養上清液對M2型巨噬細胞的分化 M2型巨噬細胞極化相關轉錄因子(STAT6、pSTAT6)表達如圖5所示,與Mθ組比,Mθ+sHeLa組的巨噬細胞pSTAT6表達水平明顯升高,差異有統計學意義(P<0.05)。HeLa細胞培養上清液可通過激活JAK-STAT6信號通路誘導巨噬細胞向M2型分化。
3 討論
浸潤腫瘤組織中的巨噬細胞通常稱為腫瘤相關的巨噬細胞,其對腫瘤的發展起重要作用。巨噬細胞可在不同條件的誘導下向M1或M2極化,其中M2表型巨噬細胞參與促進Th2免疫反應,并通過表達VEGF、TGF-β、吲哚胺2,3-雙加氧酶、程序性死亡配體1促進腫瘤的發生,且M2巨噬細胞的存在與不良預后有關[2]。本研究初步分析宮頸癌細胞培養上清液相關生長及細胞因子水平,并探討其對于巨噬細胞極化的影響。
腫瘤細胞所釋放的細胞產物一方面促進血管生成、新陳代謝、腫瘤相關細胞募集和腫瘤增長[5-6];另一方面,它們也可誘導M2表型巨噬細胞,在維持免疫抑制微環境、促進血管生成和代謝方面發揮重要作用[7]。胃癌細胞通過釋放的IL-4、IL-10、單核細胞集落刺激因子引起腫瘤相關巨噬細胞(tumorassociatedmacrophages,TAMs)向M2表型極化[8]。本研究發現HeLa細胞培養上清液中有高濃度的IL-6、IL-4、HGF、VEGF。細胞因子IL-6、IL-4被認為參與單核細胞分化成腫瘤相關巨噬細胞樣細胞的過程中,同時也是誘導M2表型巨噬細胞的重要因子[9];VEGF和HGF一樣具有較強的促血管生成作用,共同參與腫瘤的發生發展過程[10]。這表明,HeLa細胞上清液也一方面可通過釋放IL-6、IL-4 等細胞因子誘導TAMs向M2表型極化,另一方面也可通過釋放HGF、VEGF可通過促進血管生成、新陳代謝、腫瘤相關細胞募集和腫瘤生長。
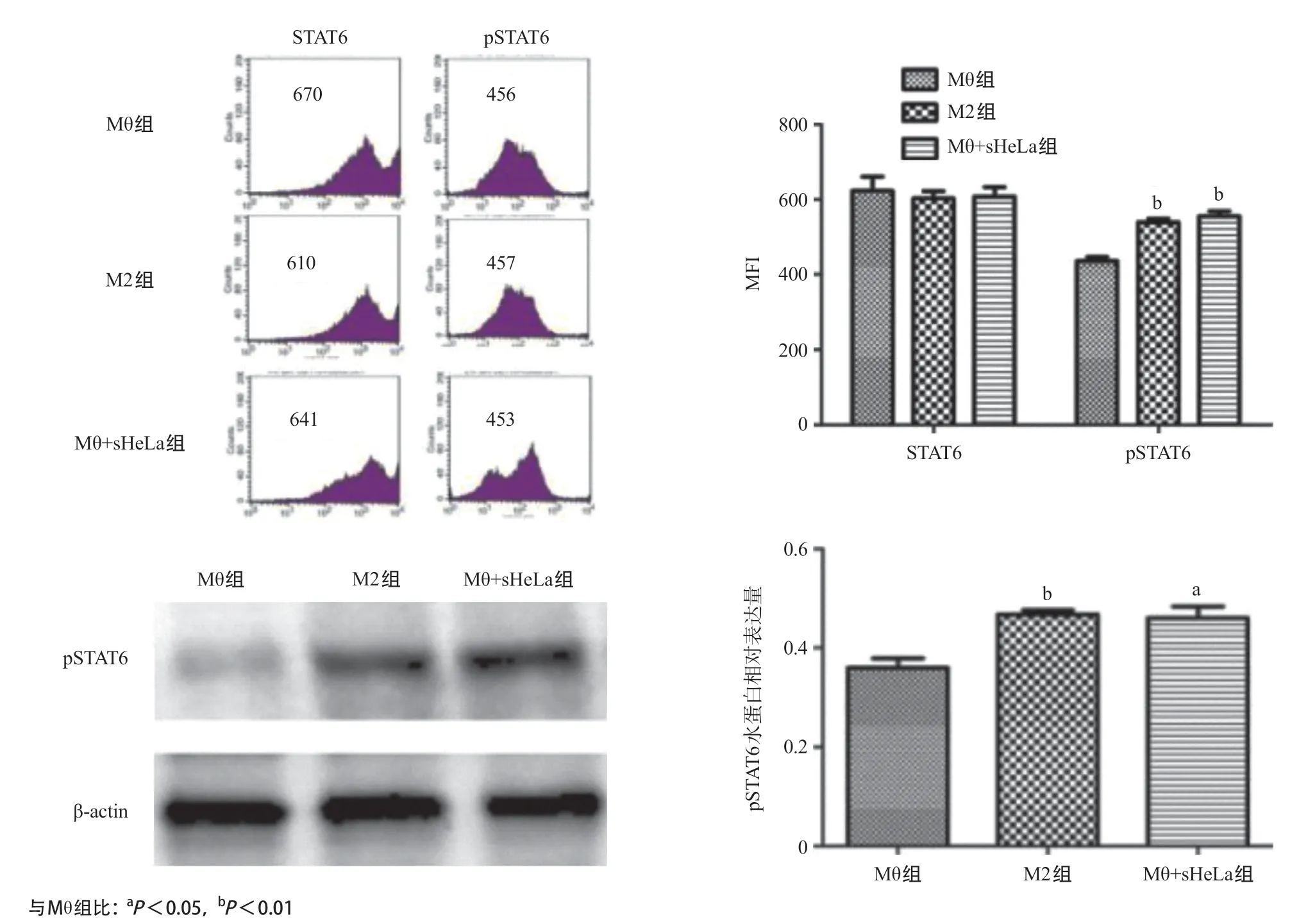
圖5 流式細胞術及Westernblot檢測巨噬細胞中pSTAT6水平
在本研究中,經HeLa細胞培養上清液處理后的M2巨噬細胞標記物的CD163、CD206表達上調,說明HeLa細胞培養上清液可誘導巨噬細胞向M2細胞極化。同時,HeLa細胞培養上清液處理后的巨噬細胞可釋放大量ANG-2、HGF、VEGF。ANG-2作為M2表型的巨噬細胞分泌的代表性生長因子,可發揮促進腫瘤生長作用,它與HGF、VEGF一道通過不同方式促進腫瘤細胞生長。重要的是,在去除Hela細胞培養基48h后,巨噬細胞可持續高表達IL-4、IL-6、IL-10以及ANG-2、VEGF、HGF,這預示在切除腫瘤后,受到原先腫瘤局部微環境影響的M2型巨噬細胞可繼續分泌相關細胞因子及生長因子來促進腫瘤復發。既往研究顯示TGF-β3 的高表達可促進腫瘤發生發展,并且M2型巨噬細胞分泌的TGF-β3也可通過自分泌的形式作用于自身,進一步促進巨噬細胞向M2極化[7]。在黑色素瘤與乳腺癌中,TGF-β3 的高表達與病情加重及不良預后有關[11]。本研究同樣發現經過Hela細胞培養上清液處理后的巨噬細胞釋放TGF-β3水平升高,也提示其在宮頸癌中的重要作用。
JAK/STAT信號通路與由各種細胞因子誘導的各種生物學應答有關,在非受體型JAK的作用下,轉錄因子STAT磷酸化并發生二聚化,磷酸化的STAT轉位至核內,激活相關基因表達;轉錄因子STAT分為多種亞型,其中STAT6與M2相關特異性基因表達有關,研究發現IL-4等細胞因子可通過激活JAK/STAT6途徑調節巨噬細胞M2的極化[12]。本研究也發現HeLa細胞培養上清液處理后的巨噬細胞中磷酸化STAT6水平增加。由于HeLa細胞培養上清液存在IL-4等多種細胞因子,因此可以推測HeLa細胞是通過釋放相關細胞因子來激活JAK/STAT6途徑,進而導致巨噬細胞向M2極化。
本研究也存在不足,首先本研究采用Hela細胞系,和真實腫瘤細胞存在差異;其次,HeLa細胞系及巨噬細胞可分泌諸多細胞產物,而本研究僅檢測少數幾種與M2巨噬細胞極化有關的細胞因子及生長因子,其余細胞產物的作用還需后續深入研究。
綜上所述,HeLa細胞培養上清液可誘導巨噬細胞向M2表型的極化,參與腫瘤的生長和血管生成。

