無癥狀2型糖尿病周圍神經病變患者監測血清NO和AGEs的臨床意義
徐英英,黃興友,魏智利,王陳芳,留菁菁,潘偉力
(1.浙江中醫藥大學附屬第三醫院內分泌風濕腎病科,浙江杭州310005;2.浙江中醫藥大學附屬第三醫院檢驗科,浙江杭州310005;3.浙江中醫藥大學第三臨床醫學院,浙江杭州310014)
糖尿病(diabetesmellitus,DM)已成為我國重大的公共健康問題[1]。糖尿病周圍神經病變(diabeticperipheralneuropathy,DPN)是2型糖尿病(type2diabetesmellitus,T2DM)常見的慢性并發癥,起病隱匿。中華醫學會糖尿病學分會的流行病學調查統計發現,DPN的發生率達到60.3%[2]。DPN可累及感覺神經、運動神經和自主神經,但以感覺神經最為常見,臨床上以疼痛、肢體麻木、感覺異常等癥狀為主[3]。
DPN早期常無自覺癥狀,易被忽視,待出現臨床癥狀時周圍神經多已出現不可逆的軸索損傷和階段性脫髓鞘等病理改變[4]。神經傳導速度(nerveconductivevelocity,NCV)減慢是周圍神經受損的重要標志,也是DM出現神經病變的先兆,常提示有節段性脫髓鞘改變。高血糖是DPN發病的始動因素,多因素相互作用共同導致DPN的發生發展[5]。糖基化終末產物(advancedglycationendoproducts,AGEs)既是高血糖的病理產物,亦是引起DPN的重要原因之一。AGEs生成增加,可導致一氧化氮(nitricoxide,NO)滅活增加、NO生成及釋放減少,都會直接導致血管舒縮障礙、局部血流灌注不足,造成神經組織的結構或功能受損。DM患者常存在NO合成或釋放功能缺陷,其含量減少與DPN的發病密切相關。本研究主要探討早期檢測NO、AGEs對無癥狀DPN患者的臨床意義。
1 資料和方法
1.1 一般資料
1.1.1 入選標準和排除標準:隨機選取浙江中醫藥大學附屬第三醫院2015年6月至2018年12月期間收治的首次診斷T2DM患者80例,經常規查體、血生化檢測,均符合2013年中華醫學會糖尿病學分會制定的T2DM診斷標準[6]。排除心腦血管疾病、嚴重腫瘤及其他疾病引發神經病變患者。
1.1.2 分組:根據2009年中國醫師協會內分泌代謝醫師分會制定的DPN診療規范[7],結合NCV測定及振動感覺閾值(vibrationperceptionthreshold,VPT)檢查,診斷DPN患者60例,男31例,女29例,年齡35~75(63.2±10.5)歲。不符合DPN者為單純T2DM組。所有DPN患者根據有無發生肢體麻木、燒灼感、疼痛等癥狀評分進行分組,分為有癥狀DPN組和無癥狀DPN組。
1.1.3 入院時情況:有癥狀DPN組患者29例,男15例,女14例,年齡43~75(63.4±10.7)歲;早期無癥狀DPN患者共31例,男16例,女15例,年齡35~74(62.8±11.1)歲。單純T2DM組患者20例,男10例,女10例,年齡35~73(62.5±10.5)歲。3組一般情況比較差異無統計學意義(P>0.05)。
1.2 研究方法 在排除非糖尿病性神經疾患后不論有無周圍神經病變的典型癥狀,所有T2DM患者均行VPT與NCV檢查。有臨床研究表明VPT>25V即可認為存在DPN[8],在早期發現神經損害方面VPT敏感性甚至要優于NCV。NCV結果判斷參照我院肌電圖室相應的正常值對照表。NCV有2項或2項以上低于正常人群均數減兩倍標準差被判斷為異常。有研究指出NCV判定標準可參考湯氏標準,腓總神經及脛神經的運動神經傳導速度(motornerveconduc-tionvelocity,MCV)≥45m/s,腓腸神經及腓淺神經的感覺神經傳導速度(sensorynerveconduc-tionvelocity,SCV)≥45m/s為正常,低于上述各值為異常[9]。
NCV檢查:運用丹麥麥迪克斯公司KeyPoint4肌電圖/誘發電位儀,室內環境安靜,室溫25℃,皮溫30℃左右,刺激脈沖波寬0.2Hu,靈敏度1mV,刺激強度3~50mV。專業人員測定患者雙下肢的NCV,包括腓總神經及脛神經的MCV和腓腸神經及腓淺神經的SCV。
VPT檢測選用遠想醫療設備有限公司生產的藍訊時代Sensiometer型號的VPT-I檢測儀,采用平臥位對T2DM患者雙下肢行振動感覺檢測,探頭接觸于大腳趾皮膚,振幅從零開始漸漸增加,直至能被檢查者感知,讀出此時的數值,行3次操作后取平均值[10]。
1.3 觀察指標 采用全自動生化分析儀檢測空腹血糖(fastingplasmaglucose,FPG)、餐后2h血糖(postprandialtwo-hourbloodglucose,PPG)、總膽固醇(totalcholesterol,TC)和甘油三酯(triglyceride,TG)、低密度脂蛋白膽固醇(lowdensitylipoproteincholesterol,LDL-c)、高密度脂蛋白膽固醇(highdensitylipoproteincholesterol,HDL-c)、載脂蛋白a(apolipoproteina,APOa)、載脂蛋白b(apolipoproteinb,APOb)等指標。采用血紅蛋白測定儀檢測糖化血紅蛋白(hemoglobina1c,HbA1c)水平。用南京生物技術有限公司提供的NO測定試劑盒,采用偶氮偶聯比色法檢測NO濃度。由天津瑞愛金生物科技有限公司提供的試劑盒,愛得康ELISA400全自動酶免工作站采用酶聯免疫法檢測AGEs水平。
1.4 統計學處理方法 采用SPSS19.0軟件進行統計學處理。計量資料用表示,多組比較采用單因素方差分析。P<0.05為差異有統計學意義。
2 結果
2.1 3組患者FPG、PPG、HbA1c指標比較 有癥狀DPN組的FPG、PPG、HbA1c水平均明顯高于無癥狀DPN組及單純T2DM組,差異有統計學意義(P<0.01)。無癥狀DPN患者的FPG、PPG、HbA1c水平均高于單純T2DM患者,差異有統計學意義(P<0.05)。見表1。
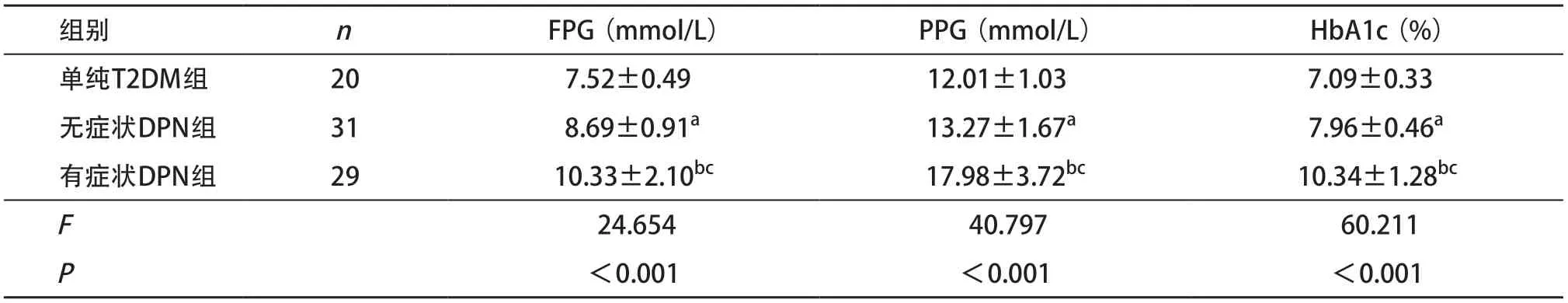
表1 3組患者FPG、PPG、HbA1c指標比較
2.2 3組患者TG、TC、LDL-c、HDL-c、APOa、APOb指標比較 3組患者的TG、TC、LDL-c、HDL-c、APOa、APOb水平差異均無統計學意義(P>0.05),見表2。
表2 3組患者TG、TC、LDL、HDL、APOa、APOb指標比較nmol/L)
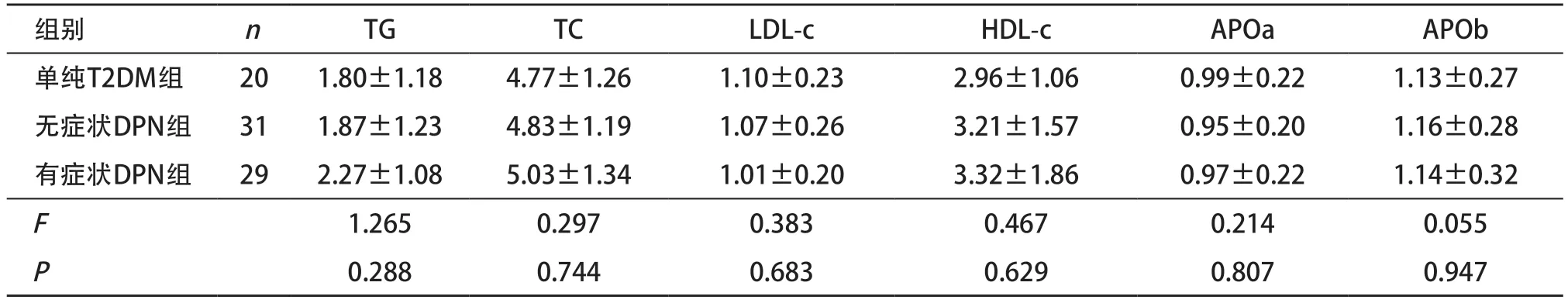
表2 3組患者TG、TC、LDL、HDL、APOa、APOb指標比較nmol/L)
組別 n TG TC LDL-c HDL-c APOa APOb單純T2DM組 20 1.80±1.18 4.77±1.26 1.10±0.23 2.96±1.06 0.99±0.22 1.13±0.27無癥狀DPN組 31 1.87±1.23 4.83±1.19 1.07±0.26 3.21±1.57 0.95±0.20 1.16±0.28有癥狀DPN組 29 2.27±1.08 5.03±1.34 1.01±0.20 3.32±1.86 0.97±0.22 1.14±0.32 F 1.265 0.297 0.383 0.467 0.214 0.055 P 0.288 0.744 0.683 0.629 0.807 0.947
2.3 3組患者NO、AGEs指標比較 與單純T2DM組比,2組DPN患者血清NO均明顯下降,差異均有統計學意義(P<0.01);2組DPN患者血清AGEs水平明顯高于單純T2DM組,差異均有統計學意義(P<0.01);2組DPN患者間血清NO、AGEs水平差異有統計學意義(P<0.01)。見表3。
3 討論
T2DM并發的神經損害最常累及周圍神經,稱為DPN,表現為遠端對稱的多發性神經病變,主要病理特點為微血管改變、神經纖維缺失、軸索變性及脫髓鞘。早期可沒有臨床表現,但NCV的減退和異常在臨床無癥狀時早已存在。目前對于無癥狀DPN的診斷缺乏統一標準,神經電生理檢查曾一度被視為金標準[11]。
DPN涉及復雜而相互關聯的發病機制,但可以肯定與長期高血糖所致代謝紊亂相關[12]。糖參與的外周神經損傷機制包括線粒體功能障礙及氧化應激、多元醇通路激活等[13]等諸多因素相互影響,從而導致運動、感覺、自主神經功能的缺失。本研究結果顯示3組患者的FPG、PPG、HbA1c水平有明顯差異,且單純T2DM組、無癥狀DPN組、有癥狀DPN組患者的FPG、PPG、HbA1c平均水平是逐漸升高的。
表3 3組患者NO、AGEs指標比較(,mmol/L)
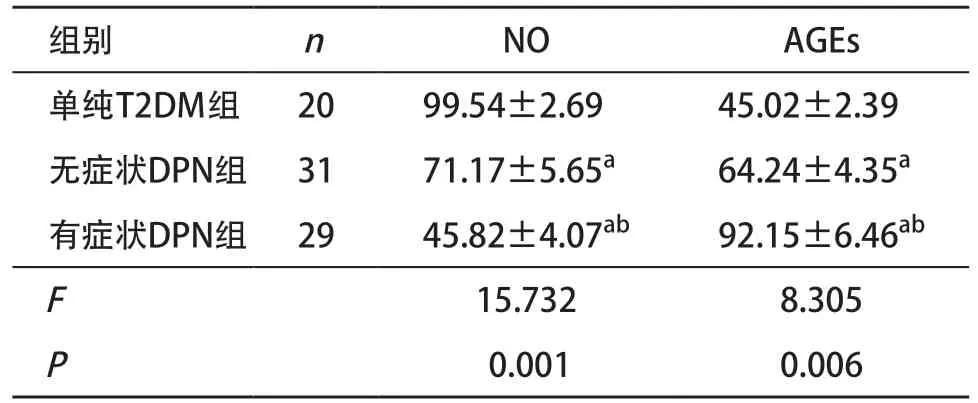
表3 3組患者NO、AGEs指標比較(,mmol/L)
與單純T2DM組比:aP <0.01;與無癥狀DPN組比:bP <0.01
組別 n NO AGEs單純T2DM組 20 99.54±2.69 45.02±2.39無癥狀DPN組 31 71.17±5.65a 64.24±4.35a有癥狀DPN組 29 45.82±4.07ab 92.15±6.46ab F 15.732 8.305 P0.001 0.006
氧化應激是導致DPN發生的關鍵,AGEs途徑是經典的氧化應激途徑,是DPN發生的重要因素。持續高血糖的環境下蛋白質、脂質或核酸等大分子物質在沒有酶參與的條件下自發地與葡萄糖或其他還原單糖反應生成穩定的共價化合物所形成的不可逆聚合物稱AGEs[13]。AGEs在DPN中的可能作用機制很多。DM患者糖、脂代謝紊亂,導致神經組織缺血、缺氧,引起氧化應激增強、自由基增多,最終使AGEs形成過多。本研究結果顯示3組患者的TG、TC、LDL-c、HDL-c、APOa、APOb水平差異均無統計學意義。有資料證明AGEs的水平變化可反映患者長期的糖代謝控制狀態,并參與DM慢性并發癥的病理過程[14]。
有研究顯示AGEs與高血糖、氧化應激等相互交叉、相互作用,影響DPN的發生、發展[15]。湯運梁等[16]研究發現AGEs的含量與DM并發癥的發生及其嚴重程度呈正相關。陳曉等[17]證實初診DM患者血清AGEs水平明顯高于正常人。但這2個研究均未明確具體診斷閾值。而李玉桂等[18]的研究結果顯示AGEs水平在合并DPN患者的血清及神經組織中明顯高于未合并DPN組,這與本研究結果一致。本研究結果顯示2組DPN患者血清AGEs水平均明顯高于單純T2DM組,且有癥狀組DPN患者血清AGEs水平明顯高于無癥狀組DPN患者。
高糖環境下AGEs產生增多,還可作用于全身血管,導致微血管與大血管病變;AGEs對神經血管的損傷主要是誘發血管內促炎、促凝血反應,增加血管通透性,導致血管舒張功能障礙,繼而引發神經組織的缺氧及代謝性損傷[19],導致NCV的下降。李玉桂等[19]的研究證實AGEs與正中神經MNCV、正中神經SNCV、腓總神經MNCV、腓總神經SNCV呈負相關。
NO與多種疾病的發生、發展有關,在神經損傷中的作用現已得到廣泛研究[20]。NO可通過血管內皮細胞釋放血管舒張因子,使血管平滑肌松弛和血管舒張[21-22]。NO還參與神經傳遞,主要通過調節血管而作用于神經,也能通過調節代謝而影響神經。血糖長期處于高水平狀態,導致血管內皮受損,NO生成降低,使得血管舒張障礙,長期作用導致神經纖維變性、失活,減慢NCV[23]。有研究證實DPN患者存在血清NO水平下降[24]。這與本研究結果一致,與單純T2DM患者比,2組DPN患者血清NO均明顯下降;2組DPN患者間血清NO水平差異也有統計學意義。因此,血清NO水平與神經系統的功能損傷相關。石清等[25]研究結果表明血清NO水平與DPN的發生密切相關,NO可作為預測DM神經損害程度的指標及重要標志物。
綜上所述,臨床上早期無癥狀DPN發病率高,起病隱匿,應特別關注。NO、AGEs是重要的生物信號和效應分子,兩者相互關聯、相互影響,共同作用導致DPN的發生。早期檢測NO、AGEs有助于早發現無癥狀DPN,并可了解其周圍神經病變的程度。DPN的早期階段是可逆的[26]。高血糖狀態是DPN發病過程中重要的誘因,也是導致機體代謝紊亂的重要原因[27]。高血糖引起的代謝紊亂直接影響神經細胞的代謝,而血糖控制有助于DPN的改善。因此,從根本上說,DPN發病與血糖濃度密切相關,控制血糖對降低DPN的發病率具有非常重要的臨床意義。

