沉默TUG1基因對肝門部膽管癌QBC939細胞增殖、凋亡及周期的影響
車 宇,梁 靜,楊怡萍,廖 娟,王 蒨,蔡英全,邵 帥
陜西省腫瘤醫院放療科(西安710061)
肝門部膽管癌起源于肝門部膽管內皮,具有高度的侵襲性,其發病率占膽管癌總體發病率的50%~80%[1]。流行病學研究顯示,近些年來肝門部膽管癌發病率呈現逐年增高的趨勢,是惡性程度最高的腫瘤之一[2]。根治性手術為目前治療肝門部膽管癌最有效的方法。然而,肝門部膽管癌起病隱匿,大多數患者就診時已處于中晚期,由于腫瘤已發生遠處轉移,導致患者失去最佳治療時機。此外,盡管中西醫結合的綜合治療方案能顯著延長腫瘤患者生存周期[3]。但是,肝門部膽管癌術后易發生局部復發,即使患者接受了根治性手術治療和中西醫結合綜合治療方案,術后5年生存率仍小于30%[4]。為了改善肝門部膽管癌的治療效果,尋找與肝門部膽管癌發生、發展相關的分子靶點也顯得尤為迫切。微小RNA(microRNA,miRNA)和長鏈非編碼RNA(Long noncoding RNA,Lnc RNA)是非編碼RNA 家族的兩個主要成員。已有大量研究表明miRNA 在膽管癌發生、發展中起著至關重要的作用[5]。然而,關注LncRNA 在膽管癌發生發展中作用的相關研究尚不多見。Lnc RNA 為轉錄本長度大于200 nt 不具備蛋白編碼功能的一類RNA[6]。研究表明,Lnc RNA 作為染色體組裝、轉錄層面以及轉錄后層面的關鍵調控因子而參與幾乎所有的生理進程[7-8]。牛磺酸上調基因1(Taurine-upregulated gene 1,TUG1)是大小為7.1 kb的LncRNA,首次發現于牛磺酸處理的小鼠視網膜細胞上調表達的基因中[9]。研究表明肝內膽管癌織中上調的TUG1 可通過競爭性結合miR-145 而促進腫瘤細胞增殖及轉移[10]。然而,另有研究表明TUG1在乳腺癌中表達下調,并通過調控CyclinD1和CDK 的表達而抑制腫瘤細胞增殖[11]。但在肝門部膽管癌中TUG1的功能和潛在機制尚不清楚。本研究擬深入闡明肝門部膽管癌細胞系QBC939中TUG1表達及其對細胞增殖及凋亡的影響。
材料和方法
1 實驗材料 TRIzol試劑購于碧云天生物技術研究所,RNA 反轉錄試劑購于Ta KaRa公司,TUG1-siRNA 由上海吉瑪公司設計并合成,LipofectamineTM2000 試 劑 購 于Invitrogen 公 司,MTT 試 劑 盒 購 于Promega公司;FITC標記的Annexin-V及PI試劑購于BD公司,人肝內膽管上皮細胞系HIBEpic和肝門部膽管癌細胞系QBC939均購于中國科學院上海細胞庫。
2 實驗方法
2.1 細胞培養和轉染:人肝內膽管上皮細胞系HIBEpic和肝門部膽管癌細胞系QBC939 采用1640培養液進行培養,其中含胎牛血清濃度為100μl/ml。細胞培養條件設置為溫度37℃,CO2濃度設置為5%。當細胞匯合度至70%~80%行細胞轉染操作。轉染試劑為LipofectamineTM2000。配置轉染反應液A:5 μl TUG1-siRNA 或TUG1 NC+250μl無血清培養基;配置轉染反應液B:5μl轉染試劑+250μl無血清培養基。將轉染反應液A 與B混合,孵育15 min,逐滴滴加至QBC939細胞中。繼續培養48 h后,收集細胞進行后續實驗。將轉染TUG1 siRNA 的QBC939細胞命名為TUG1-siRNA 組,將轉染TUG1 NC 的QBC939細胞命名為TUG1-NC組。
2.2 TUG1表達水平檢測:待肝門部膽管癌細胞轉染TUG1-siRNA 及TUG1-NC 48 h后,收集細胞,用TRIzol裂解TUG1-siRNA 組、TUG1-NC 組細胞,分別提取各組細胞總RNA,反轉錄為cDNA 作為qRT-PCR 模板。配置qRT-PCR 反應液,TUG1正向引物及反向引物各1μl、2×qRT-PCR 反應液10μl、熱啟動Taq 酶1μl、cDN 模 板1μl、去 離 子 水6μl。qRT-PCR 的反應條件設置為:95℃5 min預變性,而后進行35個循環的95℃20 s變性,60℃30 s退火,68℃20 s延伸。根據2—ΔΔCt計算各組細胞中TUG1的表達水平。
2.3 MTT 法檢測QBC939的增殖:QBC939 細胞轉染TUG1-siRNA 及TUG1-NC 48 h 后,取對數生長期的TUG1-siRNA 組和TUG1-NC組細胞,吹散細胞至單細胞懸液,PBS清洗細胞后離心。離心機轉速設定為1000 r/min,離心時間設定為5 min。再次重懸細胞,細胞計數后接種細胞至96孔板,每孔接種細 胞5000 個,每 組 細 胞 各 接 種9 孔,共 鋪6 個96 孔板。將接種細胞后的96孔板置于同一細胞培養箱后分別培養1~6 d。在第1~6天相同時間點,分別取出一板細胞,加入20μl MTT 溶液(濃度預先調整為1.5 g/L)。將滴加MTT 溶液的細胞再次放回培養箱繼續培養4 h。而后,加入120μl DMSO 溶液。細胞變色后,酶標儀讀取TUG1-siRNA 組和TUG1-NC組吸光度值,繪制細胞生長曲線。
2.4 流式細胞儀檢測QBC939細胞凋亡:取轉染48 h 后 的TUG1-siRNA 組 和TUG1-NC 組QBC939細胞。胰酶消化后,吹散細胞至單細胞懸液,PBS 清洗細胞后離心。離心機轉速設定為1000 r/min,離心時間設定為5 min。重復清洗及離心步驟3 次后,加入100μl流式洗液重懸細胞。在避光狀態下向細胞中加入100μl 流式洗液和10μl Annexin-V 抗體(FITC標記,濃度預先調整為20μg/ml)。室溫條件下避光反應30 min。而后,再次加入5μl的PI染料(濃度預先調整為50μg/ml),室溫條件下避光反應15 min。加入2 ml流式洗液后離心,離心條件同前。重復清洗及離心步驟3 次后,加入500μl流式洗液,重懸細胞后,上流式細胞儀檢測TUG1-siRNA 組和TUG1-NC組細胞凋亡情況。
2.5 流式細胞儀檢測QBC939細胞周期:取轉染TUG1-siRNA 及TUG1-NC 48 h后的TUG1-siRNA組和TUG1-NC組QBC939細胞。胰酶消化后,吹散細胞至單細胞懸液,PBS清洗細胞后離心。離心機轉速設定為1000 r/min,離心時間設定為5 min。重復清洗及離心步驟3次后,加入100μl流式洗液重懸細胞。在避光狀態下向細胞中加入5μl PI染料(濃度預先調整為50μg/ml)。在避光環境反應10 min后,加入400 μl 流式洗液。立即利用流式細胞儀檢測TUG1-siRNA 組和TUG1-NC組細胞周期。
3 統計學方法 應用IBM SPSS 22.0統計學軟件對本研究所得數據進行統計分析,計量資料以(±s)表示,應用t檢驗分析兩組間數據的差異,以P<0.05視為差異具有統計學意義。
結 果
1 TUG1在人肝內膽管上皮細胞系與肝門部膽管癌細胞系中的表達 分別提取人肝內膽管上皮細胞系HIBEpic和肝門部膽管癌細胞系QBC939 細胞的總RNA,各自反轉錄為cDNA,熒光實時定量RTQPCR 檢測各組間TUG1的表達,發現在QBC939細胞中TUG1表達較HIBEpic中明顯上調(t=10.936,P<0.01),見圖1。
2 TUG1-siRNA 下調QBC939細胞中TUG1的表達 轉染TUG1-NC 及TUG1-siRNA 于肝門部膽管癌QBC939細胞48 h后,分別提取TUG1-NC組及TUG1-siRNA 組細胞總RNA,各自反轉錄為cDNA,熒光實時定量RT-QPCR 檢測TUG1-NC 組及TUG1-siRNA 組中TUG1的表達,發現在QBC939細胞中,TUG1-siRNA 組中TUG1表達較TUG1-NC組明顯下調(t=8.827,P<0.01),見圖2。

圖1 HIBEpic和QBC939細胞中TUG1表達水平
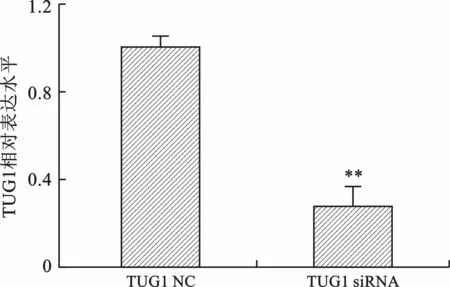
圖2 qRT-PCR 檢測TUG1 siRNA 的沉默效率
3 TUG1-siRNAs抑制QBC939 細胞的增殖 MTT 檢測分別轉染TUG1-NC與TUG1-siRNA 的QBC939細胞的細胞增殖能力差異,TUG1-siRNA 組細胞的增殖能力明顯弱于TUG1-NC 組細胞,兩組細胞增殖能力比較差異具有統計學意義(F=10.827,P=0.014),TUG1可顯著促進QBC939細胞增殖,見圖3。
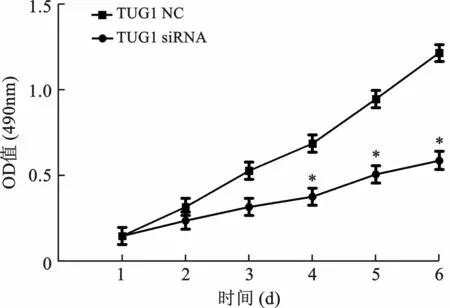
圖3 TUG1-siRNA 抑制QBC939細胞增殖能力
4 TUG1-siRNAs促進QBC939 細胞的凋亡 流式細胞術檢測分別轉染TUG1-NC 與TUG1-siRNA 的QBC939 細胞的細胞凋亡水平差異,TUG1-siRNA 組細胞的細胞凋亡比例明顯高于TUG1-NC組(t=3.291,P=0.028),提示TUG1可抑制QBC939細胞的凋亡,見圖4。
5 TUG1-siRNAs阻滯QBC939細胞于G1期 流式細胞術檢測分別轉染TUG1-NC 與TUG1-siRNA 的QBC939 細胞的細胞周期分布差異,轉染TUG1-siRNA 細胞的G1期細胞比例明顯高于TUG1-NC組(t=3.293,P=0.023),而轉染TUG1-siRNA細胞的S期細胞明顯少于TUG1-NC組(t=2.892,P=0.027),見圖5。
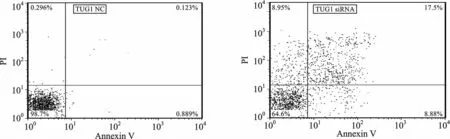
圖4 TUG1-siRNA 增強QBC939細胞凋亡水平
討 論
Lnc RNA 的發現已經極大的改變了我們對于腫瘤發病機制的認識。近來,越來越多研究表明腫瘤中異常表達的Lnc RNA 在腫瘤的發生、腫瘤細胞增殖、腫瘤侵襲等多方面扮演著重要的作用[12-13]。LncRNA MALAT1可通過競爭性結合miR-204 表達而調控CXCR4的表達,從而促進肝門部膽管癌細胞增殖、侵襲 及 轉 移[14]。LncRNA-PVT1 通 過 與PCR2 復 合 體結合而調控ANGPTL4組蛋白甲基化水平,從而抑制其表達的表達,進而促進膽管癌細胞增殖抑制其凋亡[15]。另有研究發現Lnc RNA EPIC1在膽管癌患者組織中表達異常上調,并可通過抑制Myc的表達而促進膽管癌細胞增殖及克隆形成能力[16]。然而,目前肝內膽管癌發生及進展過程中LncRNA 所發揮功能的相關報道尚不多見。

圖5 TUG1 siRNA 阻滯細胞周期于G1期
本研究檢測了人肝內膽管上皮細胞HIBEpic與肝門部膽管癌細胞系QBC939中TUG1的表達,實驗發現TUG1 在QBC939 中的表達顯著高于HIBEpic中的表達,提示TUG1可能在肝門部膽管癌發生發展中發揮著重要的作用。最新研究顯示,LncRNA 的表達可被一些轉錄因子調控。TUG1被證實作為腫瘤抑制LncRNA 并 被p53 調 控[17]。然 而,另 有 研 究 報 道TUG1 可作為致癌LncRNA 被轉錄因子SP1 調控[18]。為了進一步明確TUG1在肝門部膽管癌發生、發展中的作用,我們利用RNA 干擾技術沉默QBC939細胞中TUG1的表達,研究TUG1對肝門部膽管癌細胞增殖、凋亡、周期的影響。實驗發現沉默QBC939細胞TUG1的表達可導致細胞增殖能力明顯降低,以上結果提示TUG1 可以增強肝門部膽管癌腫瘤細胞生長。與此同時,本研究還發現細胞凋亡水平的增加、G1期細胞比例增多、S 期細胞比例減少,可能是TUG1-siRNA 抑制肝門部膽管癌細胞的潛在機制。以上結果提示TUG1可能通過調控細胞凋亡和周期而促進腫瘤細胞增殖。
綜上所述,本研究檢測了正常肝內膽管上皮細胞與肝門部膽管癌細胞中TUG1 的表達差異,并利用RNA 干擾技術沉默QBC939 細胞中TUG1 的表達,檢測TUG1 在QBC939 細胞增殖、凋亡、周期中的作用。研究發現沉默TUG1 表達可以抑制肝門部膽管癌細胞增殖,促進肝門部膽管癌細胞的凋亡,并誘導細胞周期阻滯于G1期。本研究為進一步研究肝門部膽管癌發生及進展過程中TUG1所發揮的調控作用的潛在機制奠定了初步的理論基礎,也同時有望為肝門部膽管癌的分子治療提供潛在靶點。

