糖尿病、冠狀動脈疾病及兩病并存患者基因表達差異分析
宮蕊 熱依拉·牙合甫 張國亮 任珊 陳曼麗 陳孟暉 李海濱 趙成
2型糖尿病(T2DM)和冠狀動脈疾病(CAD)密切相關,影響公眾健康,加重了經濟負擔。冠狀動脈疾病是2型糖尿病的常見并發癥,其中斑塊形成致使冠狀動脈變窄,嚴重程度影響患者冠狀動脈疾病分級。T2DM和CAD常常與POMP、肥胖等疾病同時存在。T2DM與CAD具有諸多共同危險因素,如年齡,性別,體重,生活方式,心理社會壓力和暴露于環境污染物等,兩者均具有慢性炎癥[1,2]和凝血系統紊亂特征[3]。2型糖尿病與心血管疾病發生以及死亡風險增加密切相關[4,5]。潛在機制與胰島素抵抗、非自主調節脂質代謝、凝血異常、動脈壁生物反應效應易感基因之間復雜的相互作用等有關[6]。Wu等[7]發現2型糖尿病,肥胖和冠狀動脈疾病在基因敏感區域(bin 9.3和6.5)均有表達共享。基因組信息(正常狀態、疾病相關),尤其是在高通量技術對認識疾病的復雜生物過程具有重要價值[8]。本研究通過比較2型糖尿病和冠狀動脈疾病基因表達譜,探討兩者之間的關聯性。
1 資料與方法
1.1 一般資料 收集確診患者及健康者(對照組)共計20例。其中T2DM患者2例,CAD患者2例,T2DM合并CAD者6例(T2DM+CAD),對照組10例。T2DM患者符合世界衛生組織診斷標準[9];PCI術后、CABG患者以及冠脈CTA血管限流>75%患者作為CAD患者入組標準[10]。T2DM與CAD并發患者滿足上述2個入選標準。對照組為健康人群,年齡性別比例符合試驗要求。本研究無藥物干預同時不干預患者用藥,通過倫理審批,向所有受試者提供書面知情同意書。
1.2 主要試劑與儀器 TRIZOL試劑;TruSeq RNA文庫制備試劑盒 Ribo-Zero Magnetic kit;random primer;Superscript III;USER酶;三氯甲烷、異戊醇、無水乙醇(分析純);DEPC water;低溫高速離心機;ABI7500型快速實時熒光定量PCR儀;Nanodrop ND-2000超微量紫外分光光度計;Hiseq2500。
1.3 主要統計平臺及軟件TopHat v1.3.1 軟件;Cufflinks v1.0.3軟件;GENECODIS軟件;Cytoscape軟件;bwa軟件;SeqPrep軟件;GOrilla軟件。
1.4 qRT-PCR檢測 使用Trizol試劑從血液樣品中提取總RNA。使用Nanodrop ND-2000分光光度計測量RNA的質量和數量。RNA完整性檢測方法:Agilent 2100、瓊脂糖凝膠電泳(瓊脂糖凝膠濃度:1%瓊脂糖膠;電壓:5 V/cm;時間:20 min)。
1.5 建庫測序 PCR擴增15個cycles,后應用HiSeq TM 2500平臺第二代高通量測序技術對mRNA進行測序,進行測序。通過去接頭、去低質量、去污染變性稀釋后的文庫加入到鞘流池(FlowCell)內,與FlowCell 上的接頭雜交,完成數據的處理,得到最終數據。
1.6 分析數據 實驗對mRNA數據分別進行了標準分析及mRNA共表達分析。樣本數≥6時,使用Pearson相關系數法分析樣本間mRNA與蛋白編碼基因的相關性。該分析中,采用Pearson相關系數法分析樣本間mRNA與蛋白編碼基因的相關性,閾值使用0.9。
1.6.1 差異表達基因分析:應用TopHat v1.3.1軟件[11]將原始測序所得與UCSC(University of California Santa Cruz)人類參考基因組(Build hg19)進行比對。利用Cufflinks v1.0.3軟件對原始比對文檔進行處理,衡量轉錄樣本豐度[12];鑒別差異表達基因:應用配對t檢驗用于鑒別差異表達基因。P<0.05作為基因表達顯著差異的標準。用pheatmap熱圖代碼R函數/Bioconductor包對差異表達基因執行層次集群聚類計算;差異表達基因功能富集分析:應用在線軟件GENECODIS對差異表達基因,采用基因本體論數據(GO)富集分析和京都基因基因組百科全書(KEGG)通路分析方法,進行生物學功能注釋[13]。GOrilla軟件驗證GO分析結果。
1.6.2 蛋白-蛋白相互作用網絡構建:基于在線數據庫生物相互作用通用數據集(BioGRID,http://thebiog rid.org/),建立蛋白相互作用網絡(PPIs)[14,15],應用Cytoscape軟件對所選基因在PPI網絡中的分布特征進行可視化處理。PPI網絡中的節點表示蛋白質,而鏈接點之間的邊表示2個蛋白質之間的相互作用聯系。
1.7 通過GSE23561基因表達驗證 依據以往的研究和數據庫注釋選擇GSE23561數據集(GEO,http:// www.ncbi.nlm.nih.gov/geo)[16]。證實篩選的主要差異表達基因。從而證明本研究高通量數據分析的準確性,以期彌補樣本量小可能帶來的差異表達基因測序的單芯片假陽性或假陰性可能。
2 結果
2.1 轉錄組測序分析 CAD、T2DM、T2DM+CAD以及對照組,測定生成3.28 ×107,2.88×107,3.30×107和2.28×107條測序讀數。與選擇的UCSC數據庫提供的人類參考基因組Build hg19進行對比,各組具有獨特相對總讀數分別為2.17×107,1.90×107,2.18×107和1.51×107。
2.2 組間基因差異表達
2.2.1 T2DM與對照組差異表達分析發現,T2DM有474個基因顯著差異表達,其中上調表達基因126個,下調表達基因348個。其中92個GO注釋的基因顯著差異表達。帕金森氏病的通路在T2DM組中高度富集表達(P=0.001),提示T2DM可能促進帕金森病的發生發展。見表1。
2.2.2 CAD與對照組差異表達分析:CAD有488個基因顯著差異表達,其中有400個基因是上調的另外88個下調表達。趨化因子信號通路是其中最顯著的富集途徑之一(P=6.14E-11)。見表2。
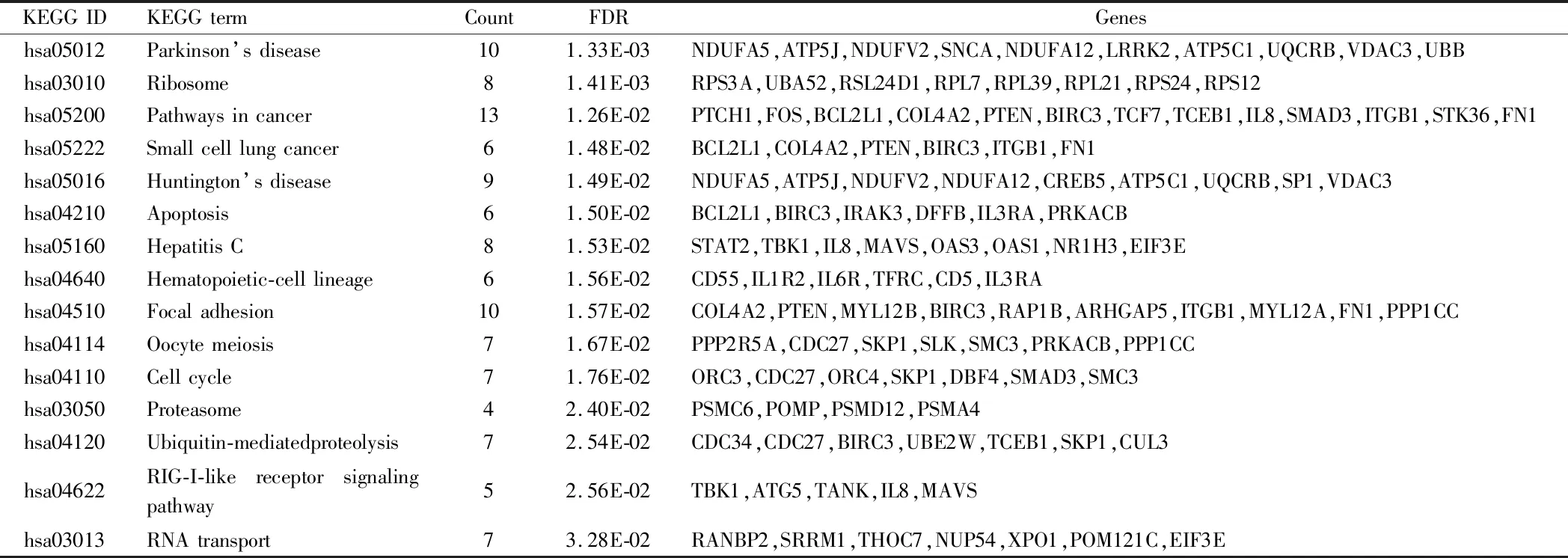
表1 T2DM中差異表達基因前15條顯著富集通路

表2 CAD中差異表達基因前15條顯著富集通路
2.2.3 T2DM+CAD與對照組差異表達分析:T2DM+CAD組總共分析發現439個差異表達基因,370個為上調表達基因,69個為下調表達基因。其中最顯著的富集通路為信號轉導(GO:0007165,P=2.94E-07) 以及抗細胞凋亡(GO:0006916,P=2.86E-06)。見表3。
2.3 CAD、T2DM、T2DM+CAD相關性 發現191個基因有較強的重疊表達。計算兩兩之間Spearman相關系數評價相關性。統計結果表明,CAD,T2DM,和T2DM + CAD者之間存在顯著的相關性(P<0.0001),其中T2DM與T2DM+CAD的相關性在外周血基因表達譜中最為顯著(Spearman’s rho=0.6757,P<0.0001)。CAD、T2DM和T2DM + CAD共同差異表達基因主要通過核糖體(P=2.77E-06),黏著斑(P=0.03),細胞凋亡(P=0.03),小細胞肺癌(P=0.03),RIG-I樣受體信號通路(P=0.03),礦物質吸收(P=0.04),白細胞跨內皮遷移(P=0.04)等通路參與差異表達。見表4。
2.4 疾病特異性PPI網絡圖 經過統計處理:最終得到47個基因涉及在T2DM特定PPI網絡關系圖。其中包括1 216個蛋白節點和1 579條相互聯系的邊。其中包括重要的樞紐蛋白TCF4 (Degree=169),SKP1 (Degree=164) 以及UBE2W (Degree=75),說明了它們在T2DM發生發展中起到了重要的作用;最終得到54個基因,與CAD特定PPI網絡關系圖。其中包括943蛋白節點和1 085條相互聯系的邊。54個基因中包括重要的樞紐蛋白有HIF1A (Degree=124),SMAD1 (Degree=112)以及SKIL (Degree=94),說明這3個基因在CAD的發生發展過程中起到了關鍵的作用。見圖1、2。

表3 T2DM + CAD組差異表達基因高表達通路
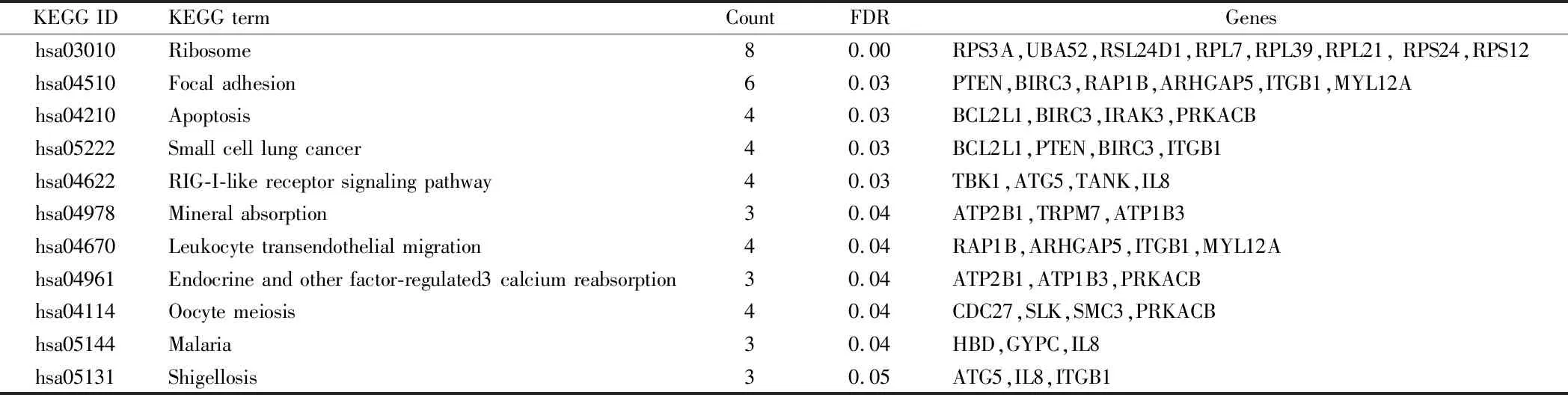
表4 T2D、CAD、T2D + CAD共同差異表達基因顯著富集通路
2.5 GSE23561基因數據庫基因表達驗證 選擇在CAD組中HIF1A,SMAD1和 SKIL顯著差異表達進行驗證,HIF1A,SMAD1和 SKIL為CAD特定PPI網絡圖中樞紐蛋白。在所選GSE23561基因數據庫提供的表達數據中,HIF1A,SMAD1以及SKIL基因在CAD組中全部為上調表達基因,T2DM與正常對照組相比SMAD1以及SKIL基因表達無統計學變化。HIF1A在CAD和T2D中表達不同。
3 討論
本研究應用RNA-seq識別T2DM、CAD以及兩病共存情況下外周血獨特的基因表達特征。比較了T2DM、CAD以及兩病共存條件下的基因表達譜,分析相關性,探索共存病理生理機制。
T2DM和CAD基因表達譜均表現為凝血系統功能紊亂,局部炎性反應與脂質代謝失調。T2DM和CAD的共同病理生理特征可能與類似共同遺傳變有關,如CDKN2A/2B,ADIPOR1[17]和TCF7L2基因的變異[18]。其中T2DM與T2DM + CAD的相關性最為顯著。重疊表達基因主要富集于GO注釋的病毒感染周期、抗細胞凋亡,內分泌腺胰腺的發育,先天免疫應答,凝血功能等通路。這些重疊基因主要參與核糖體相關的通路(RPS3A,UBA52,RSL24D1,RPL7,RPL39,RPL21,RPS24,RPS12)。
T2DM或CAD發展過程中起特殊作用的基因數據集發現,在T2DM特異性PPI網絡中,顯著的樞紐蛋白為TCF4 (Degree=169),SKP1 (Degree=164) 以及UBE2W (Degree=75)。其中TCF4,又名轉錄因子7-like 2 (TCF7L2),是編碼參與Wnt信號通路的轉錄因子。TCF4刺激胰腺β-cells的增殖,調節胰腺在胚胎發育時期的質量。并誘導腸內分泌細胞分泌胰島素促生長激素胰高血糖素樣肽-1 (GLP-1)[19],在血糖的穩態中起著至關重要的作用。且多研究表明TCF7L2基因型與T2DM之間存在相關性[20-24]。Meta分析發現TCF7L2 rs7903146基因的多態性與中國人群T2DM患病風險增加有關。CAD特異性PPI網絡研究發現, SMAD1和SKIL在CAD中特異性上調表達,在T2DM中無顯著變化; HIF-1α為HIF1A基因編碼轉錄因子,具有維持氧穩態功能。
HIF1A可能通過激活多種基因參與CAD的發生和發展與正常對照組相比,CAD患者的淋巴細胞和單核細胞中VEGF,HO-1,ET-1,HIF1A信使RNA表達顯著上調;HIF1A的表達水平與動脈粥樣硬化的嚴重程度和動脈硬化程度的間接評分具有高度相關性。一項研究表明,HIF1A多態性(rs11549465和rs11549467)與冠狀動脈疾病的臨床類型和冠狀動脈側枝的形成有關[20]。并且有相關研究證實HIF1A的rs2057482 SNP的多態性表達與早期CAD易感性的增加有關,可作為早期冠狀動脈疾病易感性標志物應用于臨床診斷[21]。
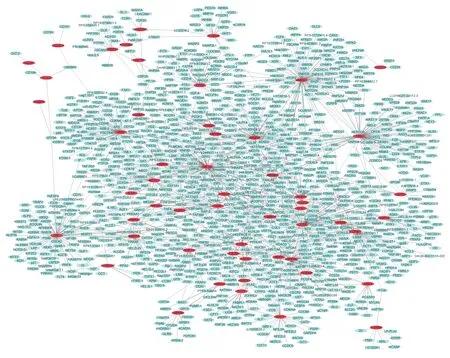
圖1 T2DM中64個失調基因PPI網絡圖;紅色節點表示上調基因,藍色節點表示下調基因;粉紅色的節點表示與差異表達基因相互作用的基因,較大的圖標表示樞紐蛋白
有證據表明HIF1A多態性(g.C45035TSNP、rs11549465)與T1DM和T2DM均存在相關性[22]。并且HIF1A可以過綁定ARNT啟動子造成小鼠β細胞特定HIF1A破壞,影響β細胞功能[23]。HIF1A在缺血性心肌細胞高血糖狀態時抑制HIF-1αm RNA表達,抑制HIF-1α缺血應答[24,25],表明心肌梗死事件發生時以及隨后的死亡率與高血糖狀態正相關。
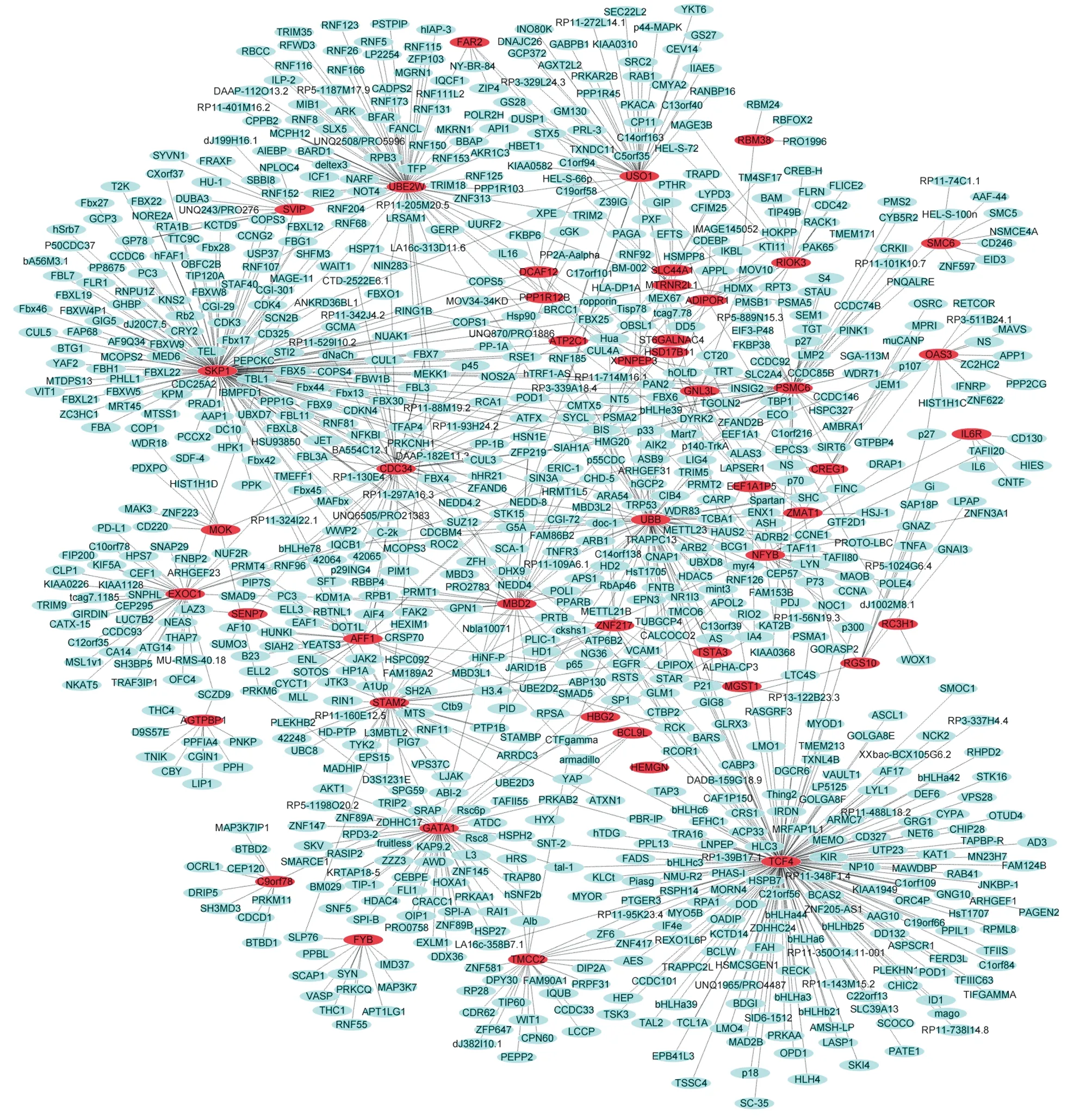
圖2 CAD中69個失調表達基因PPI網絡圖;紅色節點表示上調基因,藍色節點表示下調基因;粉紅色的節點表示與差異表達基因相互作用的基因,較大的圖標表示樞紐蛋白
SMAD1和SKIL均參與SMAD通路,它們在冠狀動脈疾病中均顯著上調表達,在2型糖尿病中表達無變化。Tseng 等研究發現,SMAD1多態性與冠狀動脈疾病患者心臟驟停有關[26]。在心臟特異性過表達SMAD1的轉基因小鼠模型中,發現轉基因小鼠缺血再灌注損傷(I/R)后心肌梗死明顯減少,心肌細胞凋亡數量明顯減少,提示SMAD1具有在缺血再灌注損傷后心臟保護中的作用[27,28]。SKIL是SMAD通路組成部分,被證明參與了心臟細胞纖維化的過程[29,30]。
TCF4、SKP1與UBE2W為2型糖尿病的關鍵調控基因;HIF1A、SMAD1與SKIL為冠狀動脈疾病的關鍵調控基因。CAD樞紐蛋白為HIF1A,SMAD1與SKIL三個基因在CAD的發生發展過程中起到了關鍵作用。HIF1A在CAD患者中呈現上調表達趨勢;SMAD1和SKIL基因在冠狀動脈疾病中顯著上調表達,具有缺血再灌注保護作用。冠狀動脈疾病、2型糖尿病、2型糖尿病+冠狀動脈疾病,之間存在共有的調控基因,可能具有相似的病理分子機制。

