外源信號分子誘導處理對甜瓜抗病MAPK基因表達的影響
鄭賀云 李超 姚軍 廖新福 耿新麗
摘 要: 為了探討MAPK基因在甜瓜中的表達調控模式,以感病甜瓜品種‘哈密加格達和抗病甜瓜品種‘Edisto47為試驗材料,采用實時定量PCR(qRT-PCR)方法,研究了外源信號分子茉莉酸甲酯(MeJA)、脫落酸(ABA)和褪黑素(MT)誘導處理甜瓜葉片中MAPK基因的表達情況。結果表明,甜瓜品種中3個MAPK相關基因MAPK21、MAPK20、MAPK9在接種白粉病菌后均出現了上調表達,MeJA處理抗病甜瓜品種后,3個基因在36 h的相對表達量達到最高,分別為130.74、107.74和99.71,處理感病甜瓜品種后,各基因在60 h的相對表達量達到最高,分別為29.32、18.35和17.34;ABA和MT處理也是同樣的變化趨勢,但表達量低于MeJA處理,由此說明3個MAPK基因在抗病甜瓜品種中的相對表達量顯著高于感病品種,MAPK21基因相對表達量高于MAPK20和MAPK9,且MeJA處理的甜瓜有助于MAPK21基因表達調控,提高其抗白粉病的能力。
關鍵詞: 甜瓜; 外源信號分子; MAPK基因; 表達分析
Abstract: In order to investigate the gene expression involved in MAPK signal transduction pathway in melon, the susceptible melon cultivar ‘Hamijiageda and disease-resistant melon cultivar ‘Edisto47 melon were used as test materials, the expression of the MAPK genes were studied by quantitative reverse-transcription polymerase chain reaction(qRT -PCR), the external signal molecules were methyl jasmonate (MeJA), abscisic acid (ABA) and melatonin (MT). The results showed that the expressions of MAPK21, MAPK20 and MAPK9 in melon varieties were up-regulated after being inoculated with powdery mildew. The disease-resistant melon cultivar 's expression of three MAPK genes was the largest after MeJA treatment for 36 hours, and the expression respectively were 130.74、107.74 and 99.71. The susceptible melon cultivars expression of three MAPK genes was the largest after MeJA treatment for 60 hours, and the expression respectively were 29.32、18.35 and 17.34; ABA and MT change trend was same variation tread with MeJA, but the expression leave lower than MeJA processing, It was concluded that the relative expression of MAPK genes in disease-resistant melon cultivar significantly higher than that of cultivars. Compared with the MAPK20 and MAPK9, the relative expression MAPK21 gene was higher, the MeJA treatment will help MAPK21 gene expression regulation, improve the resistance to powdery mildew.
甜瓜是葫蘆科(Cucurbitaceae)香瓜屬(Cucumis)一年蔓生草本植物,在我國具有悠久的栽培歷史,且栽培面積居世界前列[1]。其中,新疆栽培面積更大,是當地農民創收的主要經濟作物之一。然而,甜瓜白粉病是當地生產中廣泛發生的重要病害之一,在很大程度上制約了當地甜瓜產業的健康發展,如果預防不到位將造成甜瓜植株葉片變黃萎蔫以致大面積枯死,對甜瓜的產量和品質帶來很大危害[2]。挖掘甜瓜優異抗病基因資源用于抗病新品種的培育,是從根本上解決甜瓜白粉病病害的有效途徑[3]。
促分裂原活化蛋白激酶級聯途徑(Mitogen-activated protein kinases, MAPKs)是在真核生物中廣泛存在的一種十分重要的保守信號傳導系統,在調節生物體對環境的主動適應過程中占非常重要的作用,通常包括3個級別的功能蛋白激酶,分別是促分裂原活化蛋白激酶激酶激酶(MAPKKK)、促分裂原活化蛋白激酶激酶(MAPKK)和促分裂原活化蛋白激酶(MAPK)[4-5]。隨著各園藝作物基因組測序的完成,大量的MAPK級聯途徑基因家族成員先后從擬南芥、煙草、番茄、草莓、黃瓜、西瓜等[6-11]園藝作物中鑒定出來。其中MAPK受信號分子或細胞外刺激,經過MAPK級聯反應(MAPKKK—MAPKK—MAPK)而激活的絲氨酸/蘇氨酸蛋白激酶,通過蛋白質磷酸化作用響應外界信號并通過上游信號級聯放大并傳遞至細胞內的蛋白激酶,在調控植物的生長發育、脅迫響應及抗病反應等許多生理生化過程中起重要作用[12]。筆者所在課題組前期研究發現,甜瓜MAPK 3個基因參與了由水楊酸(SA)、乙烯利(ETH)和南瓜白粉病病原菌介導的植物抗病防衛反應的基本信號通路,初步判斷了MAPK 3個基因在甜瓜中的表達功能[13]。該試驗在前期研究的基礎上,以甜瓜感白粉病品種‘哈密加格達、抗白粉病品種‘Edisto47為試驗材料,采用MeJA、ABA和MT作為外源信號分子進行處理,無菌水處理作為對照。調查感病率并采用熒光定量PCR技術分析甜瓜抗白粉病相關基因MAPK21、MAPK20和MAPK9的差異表達,通過外源誘導提高甜瓜抗病基因MAPK的表達水平來防御甜瓜白粉病菌的侵染,以期找到防治甜瓜白粉病的高效新方法。
1 材料與方法
1.1 材料
試驗材料分別為感病品種‘哈密加格達和抗病品種‘Edisto47,2份種子購自國家西瓜甜瓜中期庫。其中‘哈密加格達為地方品種,原產于新疆吐魯番市鄯善縣,為厚皮甜瓜類型,果皮灰綠色,果面有粗網紋,果肉淺綠色,肉質脆,不抗白粉病;‘Edisto47是由南卡羅納州布萊克維爾大學選育的厚皮甜瓜品種,果皮深綠色,成熟后變成黃綠色,果實高圓,果面有粗網紋,肉質軟,高抗白粉病。
甜瓜白粉病菌生理小種Race 1由新疆農業大學西甜瓜分子育種實驗室提供。熒光定量PCR引物、反轉錄試劑盒等試材由奧科鼎盛生物有限公司提供、合成。
1.2 方法
2019年8—12月在河南科技學院園藝學院實驗室完成。選取飽滿無傷的甜瓜種子,消毒處理后經過28 ℃恒溫處理催芽,播種到50穴育苗盤中,置于人工氣候培養箱中生長,溫度25 ℃、相對濕度60%,16 h光照/8 h黑暗。
將白粉病病原菌接種于誘導培養基上震蕩培養,黑光燈誘導病原菌孢子的產生。制成濃度為1×106個·mL-1 的白粉病病原菌分生孢子懸浮液。
植株長出3~4片真葉后分別利用0.05 mmol·L-1 MeJA、0.03 mmol·L-1 ABA和 0.01 mmol·L-1 MT噴灑于甜瓜葉片表面,每個處理10株苗,3次重復,無菌水作為對照。在噴施2 d后接種甜瓜白粉病菌,扣小棚保持溫度在25~28 ℃、相對濕度大于90%、16 h光照/8 h黑暗。分別于接種后0、6、12、36、60、84、108、132 h進行感病率調查,并取其葉片迅速置于液氮中冷凍后放置-80 ℃冰箱中保存,為測定MAPK基因相對表達量做準備。感病率/%=感病株數/總株數×100。
MAPK引物由奧科鼎盛生物有限公司合成(表1)。采用CTAB法提取甜瓜總RNA,cDNA第一條鏈用PrimeScriptTMRT reagent Kit with gDNA Eraser合成試劑盒合成。以經過MeJA、ABA和MT不同時間處理的抗病和感病甜瓜葉片的cDNA為模板,PCR反應體系:模板1.0 μL,上、下游引物各0.8 μL(10 μmol·L-1,表1),dNTP Mix 10 μL(10 mmol·L-1),加 ddH2O補足至20.0 μL。PCR反應程序:95 ℃ 2 min,95 ℃ 30 s,60 ℃ 30 s,72 ℃ 30 s,33個循環,72 ℃ 10 min,4 ℃保持。PCR產物利用1%的瓊脂糖凝膠電泳檢測。
甜瓜MAPK基因片段的熒光定量PCR擴增反應體系:SYBR 10.0 μL,上、下游引物各0.8 μL,加入7.4 μL ddH2O補至19.0 μL,計算做出熒光定量試劑混合樣品,之后將混合樣分裝到96孔板中,每孔19.0 μL,每孔加入1.0 μL cDNA模板,每個處理的cDNA模板2次重復,覆膜離心混勻,反應程序:95 ℃預變性30 min,95 ℃變性10 min,59 ℃退火 30 min,95 ℃延伸10 min,65 ℃ 5 min,95 ℃ 5 min。
1.3 數據處理與分析
采用DPS 19.0數據處理軟件對試驗數據進行處理,并利用Excel 2003對數據進行作圖。
2 結果與分析
2.1 外源信號分子誘導處理后對2個甜瓜品種白粉病感病率的影響
由圖1可知,首先是抗病甜瓜品種感病率遠低于感病甜瓜品種,隨著白粉病菌接種時間的延長,感病品種感病率一直呈現上升趨勢,在132 h時,感病率達到96.67%,而抗病品種感病率為43.33%。在3個不同外源信號分子處理后,2個甜瓜品種的感病率與對照相比均有不同程度降低,不同外源信號分子處理對甜瓜白粉病的抗病效果不同,總體表現出一定的時間效應,表明MeJA、ABA、MT具有提高甜瓜白粉病抗性的作用。其中,MeJA處理下的抗病甜瓜品種感病率明顯低于對照,且隨著處理時間延長,感病率變化不大,趨勢平穩,MeJA處理下的感病甜瓜品種感病率明顯低于對照,且隨著處理時間延長,感病率呈現上升趨勢,MeJA處理后,對甜瓜白粉病的抗病效果誘導較佳,強于ABA、MT誘導效果,說明MeJA處理有助于提高甜瓜白粉病的抗性。
2.2 抗病和感病甜瓜葉片在不同外源信號分子誘導下MAPK基因表達量分析
經外源誘導處理后,抗病甜瓜品種‘Edisto47中MAPK21基因表達出現差異。對于每一個基因,相同時間點的處理組的表達量是對照組的3倍以上則差異顯著,如果它們之間的表達量差異為5倍及以上時,則差異極顯著[12]。由圖2可知,接種后立即測定MAPK21基因的表達量,CK表達量為2.30,隨著接種時間的延長,CK的MAPK21基因表達量出現上調趨勢,在接種36 h后表達量達到最高,其表達量為33.74,接種60、84、108和132 h變化趨勢比較平穩,說明MAPK21基因響應甜瓜白粉病菌脅迫處理。
用MeJA、ABA和MT處理接種白粉病菌的材料后立即測定MAPK21基因的表達量,其表達量分別為對照組的9.52倍、5.28倍和5.37倍,差異極顯著;隨著處理時間的延長,3個處理的MAPK21基因的表達量均出現上調趨勢,均在36 h后達到最高,MeJA處理為CK的3.87倍差異顯著,但ABA和MT處理分別為對照組的2.36倍和1.77倍,差異不顯著,說明MeJA處理誘導MAPK21基因上調表達效果顯著。
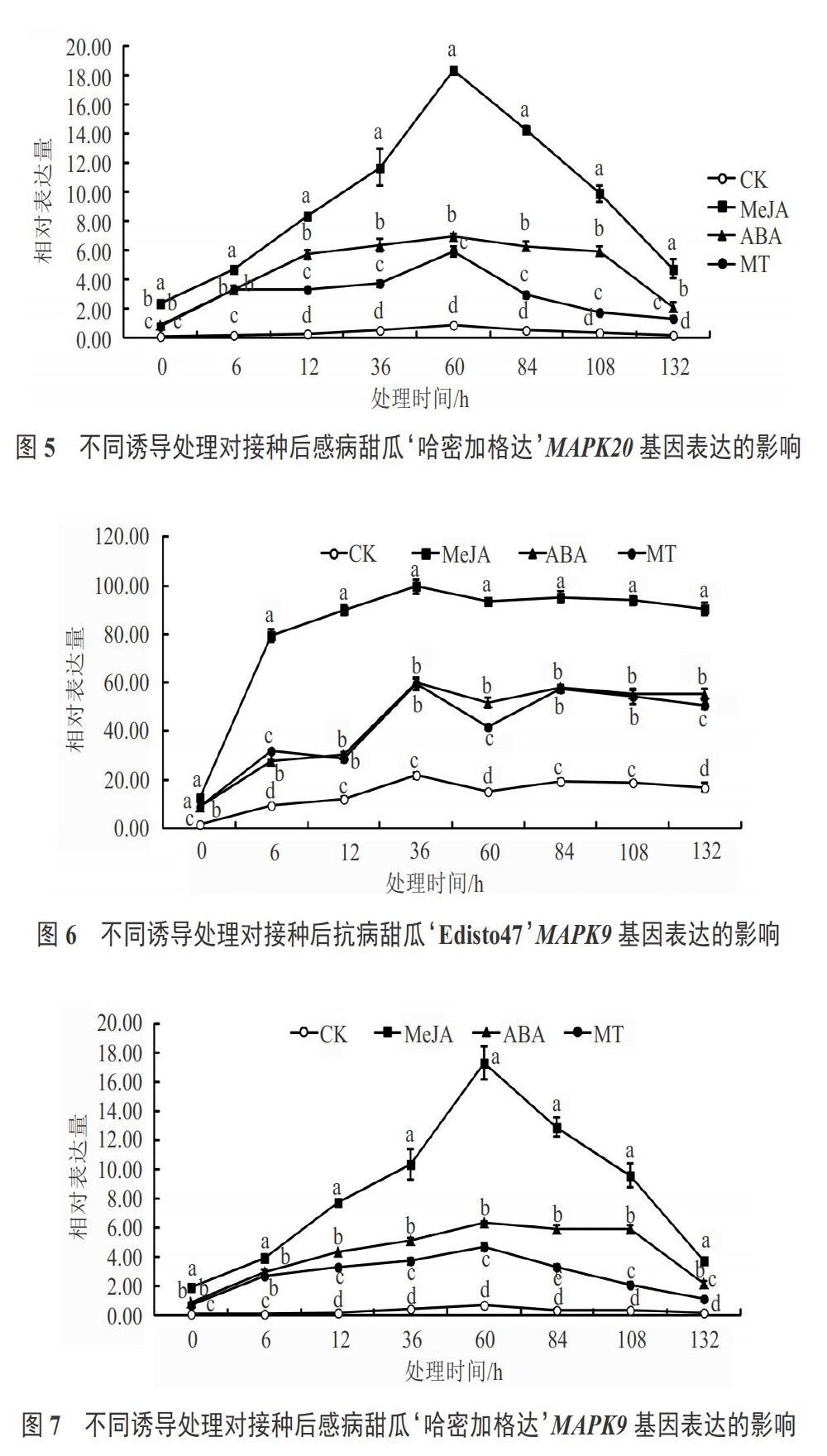
經外源誘導處理后,感病甜瓜品種‘哈密加格達中MAPK21基因表達出現差異。由圖3可知,接種后立即測定MAPK21基因的表達量,CK表達量為0.27,隨著接種時間的延長,CK的MAPK21基因表達量出現上調趨勢,在接種60 h后達到最高,其表達量為1.13,接種84、108、132 h出現下降趨勢,趨勢變化比較大,說明感病品種中MAPK21基因也響應甜瓜白粉病菌脅迫處理,但是表達量遠遠低于抗病品種。
用MeJA、ABA和MT處理接種白粉病菌的材料后立即測定處理表達量,其中MeJA處理MAPK21基因表達量為CK的15.96倍,差異極顯著;而ABA處理和MT處理表達量為CK表達量的4.85倍,差異顯著。隨著處理時間的延長,3個處理的MAPK21基因的表達量均在處理60 h后達到最高,各處理的MAPK21基因的表達量分別為對照組的25.95倍、8.78倍和5.26倍,都超過對照組的5倍以上,差異極顯著,但是MeJA處理表達量最高,說明MeJA處理誘導感病甜瓜品種后MAPK21基因上調表達效果最顯著,結合圖2結果發現,MeJA處理甜瓜品種,有助于MAPK21基因表達調控,提高其抗白粉病的能力。
對比圖2和圖3可以看出,3個處理誘導2個不同甜瓜品種的MAPK21基因相對表達量達到峰值的時間不同,抗病甜瓜品種均在36 h出現最高相對表達量,而感病甜瓜品種均在60 h才出現;MeJA處理的抗病甜瓜品種在36 h出現最高相對表達量為130.74,感病甜瓜品種在60 h出現最高相對表達量為29.32,抗病甜瓜品種MAPK21基因相對表達量是感病甜瓜品種的4.46倍,說明抗病甜瓜品種基因調控表達能力強。
由圖2和圖3還可以看出,MeJA、ABA和MT處理抗病甜瓜品種60、84、108、132 h后,抗病甜瓜品種MAPK21基因相對表達量變化趨勢比較平穩,說明抗病品種有助于防御白粉病菌,而處理的感病甜瓜品種84、108、132 h后,MAPK21基因相對表達量出現下降趨勢,說明隨著時間的延長,感病品種基因調節抵御白粉病菌的能力下降。
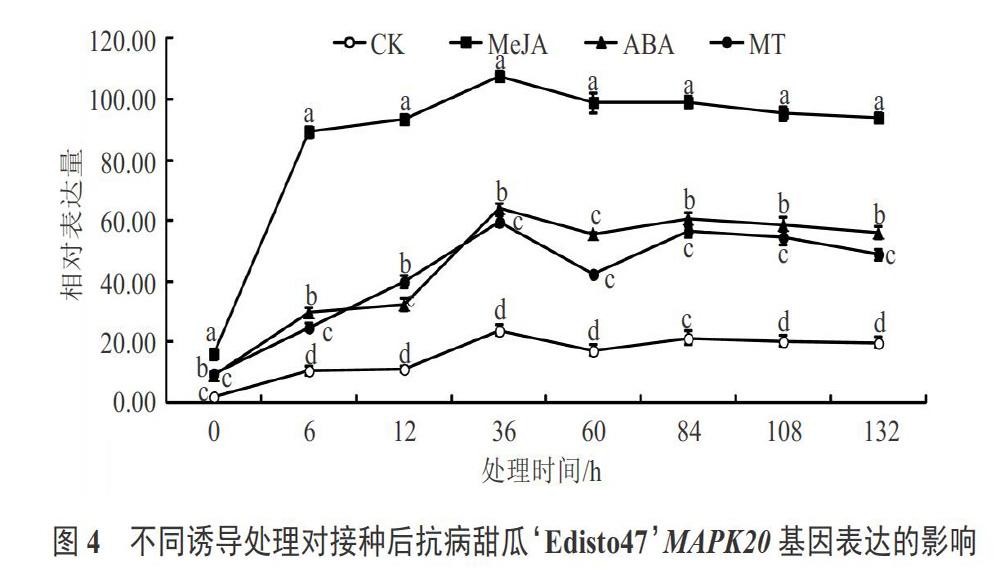
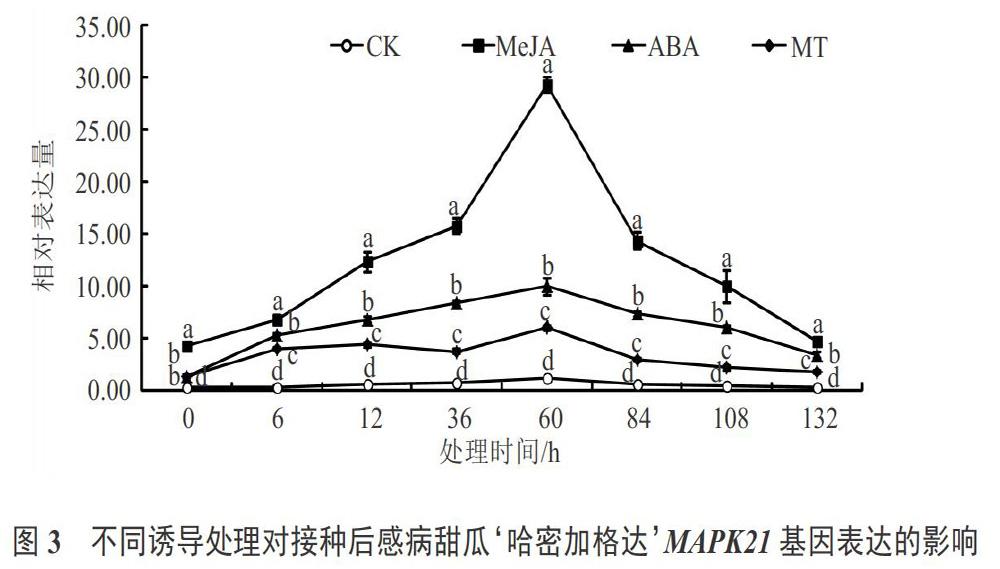
經外源信號分子誘導處理后,抗病甜瓜品種‘Edisto47和感病甜瓜品種‘哈密加格達中MAPK20基因和MAPK9基因表達變化趨勢同MAPK21基因,也出現上調趨勢(見圖4~7),說明這2個基因對于甜瓜白粉病抗性方面也具有一定的響應性,但MeJA處理后的2個基因相對表達量高于ABA處理和MT處理。另外由圖2~7對比可知,MeJA處理的抗病甜瓜品種MAPK21、MAPK20和MAPK9的相對表達量較高量分別為130.74、107.74和99.71,而用MeJA處理感病甜瓜品種MAPK21、MAPK20和MAPK9的相對表達量較高量分別為29.32、18.35和17.34;ABA和MT 2個處理也是同樣的變化趨勢,因此2個試驗材料經過接種白粉病菌對比發現,抗病甜瓜品種MAPK21基因、MAPK20基因和MAPK9基因相對表達量遠遠高于感病品種;3個處理后同一品種中MAPK21基因相對表達量遠遠高于MAPK20基因和MAPK9基因。
3 討論與結論
植物激素是植物在特定環境下細胞在代謝過程中產生的一類小分子物質,主要有SA、MeJA、ACC和ABA等。近年來,大量研究表明植物生長發育過程中受到病原菌的侵害時植株會產生激素調控與生物脅迫信號傳導途徑互作,調控植物應答生物脅迫的抗性,如:MeJA對甜瓜枯萎病[14]、人參銹病[15]、辣椒青枯病[16]等的抗性效果顯著;ABA提高植物對病原菌敏感性的主要原因尚不清楚,但是研究表明,增加ABA含量能夠提高植物對病菌的抗性,經ABA處理的煙草能夠在一定程度上提高對病毒的抵抗能力[17];MT能夠降低由盤二孢屬引起的蘋果斑點病[18]。該試驗利用MeJA、ABA和MT處理感病甜瓜‘哈密加格達和抗病甜瓜‘Edisto47并統計發病率,結果表明,不同外源信號分子處理對甜瓜白粉病的抗病效果不同,總體表現出一定的時間效應,MeJA、ABA、MT具有提高甜瓜白粉病抗性的作用,都具有調控植物應答生物脅迫抗性的潛能。
抗逆性和抗病性是植物與環境脅迫及病原菌相互適應、相互選擇的結果。基因的表達除了受組織特異性影響外,還會隨著環境的生物或非生物脅迫而改變。MAPK是通過將胞外信號逐級放大并傳遞至細胞內并且得到響應的重要蛋白激酶,其在植物的生物和非生物脅迫響應中發揮著極為重要的作用,不僅可以通過磷酸化修飾被激活,而且在mRNA水平上也可以被激活。研究發現,ClMPK7很有可能同時參與了西瓜組織受干旱、高溫及枯萎病原菌誘導的多條不同的信號轉導途徑,并在其中扮演關鍵角色[11];當葡萄受到脅迫誘導后,VvMKK2,VvMKK3和VvMKK4表現出差異性上調,可能實現不同的功能并參與不同信號通路,VvMKK2,VvMKK4和VvMKK6這3 種基因在擬南芥中的過量表達提高了植株的抗鹽和干旱脅迫能力[19];AhMAPK13基因可能參與花生受干旱、低溫、NaCl等非生物脅迫及JA、GA、ET、SA等激素介導的抗逆信號轉到途徑[20]。為了更進一步了解MeJA、ABA、MT調控甜瓜MAPK基因應答白粉病菌抗性作用,該試驗采用實時定量PCR方法,對甜瓜MAPK基因家族成員在激素脅迫下的表達模式進行分析。結果表明,甜瓜品種中MAPK 3個相關基因MAPK21、MAPK20、MAPK9在接種白粉病菌后基因都呈上調表達,但表達量出現差異,抗病甜瓜品種3個MAPK基因相對表達量高于感病甜瓜品種,MAPK21基因相對表達量高于MAPK20和MAPK9。3個MAPK基因對MeJA、ABA、MT 3個脅迫因子的重疊表達特性,說明這3個基因有可能不同程度的參與了多個信號轉到途徑,在這些信號途徑中扮演著重要的角色,其調控作用機制還有待深入研究。
甜瓜白粉病是瓜類作物上廣泛發生的重要病害,抗白粉病基因的挖掘是目前研究的熱點,篩選甜瓜優異抗病基因資源用于抗病新品種的培育,這樣有利于從根本上解決甜瓜白粉病病害的有效途徑。筆者主要分析了MeJA、ABA、MT 3個脅迫因子誘導抗病和感病甜瓜葉片中MAPK基因的表達模式,初步判斷其在甜瓜葉片中的表達模式,MAPK級聯途徑在植物的生物和非生物脅迫響應中發揮著極為重要的作用,今后可以進一步深入明確抗白粉病相關基因是如何通過信號轉導途徑調控對白粉病的抗性及家族基因扮演的角色和它們之間蛋白互作的分子機制。
參考文獻
[1] 新疆甜瓜資源調查組.新疆甜瓜西瓜志[M].烏魯木齊:新疆人民出版社,1985.
[2] 崔浩楠,朱強龍,朱子成,等. 甜瓜白粉病及其抗性分子遺傳研究進展[J].中國瓜菜,2018,31(3):1-7.
[3] WANG X L,LI G,GAO X W,et al.Powdery mildew resistance gene(Pm-AN)located in a segregation distortion region of melon LGV[J]. Rui Han in Euphytica,2011,180(3):421-428.
[4] TAKAHASHI Y ,SOYANO T,KOSETSU K,et al.HINKEL kinesin, ANP MAPKKKs and MKK6/ANQ MAPKK,Which phosphorylates and activates MPK4 MAPK,constitute a pathway that is Required for cytokinesis in Arabidopsis thaliana[J].Plant ﹠ Cell Physiology,2010,51(10):1766-1776.
[5] ZHAO F Y,HU F, ZHANG S Y,et al.MAPKs regulate root growth by influencing auxin signaling and cell cycle-related gene expression in cadmium-stressed rice[J]. Environmental Science and Pollution Research,2013,20(8):5449-5460.
[6] JONAK C,?KR?SZ L,B?GRE L,et al.Complexity, cross talk and integration of plant MAP kinase signaling[J].Current Opinion in Plant Biology,2002,5(5):415-424.
[7] 張興坦.煙草MAPK基因的功能研究[D].重慶:重慶大學,2015.
[8] 王潔.植物MAPK級聯途徑基因家族的進化分析及番茄SlMPK13的功能鑒定[D].杭州:浙江大學,2015.
[9] ZHOU H Y,REN S Y,XING Y,et al.Identification and analysis of mitogen-activated protein kinase (MAPK) cascades in Fragaria vesca[J].International Journal of Molecular Sciences,2017,18(8):1766.
[10] WANG J,PAN C T,WANG Y,et al.Genome-wide identification of MAPK,MAPKK,and MAPKKK gene families and transcriptional profiling analysis during development and stress response in cucumber[J].BMC Genomics,2015,16(1):386.
[11] 宋秋明.西瓜MAPK和MAPKK家族基因的鑒定、表達模式和功能分析[D].杭州:浙江大學,2015.
[12] 于瑩,陳宏宇,程莉莉,等.亞麻MAPK基因克隆及鹽堿脅迫下的表達分析[J].東北農業大學學報,2015(3):21-28.
[13] 辛董董,李桂榮,郭衛麗,等.甜瓜MAPK基因的表達分析[J].北方園藝,2018(24):21-26.
[14] 郭海艷,劉璐,孫宇蛟,等.3種外源誘導劑預處理對甜瓜抗病特征及其Fom-2和CHT基因表達的影響[J].西北植物學報,2018,38(5):0894-0901.
[15] 傅俊范,盤柳依,陳明,等.茉莉酸甲酯誘導人參抗銹腐病的生理機制[J].吉林農業大學學報,2012,34(4):381-384.
[16] 趙顯陽,向妙蓮,曾曉春,等.茉莉酸甲酯對辣椒抗青枯病的誘導效應及抗氧化酶活性的影響[J].植物保護學報,2018,45(5):1103-1111.
[17] 周金鑫,胡新文,張海文,等.ABA在生物脅迫應答中的調控作用[J].農業生物技術學報,2008,16(1):169-174.
[18] YIN L,WANG P,LI M,et al.Exogenous melatonin improves malus resistance to marssonina apple blotch[J].Journal of Pineal Research,2013,54(4):426-434.
[19] 王剛.葡萄MAPK類基因家族的鑒定、表達分析及部分基因的功能驗證[D].南京:南京農業大學,2014.
[20] 梁丹,張朝昕,王冕,等.花生MAPK13基因的克隆及表達分析研究[J].花生學報,2019,48(2):10-18.

