中國醫院藥物警戒系統對某院藥品不良反應上報的影響*
李紅玲,譚娜,莊紅玲 ,陶恩 ,覃正碧
(1.湖北民族大學附屬民大醫院藥學部, 恩施 445000;2.湖北民族大學醫學院,恩施 445000)
藥品不良反應(adverse drug reaction,ADR)是藥品的固有屬性,是合格藥品在正常用法用量下出現的與用藥目的無關或意外的有害反應[1]。基于藥品使用存在風險,各國紛紛建立ADR報告和監測制度[2]。我國也于2004年頒布《藥品不良反應報告與監測管理辦法》,建立ADR監測、報告和管理制度,并于2011年進行了修訂[1]。從近年來我國ADR監測報告情況來看,雖然報告數量持續上升,但我國住院患者ADR報告率不足1%[3]。中國醫院藥物警戒系統(Chinese Hospital Pharmacovigilance System,CHPS)是國家藥品不良反應監測中心開發的輔助監測哨點發現、報告、評價藥品醫療器械不良反應/事件,開展重點監測、上市后研究,獲取藥品、醫療器械警戒信息的信息化系統,該系統可與醫院信息系統(hospital information system,HIS)和實驗室信息系統(laboratory information system,LIS) 對接,從醫院系統提取患者的醫療文書、用藥信息以及檢查結果等,可為醫療機構ADR的監測工作提供完整信息,解決ADR上報工作中的漏報、缺項等問題[4]。湖北民族大學附屬民大醫院于2017年9月正式加入中國藥品不良反應監測哨點醫院聯盟,2018年1月正式開始運行該系統。現就該系統在該院運行情況做一分析,旨在為該系統在全國的推廣提供更多依據。
1 資料與方法
1.1資料來源 資料來源于安裝CHPS前(2017年1—6月)與安裝CHPS后(2018年1—6月)收集的ADR原始報表,分別設立為對照組和研究組。
1.2研究項目 對收集的原始ADR報表通過Excel表格對上報例數、新的/嚴重的ADR比例、報表填報完整性等情況進行統計。
1.3計分方法
1.3.1報表完整性比較 將ADR報表各項必填項制成ADR報告質量評估表,對安裝CHPS前后的報表必填項進行統計,每缺1項記為1分,并匯總統計分析。
1.3.2過程描述情況比較 對上報ADR過程描述拆分成“三個時間(發生時間、干預時間、癥狀緩解時間)”以及“一個過程(處理過程)”描述4個方面,描述完整得1分,不完整得0分,計算各份報表過程描述得分情況并統計分析。
1.4統計學方法 應用SPSS16.0 版統計學軟件對實驗數據進行統計分析,組間比較采用t檢驗,以P<0.05表示差異有統計學意義。
2 結果
2.1ADR上報數量方面 安裝CHPS前共上報32例,安裝后上報例數為90例,增加幅度達181.25%。
2.2ADR報表填寫完整程度 對照組ADR報表累計缺項達117項,研究組ADR報表缺項內容明顯減少,僅20項。報表填寫缺項情況比較見表1。對照組平均缺項(3.66±1.12)項、研究組為(0.23±0.67)項,差異有統計學意義(P<0.01)。
2.3不良事件過程描述情況 研究組ADR報表過程描述完整性較對照組有所上升,對照組過程描述完整性平均得分2.28分,研究組為2.87分,但兩者差異無統計學意義(P>0.05)。
2.4新的/嚴重的ADR上報情況 安裝CHPS后,本院總體ADR上報數量上升,新的/嚴重的ADR報表數從16例上升到45例,但新的/嚴重的比例均為50%,差異無統計學意義(P>0.05)。
3 討論
3.1我國ADR上報現狀 上市后藥品ADR監測是規避用藥風險、促進用藥安全極為重要的手段之一。《藥品不良反應報告與監測管理辦法》指出,醫療機構應主動收集藥品不良反應,應建立藥品不良反應報告與監測管理制度[1]。目前我國ADR上報存在漏報嚴重,尤其是醫療機構ADR上報數量不夠[5],按照世界衛生組織(WHO)統計在住院患者中10%~20%發生ADR,我國2017年總住院24 436萬例次,至少約有2443萬例發生ADR,而實際上2017年我國共收集ADR報表142.9萬份,我國ADR報告率與實際發生率相差很大,說明漏報率較高,而漏報會導致部分用藥風險不能被及時發現并預警。雖然我國ADR80%以上來源于醫療機構,但三級醫院上報比例并不高[6],以2015年數據為例,由于很多三級醫療機構上報數據為0,導致當年三級醫療機構平均上報ADR報表僅30多份[3],相對于三級醫療機構的住院量來看,上報數量遠遠不夠。而多項藥品不良反應認知調查顯示:漏報的主要原因是醫務人員對ADR上報的重要性認識不足、工作忙、上報程序復雜等[7-8]。另外,醫療機構內藥品安全委員會、ADR監測室等機構不健全,監管部門與醫院之間信息反饋、雙向交流機制不夠完善,影響了ADR信息的快捷溝通[9]。
3.2CHPS的優勢 為進一步提升我國ADR上報率,為安全用藥提供更多的依據,國家ADR監測中心在大數據時代的背景下對有效的醫療資源進行整合,開發了CHPS,該系統不僅能夠對醫療機構就診患者發生的ADR進行自動監測,而且還能夠完整地提取患者基本信息及用藥信息,能夠及時發現、報告、評價ADR[4]。
同時,該系統還能夠對藥品風險進行警戒提示,實時更新藥物警戒信息與ADR通報信息,符合我國目前ADR朝向主動監測模式發展的大方向,能夠有效避免因ADR而造成的醫患糾紛[10]。此外,CHPS 系統能夠自主設定重點監測目標(如病例監測、品種檢測等),可對不良反應高發的藥物開展有針對性地監測,并能進行二次評價,進而有效降低發生不良反應藥品的危害[11]。
3.3本院使用CHPS情況分析 安裝CHPS后,本院ADR上報數量明顯提升,這與CHPS的輔助監測功能密切相關。CHPS具有主動監測、輔助報告等功能,包括ADR病例監測、品種監測等,管理者可從管理端監測到發生的ADR,并提醒醫務人員及時上報,很大程度上減少漏報情況。
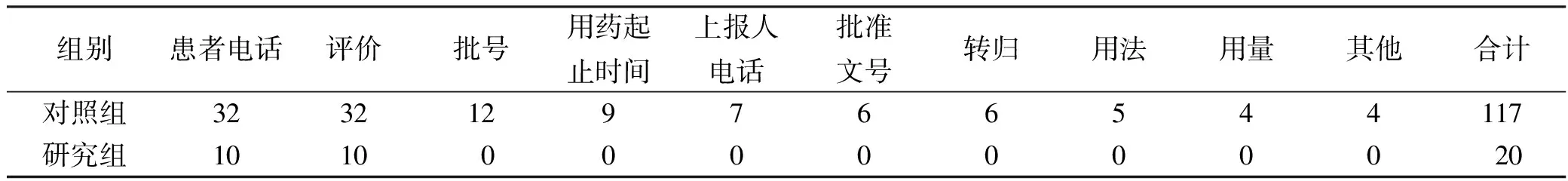
表1 CHPS安裝前后ADR報表缺項統計
從ADR報表完整性來看,安裝CHPS后,本院ADR報表缺項內容明顯減少。安裝CHPS前,本院ADR上報是通過院內醫療安全不良事件系統上報,該系統是醫院自行研發的上報程序,由于該系統無患者聯系方式及關聯性評價,致使安裝前所有報表均缺此2項內容,其次是使用藥品信息不全,如批號、批準文號、用法用量,分析其可能的原因為發生ADR后未及時收集藥品相關信息,事后再上報無法準確獲得藥品相關信息。由于CHPS與HIS對接,患者用藥信息可直接從系統中提取,使報表更加完整、準確。安裝CHPS后,由于仍有極少數醫務人員仍從醫院原有的醫療安全不良事件系統上報ADR,因此安裝后所收集的ADR報表仍有部分缺項,而通過CHPS上報的ADR報表均無缺項,報表完整。今后應深入科室進一步宣傳和指導醫務人員使用CHPS上報ADR。
ADR監測報告指出ADR應真實、準確、可信,具體體現在上報ADR要如實記錄3個時間及一個過程,只有如實記錄才能為藥物風險信號的提取提供更多依據[11]。CHPS對ADR事件描述設有通用模板,包括以上3個時間以及處理情況,但就本院統計數據來看,安裝CHPS前后,ADR事件過程描述情況有所提高,但變化不大,經分析發現醫務人員仍有沿用之前的習慣,從病程記錄中復制,而使用系統自帶通用模板的不多,導致過程描述仍不夠詳細。這也是以后我們工作的一個方向,需要加強對ADR監測系統的培訓宣傳,盡可能點對點地指導科室合理正確使用該系統。
新的/嚴重的ADR報告所占比例是衡量上報質量好壞的重要指標,尤其是嚴重的不良反應報告比例,這比例在30%以上往往預示著國家不良反應報告整體數據質量較好。CHPS安裝后,本院ADR上報數量較去年同期明顯提升,新的/嚴重的比例與去年同期持平,均為50%,而2017年我國藥品不良反應報告中新的/嚴重的比例為30.3%[12]。本院該項比例高于國家平均水平,顯示本院ADR上報的質量相對較高。
在使用該系統時,通過其病例主動監測功能發現1例患者在使用還原型谷胱甘肽針過程中出現氣促、喘息、呼吸困難,經分析考慮可能為ADR,查閱患者病歷發現其不良反應可能與該藥的用量偏大有關,及時告知醫師該藥的合適用量,進而避免其他患者再次大劑量使用該藥出現嚴重不良反應。
4 結束語
藥物安全是全球關注的焦點問題之一,ADR 監測是藥物警戒的一項常規工作,是促進安全用藥的重要渠道。藥品作為一個特殊的商品,其效益與風險并存,在治療疾病的同時也不可避免地發生不良反應[13]。CHPS能有效對醫院的醫療資源進行整合,不僅能創新監測手段,探索主動監測模式,提升ADR上報的數量與質量,還通過藥品重點監測,提供上市后藥品再評價的研究平臺,值得推廣。

