丙泊酚對高糖誘導大鼠原代成骨細胞氧化應激損傷的影響研究
馮大鵬,石 磊,祝勇剛,呂昌偉,蔣 鵬
高血糖可導致全身多系統組織、細胞病變及功能障礙,如心肌病、動脈粥樣硬化、骨質疏松等[1-2]。當前,糖尿病所引起的骨質疏松、骨壞死等骨骼系統疾病的發病率日益增高,其后果不容忽視。這些疾病的病理學基礎為高血糖條件下的細胞氧化應激反應增加,這個過程中大量生成的活性氧(ROS)直接導致細胞線粒體損傷,最終造成細胞功能紊亂以及細胞凋亡增加[3]。丙泊酚是臨床常用麻醉藥物,具有起效快、安全性高等特點。更為值得關注的是,丙泊酚還具有抗氧化應激的功能,并且在血管內皮細胞和心肌細胞中的作用已獲得驗證[4]。然而,目前關于丙泊酚在成骨細胞中的抗氧化應激特性尚未見報道。因此,本文擬研究丙泊酚對高糖誘導原代成骨細胞氧化應激損傷的影響,為高血糖所致骨骼系統相關疾病的預防與治療提供新的思路。
1 材料與方法
1.1實驗試劑與儀器 胎牛血清、α-MEM培養基均購于Hyclone公司;CCK-8檢測試劑盒購于Dojindo Molecular Technologies公司;ROS檢測試劑盒(批號:20170115)購自碧云天生物技術研究所;丙泊酚(批號:01708271)購自北京費森尤斯卡比醫藥有限公司;葡萄糖購于美國Sigma公司;0.25%胰酶購于北京索萊寶科技有限公司;新生SD仔鼠購于空軍軍醫大學動物中心;EPICS XL流式細胞儀購自美國貝克曼庫爾特有限公司;酶標儀購于美國Thermo公司。
1.2原代成骨細胞的提取與培養 取新生SD仔鼠,應用顱骨片組織培養法提取原代成骨細胞[5]。將SD仔鼠脫頸處死,用乙醇消毒3次,超凈臺內完整分離顱骨并去凈周圍軟組織,用PBS液將顱骨片沖洗干凈后剪成1 mm×1 mm大小,用0.25%胰酶消化10 min,用含10%胎牛血清的α-MEM培養基終止消化,將處理后小骨片轉移至培養皿中均勻鋪開,培養皿放置細胞孵箱培養24 h,更換培養液,隔天換液1次,顯微鏡下觀察貼壁細胞生長80%~90%融合時,用0.25%胰酶消化傳代。取第2代細胞進行實驗。
1.3實驗分組及處理 按照處理方法不同將原代成骨細胞培養分為高糖組、丙泊酚組和對照組。3組均用含10%胎牛血清的α-MEM培養基培養,高糖組的培養液加入25.5 mmol/L葡萄糖;丙泊酚組的培養液加入25.5 mmol/L葡萄糖和30 mg/ml丙泊酚。
1.4CCK-8法測定細胞增殖活力 取原代成骨細胞接種至96孔培養板內,每孔接種2×103~3×103個細胞,培養第1、3天分別于每組培養細胞中取5個孔,每孔加入CCK-8液100 μl后于細胞培養箱中孵育4 h。然后取出培養板,置于酶標儀中,檢測450 nm的OD值并讀數,每組5個讀數求平均值。
1.5細胞凋亡測定 取原代成骨細胞接種至6孔培養板內,每孔接種1×106個細胞,培養24 h消化收集各組內(每組重復3孔)培養細胞,用冰預冷的PBS重懸細胞3次以后,在細胞中添加Loading Buffer 500 μl,充分混合,添加PI和Annexin V-FITC染液并混勻,用EPICS XL流式細胞儀檢測細胞凋亡率,每組3個計數求平均值和標準差。
1.6Western blot檢測Caspase-3蛋白表達水平 取原代成骨細胞接種至6孔培養板內,每孔接種1×106個細胞,培養24 h后消化收集各組內(每組重復3孔)培養細胞到1.5 ml離心管中并用PBS液沖洗3遍,適量體積RIPA細胞裂解液提取總蛋白,并用BCA法對蛋白濃度進行測定。用10%的分離膠和5%的濃縮膠進行電泳。蛋白與4×Loading Buffer按照體積比4∶1混合以后置于100℃孵育5 min。將蛋白樣品添加到上樣孔內,Marker上樣量為10 μl,接通電源(通常25 mA),上層膠電壓為120 V,下層膠電壓為160 V,大約90 min后可見藍色線條移至玻璃板底端,提示電泳結束,關閉電源。準備6張7 cm×9 cm的濾紙和1張大小合適的PVDF膜,使用前先用甲醇活化PVDF膜。將分離膠小心剝離并蓋在濾紙上,并把膜蓋在膠上,去除氣泡后在膜上面蓋3張濾紙,去除氣泡,將另一海綿墊蓋上。200 mA恒流轉膜1 h,然后將轉好的膜取出并在室溫條件下脫色搖床上用5%脫脂牛奶(0.5% TBST配制)封閉1 h。用TBST溶解的5%脫脂牛奶稀釋一抗,稀釋比例為1∶300,4℃條件下孵育過夜。用TBST在室溫條件下脫色搖床上洗3次,每次5 min。用TBST稀釋二抗3000倍,孵育30 min,用TBST在室溫條件下脫色搖床上洗3次,每次5 min。將試劑ECLA、ECLB在離心管中以相同體積混合,PVDF膜蛋白面朝上并與上述混合液充分接觸1~2 min,然后去盡殘留液體,包好放入暗匣里進行曝光。用顯影劑和定影劑進行顯影及定影,調整曝光條件,掃描膠片,Alpha軟件處理后系統分析各個條帶的光密度值,以β-actin作為參照。
1.7ROS表達水平檢測 按照之前分組方法處理細胞,培養24 h后消化收集各組內培養細胞,用試劑盒檢測細胞中ROS含量,ROS表達水平用熒光強度表示。
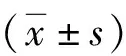
2 結果
2.1SD仔鼠原代成骨細胞培養 按照顱骨片組織培養法提取SD仔鼠原代成骨細胞,連續培養3~5 d后可見原代成骨細胞從顱骨片邊緣長出,形態呈長梭形。見圖1。

圖1 顱骨邊緣生長的原代成骨細胞(標尺:100 μm,陰影部分為顱骨片)
2.2細胞增殖活力檢測 CCK-8法測定450 nm的OD值,檢測細胞增殖活力。培養第1天,3組原代成骨細胞增殖活力比較差異無統計學意義(P>0.05)。培養第3天,對照組和丙泊酚組原代成骨細胞增殖活力明顯優于高糖組(P<0.05)。見圖2。

圖2 3組原代成骨細胞增殖活力的OD值比較
高糖組培養液加入25.5 mmol/L葡萄糖,丙泊酚組培養液加入25.5 mmol/L葡萄糖和30 mg/ml丙泊酚,對照組不做任何處理;與高糖組比較,aP<0.05
2.3細胞凋亡率比較 高糖組原代成骨細胞的凋亡率為(35.68±3.35)%、丙泊酚組為(19.03±2.27)%、對照組為(7.21±1.03)%。與對照組比較,高糖組原代成骨細胞的凋亡率明顯升高(P<0.05)。與高糖組比較,丙泊酚組原代成骨細胞的凋亡率明顯降低(P<0.05)。見圖3。

圖3 3組原代成骨細胞凋亡率流式細胞分析圖
高糖組培養液加入25.5 mmol/L葡萄糖,丙泊酚組培養液加入25.5 mmol/L葡萄糖和30 mg/ml丙泊酚,對照組不做任何處理
2.4Caspase-3蛋白表達水平檢測 高糖組原代成骨細胞Caspase-3蛋白表達水平為0.50±0.04、丙泊酚組為0.28±0.02、對照組為0.27±0.03。與對照組比較,高糖組原代成骨細胞Caspase-3蛋白表達水平明顯升高(P<0.05)。與高糖組比較,丙泊酚組原代成骨細胞Caspase-3蛋白表達水平明顯降低(P<0.05)。見圖4。

圖4 3組原代成骨細胞Caspase-3蛋白表達水平
高糖組培養液加入25.5 mmol/L葡萄糖,丙泊酚組培養液加入25.5 mmol/L葡萄糖和30 mg/ml丙泊酚,對照組不做任何處理
2.5ROS熒光強度檢測 高糖組原代成骨細胞ROS熒光強度水平為463.25±45.37、丙泊酚組為219.18±23.56、對照組為107.53±14.67。與對照組比較,高糖組原代成骨細胞ROS熒光強度水平明顯升高(P<0.05)。與高糖組比較,丙泊酚組原代成骨細胞ROS熒光強度水平明顯降低(P<0.05)。
3 討論
近年來隨著對氧化應激研究的不斷深入,學者們對其在疾病發生和發展過程中起的重要作用有了新的認識。氧化應激源于細胞自身的代償性反應,細胞通過還原反應,將分子氧變成水而產生能量,此過程中局部會產生少量ROS[6]。ROS主要產自過氧化物酶體脂肪酸、線粒體電子傳遞鏈、巨噬細胞和細胞色素P450[7]。ROS在生理水平對細胞有益,且由于大部分細胞具有抗氧化和修復系統,故能耐受一定程度的氧化應激。而當機體內ROS水平持續上升并超過了細胞抗氧化系統的防御能力,則將導致細胞凋亡[8]。此外,ROS還可直接破壞DNA及維持細胞膜穩定的蛋白質和磷脂,誘導細胞凋亡[9-10]。ROS損傷細胞的機制復雜,但其主要是通過活化轉錄因子、促進細胞凋亡等多種途徑來損傷細胞[11]。
氧化應激對于成骨細胞的增殖與分化具有重要意義。細胞內的ROS水平直接影響成骨細胞的存活以及功能[12]。當ROS在細胞內大量蓄積時,內質網蛋白會發生錯誤折疊,從而引起內質網應激,繼而激活下游執行凋亡的因子Caspase-3,最終導致細胞凋亡[13]。而Caspase-3是細胞凋亡的關鍵分子,當Caspase-3蛋白表達增加時,將導致細胞凋亡[14]。
在臨床上,大部分糖尿病患者都伴有骨量減少和骨密度降低,這與局部微循環條件較差相關,但其根源在于高血糖所誘發的氧化應激。糖尿病患者由于體內長期處于高血糖狀態,易誘發機體細胞氧化應激,從而導致多器官功能障礙。在骨骼系統,糖尿病可致骨生成和吸收代謝紊亂,繼而誘發骨量降低,最終引起骨質疏松及骨慢性感染和炎癥等并發癥。在口腔科,高血糖所致氧化應激反應可直接導致種植體周圍骨丟失、種植體周圍炎等[15]。有相關研究表明,高糖條件下,成骨細胞MC3T3-E1的增殖分化受到顯著抑制,其機制在于MC3T3-E1成骨細胞系中線粒體膜電位相降低、Caspase-3活性增強、氧化應激水平上升,從而導致細胞凋亡顯著增加[16]。成骨細胞是骨細胞的前體,對于骨形成具有極其重要的作用;成骨細胞的增殖與凋亡對于骨界面的愈合極為重要[17]。
丙泊酚是臨床常用的靜脈麻醉藥物之一,研究發現其對心、腦、腎、肝臟等重要臟器具有一定的保護作用;此外,丙泊酚還在缺血再灌注、動脈粥樣硬化等氧化應激性疾病中發揮了一定的抗氧化作用,從而能夠減輕細胞的損傷以及減少凋亡[18-19]。另外還有文獻研究表明,丙泊酚具有抑制肝癌、胃癌、食管癌、胰腺癌、結腸癌、肺癌等腫瘤細胞增殖并促進其凋亡的能力[20-26]。
本研究結果表明,高糖培養條件下,原代成骨細胞增殖減少,凋亡顯著增加,細胞中ROS熒光強度水平明顯升高,Caspase-3蛋白表達增高。提示高糖能夠誘導原代成骨細胞氧化應激損傷和凋亡。而加入丙泊酚,能夠明顯促進高糖培養條件下原代成骨細胞增殖,抑制其凋亡,細胞中ROS熒光強度和Caspase-3蛋白表達水平也顯著降低。該結果提示丙泊酚可通過降低氧化應激減少高糖對原代成骨細胞的損傷作用,對于高糖條件下機體骨形成具有一定的保護作用。另外,本研究中丙泊酚降低氧化應激的機制尚未完全明確,下一步將深入研究高血糖所引起的ROS相關機制以及丙泊酚在其中發揮的調節作用,從而為高血糖所致骨骼系統相關疾病的預防與治療提供新的途徑。
綜上所述,高糖可以導致成骨細胞氧化應激損傷,增加細胞凋亡;丙泊酚可以減輕高糖所致成骨細胞的氧化應激,減少細胞凋亡,促進細胞增殖。

