加溫對紅細胞以及血液質量影響的實驗研究
馬印圖,谷建芳,陳曉飛,王更銀,劉 宏,王 哲,李莉華
緊急快速輸血輸液是搶救失血性休克患者的重要手段,特別是在野戰、自然災害等突發情況下,短時間內需要輸注大量的血液糾正血容量不足,保障重要臟器的血液灌注,改善機體血液循環[1-2]。但短時間大量冷藏庫存血液輸入傷員體內可能引起低溫損傷等嚴重的不良反應,因此對庫存血進行復溫后輸注,可有效防治低體溫并發癥的發生[3-4]。而加溫過程中的溫度控制不當可能會對紅細胞及血液生化指標產生影響,目前研究不同溫度對血液成分、血生化指標等影響的相關文獻較少[5-6],加溫溫度的安全性尚未得到統一認證[7]。本研究模擬水浴加溫模式,采用血液流動和非流動狀態平行試驗,觀察不同加溫溫度對紅細胞形態、溶血率、血漿游離血紅蛋白等血液質量的影響,評價安全的輸血加溫溫度,為野戰加溫輸血提供實驗基礎和理論依據。
1 材料與方法
1.1血液來源 采集健康獻血者的全血200 ml,按照常規方法分離制備去白細胞全血,靜置于2~6℃儲血冰箱內備用。
1.2主要儀器和試劑 加溫水浴箱由蘇州醫療儀器廠生產;血袋、一次性輸血器由山東威高集團醫用高分子制品股份有限公司提供;德國貝克曼AC.T5diff AL全自動血細胞分析儀,Olympus CX23生物顯微鏡,北京瑞爾達4040半自動生化分析儀,美國Beckman-Coulter FC500型流式細胞儀。
1.3實驗方法
1.3.1非流動狀態下對血液加溫:從4℃冰箱內取出保存10 d的去白細胞全血200 ml,室溫下混勻靜置30 min,從血袋中抽取5 ml血樣本置試管內作為對照,分別放置在40、45、50和55℃水浴箱中,10 min后分別抽取加溫后的血液5 ml,做好標記,采用全自動血細胞分析儀檢測,半自動生化分析儀檢測游離血紅蛋白、計算溶血率、血鉀指標,紅細胞滲透脆性試驗采用流式細胞儀進行檢測[8]。
1.3.2流動狀態下對血液加溫:按照上述方法,取4℃保存10 d的去白細胞全血200 ml,室溫下混勻靜置30 min,將血袋懸掛于輸液架上,輸血器管路侵入不同溫度的水浴箱中約50~60 cm,輸注末端連接一個無菌空轉移袋,滴速調節為8~10 ml/min,模擬輸血過程,10 min后抽取轉移袋內的血液用于相關指標的檢測。
1.3.3血液標本的留取與檢測:試驗前留取血袋內血液5 ml作為對照組,不同溫度加溫后采集5 ml血液至試管內,分別用于鏡下觀察紅細胞形態,檢測紅細胞計數(RBC)、紅細胞壓積(HCT)、血紅蛋白(HGB)、血鉀、血漿游離血紅蛋白等紅細胞完整性指標,并計算溶血率[9],溶血率=[(1-HCT)×CFHb/CHb]×100%,式中HCT為紅細胞壓積,CFHb為血漿或上清游離血紅蛋白濃度(g/L),CHb為血紅蛋白濃度(g/L)。
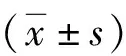
2 結果
2.1加溫前后紅細胞相關指標的變化 血液在流動和非流動情況下,對加溫前后RBC、HCT和HGB進行檢測,以加溫前后檢測結果的差值作為因變量進行方差分析,然后再分析殘差,其中有大概17%的離群數。因此,該結果不符合正態分布規律,不適合用方差分析方法,采用統計軟件中可以抵抗離群點的穩健M評估方法。結果顯示,血液在非流動狀態下,≤50℃各組加溫10 min各項指標差值比較差異無統計學意義(P>0.05)。與≤50℃各組比較,55℃組各項指標的差值變化明顯,差異均具有統計學意義(P<0.05)。說明在非流動情況下≤50℃加溫10 min對血液紅細胞影響不明顯,超過55℃則對紅細胞損傷作用加重。見表1。而血液在流動狀態下,≤55℃以下加溫對血液RBC、HCT和HGB指標的影響不明顯,各溫度組間差值比較差異無統計學意義(P>0.05)。見表2。
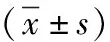
表1 非流動狀態下血液加溫前后紅細胞相關指標的變化情況
RBC紅細胞計數,HCT為紅細胞壓積,HGB為血紅蛋白;與≤50℃的各組差值比較,aP<0.05
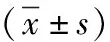
表2 流動狀態下血液加溫前后紅細胞相關指標的變化情況
RBC紅細胞計數,HCT為紅細胞壓積,HGB為血紅蛋白
2.2加溫對紅細胞溶血情況的影響 通過水浴箱分別對輸血器管路和血袋加溫,檢測血液在流動和非流動狀態下,加溫10 min后血漿pH值和CFHb,計算紅細胞溶血率。結果顯示,在≤50℃的各組間紅細胞溶血率比較差異無統計學意義(P>0.05)。但55℃加溫10 min后紅細胞溶血率明顯上升,與≤50℃各組比較差異均具有統計學意義(P<0.05)。說明加溫超過55℃對紅細胞破壞嚴重。見表3。

表3 流動和非流動狀態下不同溫度加溫10 min后的溶血情況
注:CFHb為血漿或上清游離血紅蛋白濃度;與≤50℃各組比較,aP<0.05
2.3加溫對紅細胞滲透脆性及血鉀的影響 檢測血液在流動和非流動狀態下加溫前后紅細胞滲透脆性和血鉀含量的變化。結果顯示,溫度在40~50℃加溫后紅細胞在0.60%和0.65%的NaCl濃度下滲透脆性略有增加,但組間方差分析差異無統計學意義(P>0.05)。提示適當加溫不會引起有意義的紅細胞溶血。非流動狀態和流動狀態下,≤50℃各組加溫前后血鉀濃度差值波動在0.36~2.67 mmol/L之間,加溫前后差值經方差分析,比較差異無統計學意義(P>0.05)。而溫度超過55℃血鉀濃度明顯增高,加溫前后差值經方差分析,與≤50℃各組比較差異均具有統計學意義(P<0.05)。說明溫度超過55℃會造成血鉀水平升高。見表4。
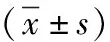
表4 流動和非流動狀態下血液加溫前后血鉀變化情況
注:與≤50℃的各組差值比較,aP<0.05
2.4紅細胞形態變化 取加溫前后的血液進行涂片,瑞姬氏染色后普通光鏡高倍視野和油鏡下鏡檢,觀察紅細胞形態變化。結果顯示,隨著溫度的升高,紅細胞的體積逐漸增大,完整性逐漸受到破壞,血袋在50℃加溫10 min,約85%的紅細胞可維持形態完整,很少見異形的紅細胞,但溫度增加到55℃以上時,視野中可見到菱形、球形和棘狀紅細胞,隨著溫度的增加,異形紅細胞的數量也逐漸增多,而且出現了紅細胞碎片,說明在≤50℃的溫度范圍內短時間加溫對紅細胞的破壞很小,過高的溫度會導致紅細胞溶血和破壞現象增多。
3 討論
輸血是急診搶救大失血傷員的常用方法,患者輸入大量冷藏的庫存血會引起靜脈痙攣、體溫降低、血壓下降,進而誘發凝血功能障礙、心律失常、心臟驟停等一系列臨床和病理變化[10-11]。血液加溫主要是預防患者大量使用庫存血造成的低體溫并發癥[12]。由于血液的特殊性,其中的紅細胞成分容易受外界多種因素的影響而破壞[13],其中造成紅細胞熱損傷的原因主要有:①加溫血袋時袋內血液會產生熱效應,導致紅細胞的脆性增加,特別是貼壁的紅細胞,進而引起膜蛋白變性、破裂溶血;②血液長時間在高溫環境中,熱量在細胞內不斷積累、擴散,由此引起細胞分子持續受到熱損傷,超出紅細胞的熱平衡和熱耐受限度而造成膜變性、溶血;③血液黏稠度,隨著血液保存期的延長,紅細胞膜內結構不斷發生變化[14],尤其是一些衰老的紅細胞,胞內酶的活性逐漸降低,導致膜中的脂質成分發生變化,細胞變形性降低,黏稠度升高,受熱損傷破壞的機會更大,這可能是造成溶血率和血鉀升高的主要原因;④血液加溫的方式和溫度的高低等因素[15-16]。因此,加溫過程中是否造成紅細胞溶血及其程度直接關系到血液質量和輸血的安全性。
去白細胞全血中的主要有形成分是紅細胞,從低溫儲血冰箱內取出至輸入人體的過程中受震蕩、外界溫度等多種因素影響,導致紅細胞本身的變形能力和完整性遭到破壞,當較多的紅細胞破裂溶血,將產生大量的游離血紅蛋白和鉀離子,這些物質輸入體內會引起高鉀血癥等電解質紊亂的風險[17]。本次實驗結果顯示,在低于50℃范圍內給血液加溫,短時間內RBC、紅細胞形態和溶血率等方面的變化不明顯,說明適當加溫對血液成分基本無影響。
血液在流動狀態下加溫,理論上血液升高的溫度會比靜止狀態時低,短時間內對流動的紅細胞影響更小[18],本實驗結果也驗證了上述結論,提示采用流動加溫裝置輸血時,要達到相同的加溫效果,可適當調高溫度,但盡量不要超過55℃。從相關檢測結果來看,隨著溫度的升高紅細胞受損程度呈上升趨勢。因此,研究適當的血液加溫溫度,既達到血液升溫的目的,同時又能確保加溫過程中的血液質量,防止低溫輸血反應的發生是非常必要的。
根據國家衛生健康委員會《臨床用血質量控制指標(2019版)》的有關規定,臨床輸血的質量標準GB18469-2012《全血及成分血質量要求》規定保存期末全血中血漿游離血紅蛋白≤0.72 g/L[19],我國軍用標準GJB9013-2017《戰時輸血游離血紅蛋白限值》規定戰時和應急時24 h內輸注血液中游離血紅蛋白的最高限值≤3 g。本實驗研究結果表明,紅細胞在40~50℃的溫度下加溫10 min,對紅細胞的完整性和溶血程度幾乎沒有影響,短時間內適當加溫對血液各項指標是安全的,血液質量完全符合國家和軍隊的相關標準要求。但隨著溫度的增加和保存時間的延長,紅細胞溶血情況有所加重。由于本研究模擬加溫輸血的樣本量較小,加溫時間較短,而且僅模擬了體外輸血情況,臨床實際輸血時還需要考慮患者的自身狀況和病情等因素,今后深入研究應該加大標本量、延長加溫時間、進行動物輸血試驗進一步評價效果。

