人源THOC1-THOC2-THOC3亞復合物的電鏡結構研究
劉永湄,譚 明,雷 鳴
上海交通大學醫學院附屬第九人民醫院上海精準醫學研究院,上海200125
mRNA從細胞核到細胞質的轉運是真核基因表達的重要調控步驟之一,該過程與mRNA生物合成的多個步驟相聯合,以確保只有加工成熟的mRNA能被運送到細胞質中翻譯[1-4]。TREX(transcription-export)復合物是一種進化上高度保守的多蛋白亞基復合物,位于這種功能聯合的中心;顧名思義,該復合物包含了轉錄和出核的相關調控因子,參與了mRNA的轉錄、5'端加帽、剪切、3'端加工以及出核等一系列過程,是實現mRNA生物合成和質量監控的關鍵復合物[5-7]。
TREX復合物由核心的THO復合物以及RNA解旋酶UAP56(U2AF65-associated protein 56)和mRNA結合蛋白質Aly(Aly/REF export factor)組成。不同的物種中,THO復合物的組分也有所差異;在哺乳動物中THO復合物由6個蛋白質亞基組成(THOC 1~3,5~7);其中THOC1、THOC2、THOC3在酵母中存在同源物蛋白質[8-9]。作為THO復合物的高度保守的亞基,THOC1、THOC2、THOC3中任何一個組分的缺失,都會不同程度地影響細胞mRNA的出核轉運[10-11]。此外有文獻報道,許多遺傳疾病和腫瘤的發生與這3個THO復合物亞基的功能異常有關。例如,THOC1在原發性卵巢癌、結腸癌、乳腺癌和肺癌細胞內的表達水平異常升高;而在睪丸癌和皮膚癌的細胞中THOC1的表達量卻很低[12-13]。THOC2的突變與神經系統發育障礙有關,會導致不同程度的智力殘疾并表現出包括言語延遲、身材矮小、癲癇發作、步態紊亂和震顫等特征[14-15]。THOC3含有多個重復的WD40序列,用于介導蛋白質之間的相互作用[6,16]。目前THO復合物的組裝過程尚不清楚,但是THO亞復合物是作為一個整體,參與TREX的功能。UAP56具有ATP水解酶的活性[17-18],然而,其所具有的ATP水解酶和RNA解旋酶活性在mRNA出核過程的作用并不明確。Aly作為mRNA的出核配基(adaptor),通過與下游出核受體NXF1/NXT1(nuclear RNA export factor 1/nuclear transport factor 2 like export factor 1)結合,引導信使核糖核蛋白體(messenger ribonucleoprotein,mRNP)的正常出核[19-20]。
盡管TREX復合物在mRNA出核轉運過程中發揮著十分重要的作用,相關的結構生物學研究卻進展緩慢,僅有UAP56及Aly的高分辨率晶體結構以及酵母THO復合物的低分辨率晶體及負染電鏡結構被報道[21-23],這極大地限制了對TREX復合物組裝、招募、參與mRNA出核運輸的分子機制的研究。人源THO復合物與酵母THO復合物在組分上存在較大差異,并且招募機制也有所不同[8]。解析人源THO復合物的結構,對于揭示其功能和招募機制具有重要的意義,同時能為TREX復合物調控異常引起的疾病提供新的診療依據。本研究通過建立完善的昆蟲細胞表達和蛋白質體外純化體系,獲得人源THO復合物中由THOC1、THOC2、THOC3形成的亞復合物的高質量的蛋白樣品,借助透射電子顯微鏡(電鏡)和單顆粒重構技術,得到了該亞復合物的三維結構模型,從而為后續解析完整的THO復合物及TREX復合物的高分辨率結構奠定了堅實的基礎。
1.1.2 載體、菌株和細胞 pFastBac Dual載體、E.coli DH10Bac菌種、Sf9昆蟲細胞、High Five昆蟲細胞均由本實驗室保存。
1 材料與方法
1.1 實驗材料
1.1.1 主要試劑和儀器 限制性核酸內切酶、T4 DNA連 接 酶(TaKaRa),HEPES、PMSF、 咪 唑、 生 物 素(Sigma),桿狀病毒(Baculovirus)gp64 抗體(AcV5)PE(phycoerytherin)(Santa Cruz ,sc-65499PE),Ni-NTA 瓊脂 糖 凝 膠(QIAGEN),Strep-Tactin?XT Superf l ow 凝 膠(IBA),Superose 6 Increase 10/300 GL、AKTA FPLC快速純化液相色譜系統(GE Healthcare),超高壓均質機(上海勵途機械設備工程有限公司),立式離心機(Beckman Coulter),冷凍離心機(Eppendorf),電泳儀與電泳槽(Bio-Rad),細胞計數儀(Invitrogen,CountessⅡ),細胞流式分析儀(BD,FACSCalibur Flow Cytometer),高分辨軌道阱質譜儀(Thermo Scientific,Q-Exactive HF),碳膜銅網(北京中鏡科儀技術有限公司,普通碳支持膜),透射電子顯微鏡(FEI,Talos L120C)。
1.2 實驗方法
1.2.1 引物合成和DNA序列測定 均由上海鉑尚生物技術有限公司完成。
1.2.2 重組質粒的構建 利用PCR獲得人源THOC1全長(氨基酸殘基:1~657)、THOC3全長(氨基酸殘基:1~351)的編碼序列,先后插入pFastBac Dual載體,并在THOC1的C端加入Strep純化標簽,獲得pFastBac Dual-THOC1-Strep-THOC3重組質粒;利用PCR獲得人源THOC2的N端(氨基酸殘基:1~1 190)編碼序列,插入pFastBac Dual載體,并在其N端加入10×His純化標簽,獲得pFastBac Dual-10×His-THOC2重組質粒。
1.2.3 重組蛋白質表達 按照Invitrogen公司Bac-to-Bac?Baculovirus Expression System說明書進行,將pFastBac Dual-THOC1-Strep-THOC3重組質粒與pFastBac Dual-10×His-THOC2重組質粒分別轉化DH10Bac感受態菌株,制備重組桿狀病毒質粒(Baculovirus plasmid),轉染昆蟲細胞Sf9,獲得相應的初代桿狀病毒;初代病毒經過2代擴增后,收集含病毒的細胞培養液,4 ℃低溫短暫存儲;經免疫法測定病毒滴度后,將2種病毒按1∶1的滴度混合,以MOI(multiplicity of infection,病毒與細胞的比例)等于10的比例侵染新鮮的、密度為3×106個/mL的High Five昆蟲細胞。侵染后的High Five昆蟲細胞在27 ℃條件下低速振蕩培養72 h,后收取細胞進行蛋白純化。
1.2.4 免疫法測定病毒滴度 取新鮮的High Five昆蟲細胞,計數后,按一定的稀釋倍數加入待測病毒;16 h后,收集細胞,用PBS清洗3次后,取約1×106個細胞于100 μL PBS,加入 2 μL gp64 抗體,室溫孵育 1 h;加入400 μL PBS,進行細胞流式分析,統計攜帶紅色熒光的細胞占總細胞的比率;得到的比率乘以起始細胞數目及病毒液的稀釋倍數,計算出病毒的滴度。
1.2.5 THO蛋白質復合物純化 表達目的蛋白質復合物的High Five細胞2 000×g離心15 min,棄上清,用lysis buffer(20 mmol/L pH 7.5的 HEPES、200 mmol/L NaCl、10%甘油)重懸,采用超高壓均質機600 bar高壓裂解細胞;細胞裂解后經39 000×g高速離心30 min,取上清與Ni-NTA 瓊脂糖凝膠在4 ℃低速旋轉混合2 h,柱料用含20 mmol/L咪唑的wash buffer(20 mmol/L pH 7.5的HEPES、200 mmol/L NaCl)洗去雜蛋白質,再用含25 mmol/L咪唑的wash buffer洗脫目的蛋白質。得到的目的蛋白質溶液與Strep凝膠在4 ℃低速旋轉混合至少6 h,用wash buffer洗去雜蛋白質,用含50 mmol/L生物素的wash buffer洗脫目的蛋白質。將蛋白質樣品濃縮至1 mL,通過Superose 6 Increase 10/300 GL(用wash buffer平衡柱子),分開收集流出組分,經十二烷基磺酸鈉-聚丙烯酰胺凝膠電泳(SDS-PAGE)分析鑒定后,合并目的蛋白質溶液。
1.2.6 蛋白質組分的質譜鑒定 取約20 μg蛋白質,經三(2-羧乙基)膦還原和碘乙酸銨烷基化處理后,加入胰蛋白酶過夜酶解;酶解肽段利用C18柱子除鹽后,通過液相色譜 - 串聯質譜法(liquid chromatography-tandem mass spectrometry,LC-MS/MS)進行分析;質譜原始數據提交到Proteome Discoverer 2.3軟件中,使用UniProt數據庫中的人(Homo sapiens)和粉紋夜蛾(Trichoplusia ni)蛋白質數據庫進行檢索。
1.2.7 負染樣品制備、數據收集及模型構建 因甲酸雙氧鈾(uranyl formate,UF)溶液較細膩的顆粒度及其較高的浸透能力,故選擇其作為樣品的負染色液。負染電鏡實驗步驟如下:對碳膜銅網進行親水化處理后,取3.5 μL蛋白質(50 μg/mL)溶液滴于碳膜銅網,吸附1 min;用濾紙從碳膜銅網邊緣輕輕吸去多余的溶液,滴加15 μL 0.75%(質量體積比)UF負染色液,染色1 min;用濾紙吸去多余液體,室溫晾干;晾干后將樣品置于120 kV透射電鏡中觀察,放大倍數設置為73 000倍,欠焦值設置為-1~-2 μm;選擇樣品顆粒分散性和均一性較好的區域進行數據收集。隨后利用數據處理軟件EMAN2[24]和RELION3[25]對所收集的圖像進行處理并產生一個三維模型。
1.2.8 THOC3蛋白結構預測 I-TASSER(Iterative Threading ASSEmbly Refinement)是由密歇根大學開發的在線蛋白質結構與功能預測的工具,它能從PDB(Protein Data Bank)數據庫里識別結構模板,通過基于迭代模板的片段組裝模擬來構建完整的結構模型。根據網站提示,提交THOC3蛋白質序列,獲得相應的蛋白質三級結構預測數據。
2 結果
2.1 THOC1-THOC2-THOC3亞復合物表達及純化
THOC1、THOC2、THOC3亞基在哺乳動物和酵母中均非常保守,但是組分之間的相互作用尚不清楚(圖1A);人源THOC2全長為1 593個氨基酸,在進行全長蛋白的外源表達過程中,未能檢測到蛋白表達(數據未顯示)。通過在線軟件FoldIndex[26]對THOC2折疊傾向性進行預測分析發現,在THOC2的C端存在一段很大的無序區域(氨基酸殘基:1 191~1 593)(圖1B),因此截取THOC2(氨基酸殘基:1~1 190)進行外源表達;THOC1和THOC3則選擇全長進行表達。THOC2的N端帶有10×His標簽,THOC1的C端帶有Strep標簽,用于兩步親和層析。第一步通過Ni-NTA親和層析獲得的目的蛋白質帶有少量的雜蛋白質,經過第二步Strep-Tactin親和層析后得到純度較高的目的蛋白質樣品(圖1C)。為了提高樣品的均一性,目的蛋白質樣品通過Superose 6 Increase 10/300 GL進一步分離提純(圖1D),收集所有的流出組分,經SDS-PAGE鑒定(圖1E),合并含有目的蛋白質復合物的組分。純化的樣品經過LC-MS/MS鑒定,結果表明純化所得的樣品是THOC1-THOC2-THOC3亞復合物(表1)。經過整個分離純化步驟,從300 mL的High Five細胞里可純化出約1 mg的目的蛋白質復合物。
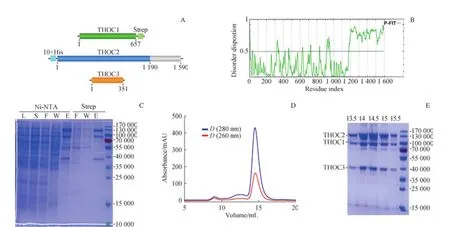
圖1 重組人源THOC1-THOC2-THOC3亞復合物的表達及純化Fig 1 Expression and purification of the recombinant human THOC1-THOC2-THOC3 subcomplex

表1 純化的THOC1-THOC2-THOC3樣品蛋白質組分質譜分析結果Tab 1 Analysis of protein components in purified THOC1-THOC2-THOC3 subcomplex by LC-MS/MS
2.2 THOC1-THOC2-THOC3亞復合物負染電鏡數據收集和三維模型的建立
在獲得高純度且均一性較好的THOC1-THOC2-THOC3亞復合物后,采用負染電鏡技術和單顆粒重構技術分析目的復合物的三維模型。樣品吸附到碳膜銅網后,經重金屬UF染色處理過后,在120 kV透射電鏡下觀察,結果表明樣品在負染條件下顆粒完整,大小均一,且分散性好,長度約為2.2 nm,和預期相對分子質量(約250 000)大小相符合(圖2A)。在同樣條件下收集負染照片129張。利用EMAN2[24]軟件手工挑選11 762個顆粒,之后使用RELION3[25]軟件進行二維分類平均和三維分類計算。分類結果表明復合物結構特征明顯(圖2B),整體呈現長條形狀(圖2C),在不同的區域有不同的優勢取向,角度分布較為均勻(圖2D)。
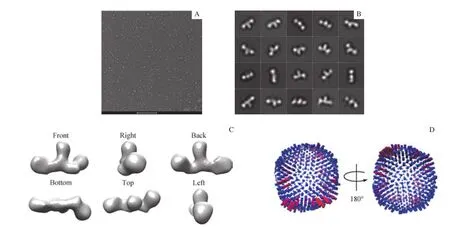
圖2 負染電鏡分析THOC1-THOC2-THOC3亞復合物Fig 2 Negative-staining electron microscopy analysis of the THOC1-THOC2-THOC3 subcomplex
2.3 THOC1-THOC2-THOC3亞復合物初步結構分析
三維分類計算結果經過進一步優化,最終得到分辨率為29 ?的人源THOC1-THOC2-THOC3亞復合物的負染三維模型(圖3A);圖像中顆粒棱角更加清晰,復合物整體結構延展,呈“F”型,整個復合物的尺度為200 ?×120 ?×80 ?(圖 3B)。由于目前尚未有 THOC1、THOC2、THOC3任何一個組分的高分辨率數據,因此,低分辨率的負染結構并不能確定各組分的相互位置。已有的研究[27]預測THOC3含有若干個WD40重復序列,所有的WD40重復序列組成一個β螺旋槳結構。我們借助結構預測軟件I-TASSER[28]模擬產生了一個THOC3(氨基酸殘基:46~351)的原子結構模型(圖3C)(THOC3 N端1~45位氨基酸未發現任何已知的同源結構域);通過軟件UCSF Chimera[29]自動匹配,確認了THOC3在亞復合物里的位置(圖3D)。發現人源THOC3在THOC1-THOC2-THOC3亞復合物中的位置和已報道的低分辨率酵母THO復合物電鏡結構中THOC3的定位相同[30],這表明在人和酵母中THOC1-THOC2-THOC3亞復合物的結構保守。
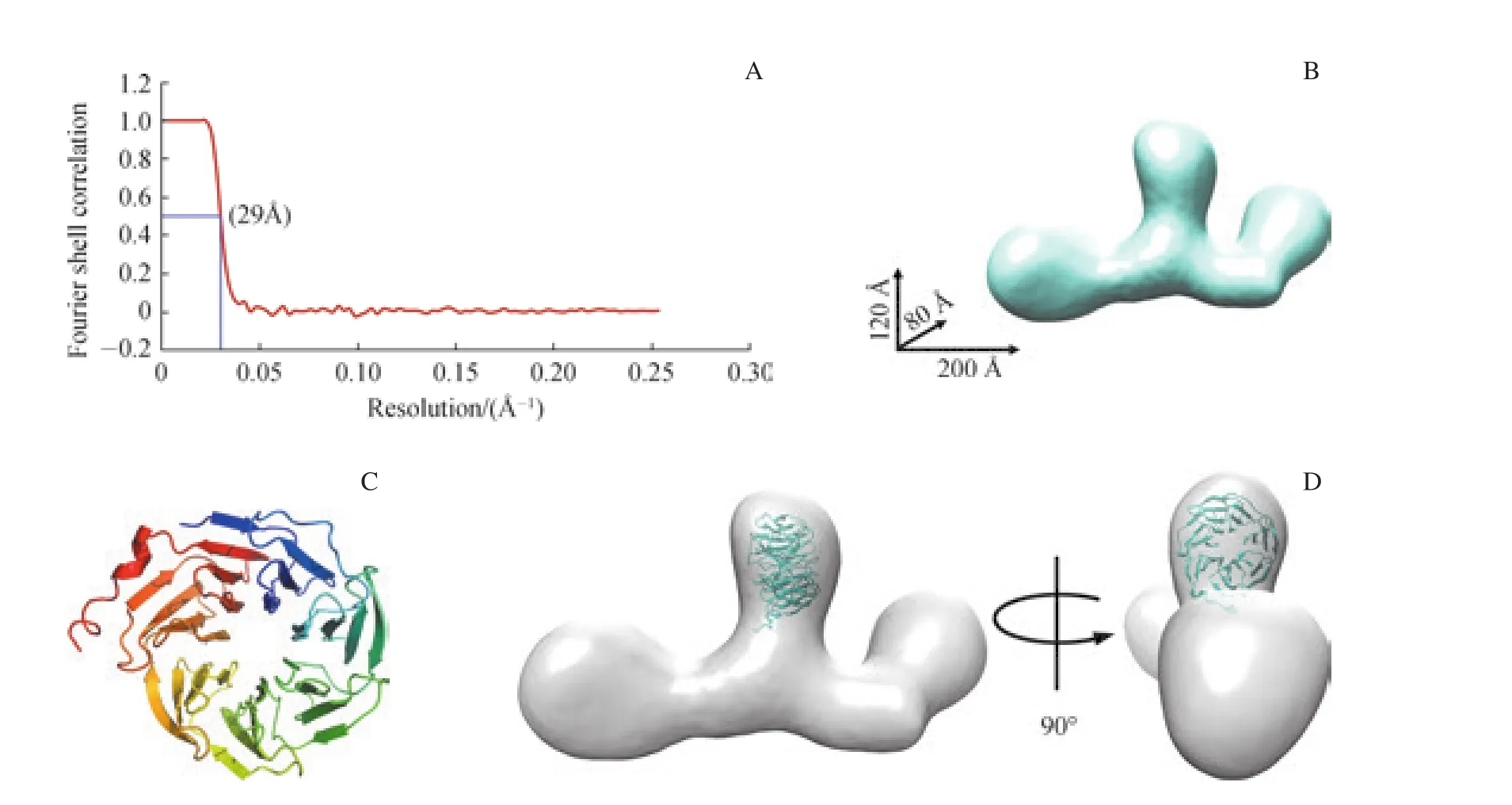
圖3 THOC1-THOC2-THOC3亞復合物負染三維模型和THOC3的定位Fig 3 Three-dimensional reconstruction of the THOC1-THOC2-THOC3 subcomplex and localization of THOC3
3 討論
自從首次在酵母和人細胞中被發現,THO/TREX復合物一直就是mRNA的加工和出核轉運研究領域的一個重要靶標[19]。相對于已報道的THO/TREX復合物功能研究,與之相關的結構生物學研究則進展緩慢,嚴重限制了對該復合物在發揮生物學活性分子機制的理解[31]。在2012年有研究者[30]發表了酵母中THO復合物(Hpr1/Tho1、Tho2、Tex1/Tho3、Mft1、Thp2)的低分辨率結構,但是至今尚無關于人源THO復合物結構的報道。與酵母不同的是,人源THO復合物含有6個亞基(THOC 1~3,5~7),其中THOC5、THOC6、THOC7在酵母中并沒有同源物,只有THOC1、THOC2、THOC3在酵母中有高度保守的同源物[8-9]。此外有研究[8]表明THO/TREX復合物在酵母和人細胞里的招募機制有所不同,因此解析人源THO/TREX復合物的結構也勢在必行。我們嘗試在體外表達重組完整的人源THO復合物,但并未得到穩定的復合物。因此,我們首先研究保守性較高的人源THOC1-THOC2-THOC3亞復合物的結構。與酵母的Tho2類似,人源的THOC2的C端包含一段高度無序的序列[30],不參與THOC1、THOC2、THOC3之間的相互作用,所以只截取THOC2 亞基1~1 190的序列用于表達純化。
我們采用兩步親和層析和一步凝膠過濾層析分離提純目標復合物,對純化的樣品進行質譜分析鑒定,確定其中的主要成分是THOC1-THOC2-THOC3亞復合物,只有極少量的70 kDa熱休克蛋白(heat shock 70 kDa protein)等雜蛋白質的污染(表1);此外,凝膠過濾層析保證實驗獲得的是整體的目標復合物,而不是分散的各個組分(圖1D),可直接用于電鏡分析。通過單顆粒重構技術,獲得了THOC1-THOC2-THOC3亞復合的低分辨率結構。除了有報道[27]表明THOC3含有典型的由WD40重復序列組成的β螺旋槳結構以外,THOC1和THOC2沒有任何結構信息,因此我們借助分子對接的方式,確定了THOC3在整個亞復合物的位置。
我們的研究首次獲得了人源THOC1-THOC2-THOC3亞復合物的負染三維模型,朝著闡明人源TREX復合物的組裝和招募的分子機制的方向踏出了關鍵的一步。與已報道的酵母的低分辨率THO復合物進行對比[30],該亞復合物呈“F”型,且THOC3/Tex1位于亞復合物的中間部位。下一步我們將優化樣品的制備條件,嘗試冷凍電鏡分析,以期獲得THOC1-THOC2-THOC3亞復合物的高分辨冷凍電鏡結構。同時,我們將優化純化條件,制備完整THO復合物并解析其冷凍電鏡結構,全面地解釋THO復合物組裝過程以及內部的相互作用。
[收稿日期]2019-10-10


團隊負責人介紹
雷鳴 LEI Ming
博士、研究員、博士生導師
Ph.D, Principle Investigator, Doctoral Supervisor ORCID ID:0000-0002-1153-4791
雷鳴(1971—),中組部“千人計劃”特聘專家。2001年博士畢業于美國哈佛大學。2001至2004年在美國科羅拉多大學波爾德分校從事博士后研究。2004至2011年在美國密西根大學醫學院生物化學系工作,歷任助理教授、副教授。2011年6月至2017年8月,擔任國家蛋白質科學中心(上海)主任,中科院生化細胞所副所長。2017年9月至今,擔任上海交通大學醫學院附屬第九人民醫院上海精準醫學研究院執行院長。現任亞太蛋白質協會執行委員、中國生物物理學會副理事長。目前擔任Biological Chemistry雜志副主編、Science Bulletin雜志執行編委。
特約創新團隊介紹
創新團隊名稱
面向臨床應用的精準醫學分析與精準醫學設計
團隊主要成員
雷鳴(研究員/博士) 匡延平(主任醫師/博士) 曹禹(研究員/博士)
卞遷(研究員/博士) 武健(研究員/博士) 張家毓(研究員/博士)
鄧瑋(副研究員/博士) 廖日晶(副研究員/博士)
LEI Ming (1971—), distinguished expert of the Recruitment Program of Global Experts by the Organization Department of the CPC Central Committee. Dr.LEI received a doctor degree of Biophysics from Harvard University in 2001.During 2001 and 2004, he received the postdoctoral training at University of Colorado at Boulder. From 2004, he began the academic career at the University of Michigan as an assistant professor and became tenured associate professor at 2010. From 2011 to 2017, he was the Deputy Director of Shanghai Institute of Biochemistry and Cell Biology, Chinese Academy of Sciences and Director of National Center for Protein Science Shanghai, China. From 2017 to present, he has been the Executive Director of Shanghai Institute of Precision Medicine, Shanghai Ninth People’s Hospital, Shanghai Jiao Tong University School of Medicine. He is the Executive Committee member of Asia Pacific Protein Association and the Deputy Secretary of Biophysical Society of China. He is also the Associate Editor of Biological Chemistry and the Executive Editor of Science Bulletin.
Dr. LEI is focusing on understanding the organization and dynamics of macromolecular assemblies important for genome regulation and stability and have made significant progress in this fi eld. He had the experience of leading the Ministry of Science and Technology 973 Program of China and the National Natural Science Foundation Key Program and Joint Funds of Key Program of China, and participating in the Strategic Priority Research Program of the Chinese Academy of Sciences and the National Science and Technology Major Project ‘Key New Drug Creation and Manufacturing Program’ of China. He was supported by the National Natural Science Foundation for Distinguished Young Scholars of China in 2015 and by the Outstanding Academic Leader Program of Science and Technology Commission of Shanghai Municipality in 2016.
雷鳴研究員長期致力于蛋白質復合體為主的生物大分子的結構和分子機制及其在癌癥和衰老中的作用等科研工作,取得了多項突破性的研究成果。自回國以來,承擔多項國家級和省部級科研任務,作為首席科學家主持國家科技部“973”重大研究計劃項目1項,主持國家基金委重點項目2項,主持國家基金委大科學裝置聯合基金項目1項,參與中科院戰略性先導技術專項(B類)1項,參與國家科技部重大新藥創制專項計劃1項,參與國家科技部蛋白質科學重大研究計劃項目2項,并得到2015年度國家杰出青年科學基金、2016年度上海市優秀學科帶頭人等人才項目支持。

主要研究方向
綜合應用結構生物學、生物化學以及細胞生物學等多種技術手段,雷鳴研究員領導的團隊深入探討了以蛋白質復合體為主的生物大分子的結構和分子機制及其在癌癥和衰老中的作用。在染色體研究特別是端粒、長鏈非編碼RNA以及表觀遺傳學等領域做出了多項突破性的工作,取得了豐碩的研究成果,受到了國際同行的廣泛關注與認可。在Cell、Nature、Science、Mol Cell、Nat Struct Mol Biol等國際頂級學術期刊上發表論文70余篇,論文他引次數達3 000次以上。上述成果為我們更好地理解這些蛋白質復合物相關的生理進程奠定了重要的基礎,并為相關的疾病機制探索及新型藥物研發提供了理論依據。
The goal of Dr. LEI’s group is to understand the organization and dynamics of macromolecular assemblies important for genome regulation and stability. With combination of structural analyses, such as X-ray crystallography, nuclear magnetic resonance and electron microscopy, coupled with biophysical, biochemical and cellular approaches, Dr. LEI’s group has made important progress on telomeres, long noncoding RNAs (lncRNAs)and epigenetics among others. During the last fi ve years, this group has published more than 70 SCI-indexed papers in Cell, Nature, Science, Mol Cell, Nat Struct Mol Biol, et al, with a total citation number of more than 3 000. These studies provide a solid foundation for our understanding of the molecular basis associated with the important protein complexes and open a new horizon on novel drug development.
近2年代表性成果
1) Chen H, Xue J, Churikov D, et al. Structural insights into yeast telomerase recruitment to telomeres[J]. Cell, 2018, 172(1/2): 331-343.
2) Lan P, Tan M, Zhang Y, et al. Structural insight into precursor tRNA processing by yeast ribonuclease P[J]. Science, 2018, 362(6415). DOI: 10.1126/science.aat6678.
3) Wu J, Niu S, Tan M, et al. Cyro-EM structure of human ribonuclease P holoenzyme[J]. Cell, 2018, 175(5): 1393-1404.
4) Wang Y, Chen Y, Chen J, et al. The meiotic TERB1-TERB2-MAJIN complex tethers telomeres to the nuclear envelope[J]. Nat Commun, 2019, 10(1):564.
5) Wan F, Wang Q, Tan J, et al. Cryo-electron microscopy structure of an archaeal ribonuclease P holoenzyme[J]. Nat Commun, 2019, 10(1): 2617.
6) Wan B, Wu J, Meng X, et al. Molecular basis for control of diverse genome stability factors by the multi-BRCT scaffold Rtt107[J]. Mol Cell, 2019,75(2): 238-251.

