川芎嗪對急性肺損傷的保護作用及其可能機制
林欣,陸學芬,杭黎華
(江蘇大學附屬昆山醫院 麻醉科,江蘇 昆山 215300)
肺損傷過程中,肺泡膜的完整性破壞及通透性的改變是導致急性肺損傷的根本原因[1]。細胞連接維持肺泡膜完整性和通透性,它主要包括黏附連接(adherent junction,AJ)和緊密連接(tight junction,TJ),其中TJ在維持肺泡黏膜上皮機械屏障和肺泡膜通透性中起著更加重要的作用[2]。TJ通常位于上皮細胞頂端相鄰細胞間,對維護上皮細胞兩側物質的差異和保持細胞極性起著重要的作用。TJ蛋白是由一系列跨膜蛋白和外周蛋白相互作用而形成的復雜的蛋白質體系,主要包括跨膜蛋白家族(claudin和occludin)、連接黏附蛋白(junctional adhesion molecule,JAM),并與胞漿內的膜周蛋白(zonulae occludente,ZO)包括ZO-1、2、3,肌動蛋白與細胞骨架直接連接,是肺泡上皮屏障的重要組成成分[3]。occludin蛋白是其中重要的蛋白之一,上皮細胞通過occludin蛋白封閉細胞間隙,并與ZO-1等結合形成TJ的基礎結構[4]。在occludin蛋白功能的調節中,絲/蘇氨酸的磷酸化狀態較為重要,其主要受蛋白激酶C(protein kinase C,PKC)的影響[5-6]。PKC能激活細胞質中的靶酶參與生化反應的調控,同時也能作用于細胞核中的轉錄因子,參與基因表達的調控,調節細胞的代謝、生長和分化。從以上研究我們發現,occludin蛋白的表達減少或磷酸化活性改變會導致TJ的破壞,肺泡通透性增加,引發肺水腫肺損傷,如果能增加occludin的表達或調節其活性也許會減輕或延緩肺損傷的發生發展。
川芎嗪(tetramethylpyrazine,TMP)是中藥川芎的有效成分之一,化學結構為四甲基吡嗪,臨床上主要用于治療慢性頑固性哮喘、肺纖維化、閉塞性血管疾病等。基礎研究[7]顯示,TMP具有改善缺血部位血流速度、減輕血管外周阻力,從而改善局部血液微循環的作用,還能夠降低前列腺素合成,抑制淋巴細胞、中性粒細胞等釋放腫瘤壞死因子-α(TNF-α)及白細胞介素-1β(IL-1β)等,避免組織受到反復刺激產生炎癥因子。TMP應用于肺缺血再灌注大鼠模型中,可以減少丙二醛(MDA)、髓過氧化物酶(MPO)、超氧化物歧化酶(SOD)等的釋放,提高內源性清除氧自由基的能力,產生抗氧化應激,對抗肺缺血再灌注的病理損傷[8]。但TMP對肺組織作用的研究大多局限于炎癥因子,對肺損傷過程中肺泡膜完整性及通透性缺乏更深層次的研究。
本研究擬探討大鼠肺過度通氣所致急性肺損傷模型中,TMP干預對氣道血漿微滲漏、肺緊密連接蛋白occludin和ZO-1以及肺組織炎癥因子表達的影響,探究TMP對急性肺損傷的保護作用及其機制。
1 材料與方法
1.1 動物及分組
健康SD大鼠(體重250~300 g)45只,隨機分為單純氣管插管組(對照組)、肺通氣組(模型組)及肺通氣加TMP霧化吸入組(干預組)3組。實驗動物由江蘇大學附屬昆山醫院動物實驗中心提供,本研究已獲得醫院倫理委員會批準。
1.2 大鼠實驗方法
所有大鼠用3%戊巴比妥鈉腹腔注射麻醉,置于仰臥位并固定四肢。氣管切開后行氣管插管。對照組單純行氣管插管;模型組使用RSP1002型小動物呼吸機行機械通氣,通氣設置:吸氣呼氣比(I∶E)1∶1,呼吸頻率(RR)80次·min-1,通氣量(VT) 10 ml·kg-1,氧濃度分數(FiO2)100%,通氣2 h;TMP組在通氣前氧氣驅動霧化吸入TMP 20 mg·kg-1·h-1,驅動氧流量 5~6 L·min-1,吸入30 min。
1.3 大鼠氣道血漿微滲漏檢測
取上述每組大鼠各7只,行氣道血漿微滲漏檢測。參考文獻[9],大鼠尾靜脈注射伊文思藍1 ml,10 min后剪開胸腔,左心房切一小口,從右室插入14 F針頭入肺動脈灌注生理鹽水250 ml以去除血管內的染料;取右支氣管、右肺上葉,置于甲酰胺內24 h,于37 ℃水浴箱內提取伊文斯藍染料,測定620 nm處吸光度。根據標準曲線測定組織內染料濃度。切取氣管和左主支氣管,行冰凍切片,直接熒光顯微鏡下觀察伊文斯藍熒光。
1.4 免疫蛋白印跡檢測
取上述每組大鼠各8只,剪開胸腔取左肺組織,檢測occludin(1∶500,Novus公司)和ZO-1(1∶800,Abcam公司)的表達。冰上操作,快速將肺組織剪成小塊,提取總蛋白,用BCA法檢測蛋白濃度。經過凝膠電泳、轉膜、封閉、加入一抗和二抗后,在掃描儀上獲取圖像,應用Alpha軟件處理系統分析條帶灰度值,蛋白水平用目標蛋白與內參照3-磷酸甘油醛脫氫酶(GAPDH)條帶灰度值比值表示。
1.5 酶聯免疫吸附試驗
將1.4中大鼠右肺組織取出,檢測occludin、ZO-1、IL-1β、IL-6、TNF-α的含量。具體實驗過程按試劑盒(美國Cayman公司)說明書進行。冰上操作,剪成小塊組織勻漿。所有組織勻漿標本稀釋10倍,加入標準稀釋液至空白孔和零孔,加入標本和已稀釋的不同濃度的標準品各100 μl至相應孔中。加入標志物,用膜把板封好,4 ℃孵育過夜。棄去廢液,用洗液洗板5次,然后每孔加入200 μl顯色劑,用膜封好,避光振蕩60 min。在酶標儀上405 nm處測吸光度。根據試劑公司提供的方法繪制標準曲線,求出標本中含量。
1.6 統計學處理
所有數據以均數±標準差表示,采用SPSS 17.0軟件分析。多組間比較采用單因素方差分析(ANOVA),進一步組間兩兩比較采用LSD-t檢驗,P<0.05表示差異具有統計學意義。
2 結 果
2.1 各組大鼠氣道血漿微滲漏比較
見圖1。與對照組比較,模型組大鼠氣道伊文思藍熒光亮度顯著增強,而干預組大鼠氣道伊文思藍熒光亮度較模型組顯著減弱;各組氣道伊文思藍熒光平均光密度值差異有統計學意義(F=10.234,P=0.016),模型組顯著高于對照組(2.85±0.67vs1.09±0.35,P=0.003),而干預組顯著低于模型組(2.12±0.44vs2.85±0.67,P=0.031);肺組織內伊文思藍濃度各組差異有統計學意義(F=5.897,P=0.009),模型組顯著高于對照組(69.45±19.87vs25.63±8.74,P=0.000),而干預組顯著低于模型組(45.62±12.18vs69.45±19.87,P=0.012)。上述結果表明,機械通氣可造成大鼠氣道損傷,血漿微滲漏顯著增加,而霧化吸入TMP可改善機械通氣造成的氣道血漿微滲漏的增加。
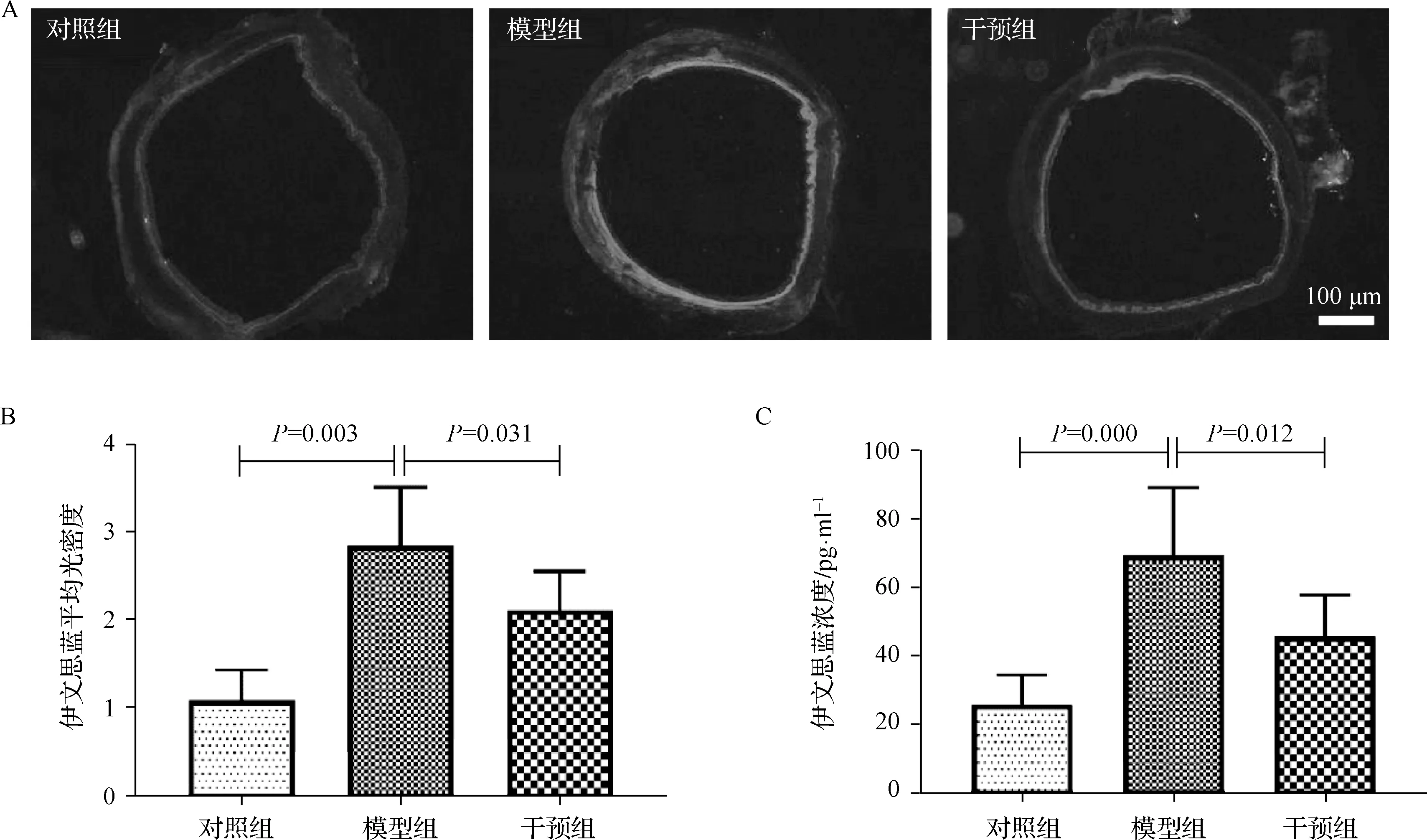
圖1 各組大鼠氣道血漿微滲漏情況 A.大鼠氣道伊文思藍熒光染色;B.大鼠氣道伊文思藍平均光密度值;C.大鼠肺組織伊文思藍濃度
2.2 各組大鼠肺組織細胞間緊密連接蛋白比較
見圖2。與對照組比較,模型組大鼠肺組織細胞間緊密連接蛋白ZO-1、occludin表達顯著減少,而干預組較模型組顯著增多;蛋白水平與GAPDH相比(ZO-1/GAPDH:F=12.119,P=0.023;occludin/GAPDH:F=13.412,P=0.026),模型組顯著高于對照組(ZO-1:0.62±0.15vs1.23±0.22,P=0.012;occludin:0.59±0.14vs1.15±0.25,P=0.001),而干預組顯著低于模型組(ZO-1:0.78±0.19vs0.62±0.15,P=0.046;occludin:0.81±0.22vs0.59±0.14,P=0.039);ELISA結果(ZO-1濃度:F=9.746,P=0.017;occludin濃度:F=11.264,P=0.013),模型組顯著高于對照組(ZO-1:16.52±5.98vs38.64±12.18,P=0.009;occludin:48.12±11.98vs69.71±25.74,P=0.026),而干預組顯著低于模型組(ZO-1:25.19±8.74vs16.52±5.98,P=0.022;occludin:59.21±15.72vs69.71±25.74,P=0.041)。上述結果表明,機械通氣可造成大鼠肺泡間緊密連接破壞,而霧化吸入TMP可改善此現象。
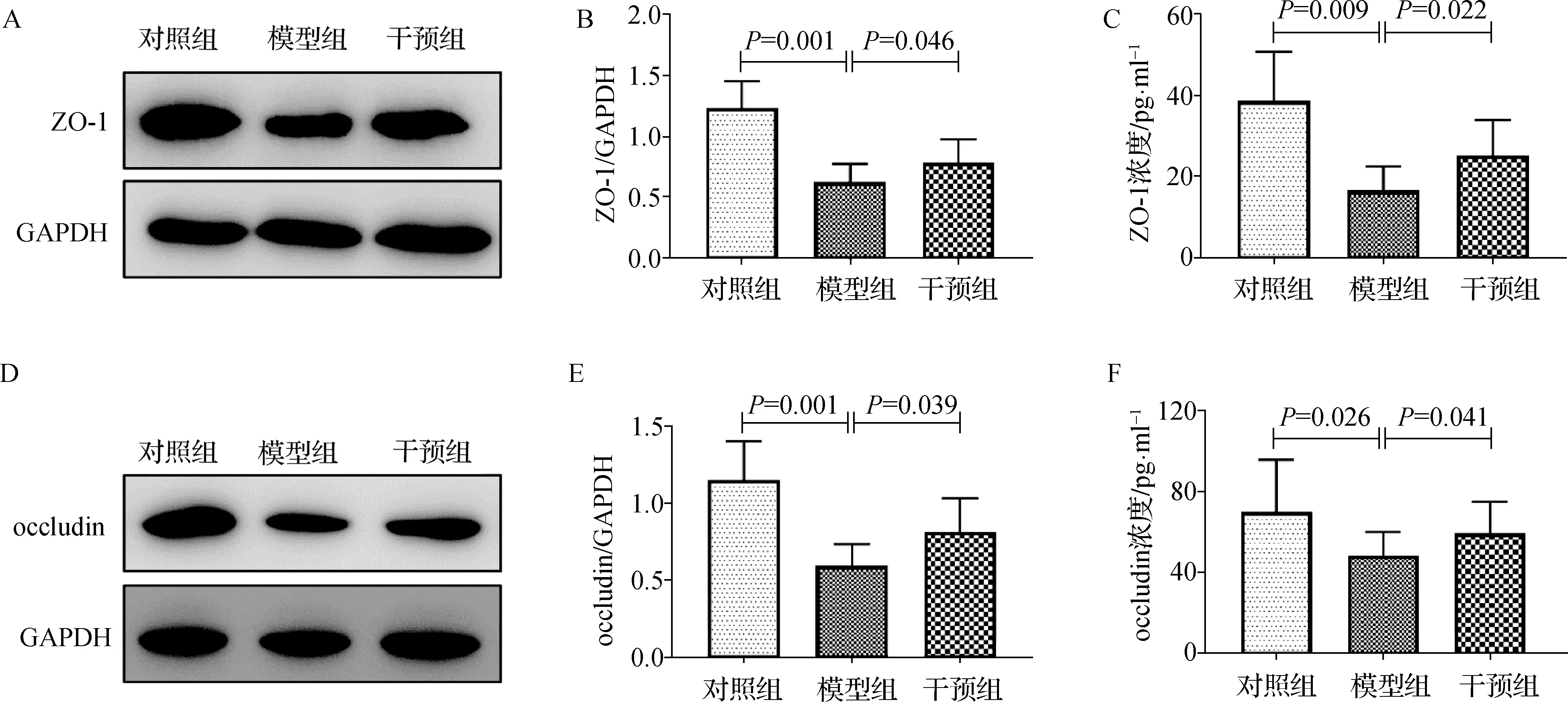
圖2 各組大鼠肺組織緊密連接蛋白表達水平 A、D.大鼠肺組織ZO-1、Occludin表達;B、E.大鼠肺組織ZO-1、Occludin表達的比較;C、F.大鼠肺組織ZO-1、Occludin濃度的比較
2.3 各組大鼠肺組織炎癥因子含量比較
見圖3。肺組織炎癥因子含量3組間差異有統計學意義(IL-1β:F=6.382,P=0.009;IL-6:F=7.778,P=0.011;TNF-α:F=9.956,P=0.015)。與對照組比較,模型組大鼠肺組織IL-1β(62.59±18.41vs26.74±9.41,P=0.002)、IL-6(32.11±7.42vs15.23±4.45,P=0.003)、TNF-α(98.67±25.47vs60.12±12.84,P=0.019)含量顯著增高;與模型組比較,干預組大鼠肺組織IL-1β(50.13±15.67vs62.59±18.41,P=0.039)、IL-6(26.84 ±6.99vs32.11±7.42,P=0.037)、IL-6(85.61±20.13vs98.67±25.47,P=0.046)含量顯著降低。上述結果表明,機械通氣可誘導氣道炎癥,而霧化吸入TMP可改善炎癥水平,減少炎癥因子的釋放。

圖3 各組動物氣道肺組織炎癥因子水平 A.動物肺組織IL-1β的濃度;B.動物肺組織IL-6的濃度;C.動物肺組織TNF-α的濃度
3 討 論
急性肺損傷發病急驟,死亡率高,包括各種抗炎/促炎因素、體液與細胞免疫因素、神經源性炎癥以及環境因素等等,目前機制尚未完全清楚。不同機械通氣量對呼吸循環系統都會造成影響[10],且機械通氣誘發的急性肺損傷是其中的一個重要類型[11],主要是因為手術或者危重癥患者在急性機械通氣過程中,通氣因素和患者肺部因素的相互作用,進而導致肺部損傷,產生一系列病理生理改變,包括肺泡的破壞即屏障功能的損傷,以及炎癥因子的大量釋放[12]。因此肺內炎癥反應失控是誘發彌漫性急性肺損傷的重要因素。
我國傳統中藥對急性肺損傷的治療目前已經有較多的基礎和臨床研究。比如葛根素、青蒿素、參脈等藥物,在改善炎癥、微循環等方面均有一定的療效,但關于TMP在治療急性肺損傷方面的研究較少。TMP是我國傳統中藥川芎的主要成分之一,既往研究發現其有多種藥理作用[13],包括:(1) 免疫調節功能。TMP可抑制一些細胞因子特別是炎癥因子的釋放,因此具有抑制炎癥反應作用。(2) 抗凝、抑制血栓形成以及擴張外周血管作用。TMP可以增加小微血管如微動脈、微靜脈和毛細血管等的管徑,因此可以增加血流量,使血流黏稠度降低。(3) 抗凝、抑制血小板聚集的作用,從而較少小血管內微血栓的形成,起到改善微循環的作用。(4) 改善氧化/抗氧化作用,部分有鈣拮抗劑的特性,還可以促進能量合成。
單肺通氣時采用的大潮氣量通氣使健側肺肺泡受到過度機械牽張,而非通氣側肺不僅因缺氧引起肺泡萎陷,而且由于缺氧性肺血管收縮導致血流灌注不足;當萎陷肺復張時,肺組織恢復灌注,從而導致肺損傷[14]。造成急性肺損傷的分子機制較為復雜,比如巨噬細胞激活可增加肺損傷的程度[15],TLR4、Akt信號通路激活[9]及NF-κB、MAPK信號通路也起著重要的作用[16]。本研究中大鼠動物模型模擬了機械通氣造成的急性肺損傷,基本符合人急性肺損傷的病理生理過程。研究發現,予大鼠機械通氣,可導致氣道血漿微滲漏增加,肺組織細胞間緊密連接破壞,肺組織內炎癥因子釋放增加,而提前給予TMP霧化吸入干預,可以改善上述現象,使氣道血漿微滲漏程度降低,細胞間緊密連接破壞減少,炎癥因子釋放減少,故而可以認為TMP對機械通氣造成的急性肺損傷具有保護作用,因此TMP在今后有可能作為治療急性肺損傷的新藥而應用于臨床。
綜上所述,TMP可以減輕機械通氣誘發的急性肺損傷中炎癥反應,減少肺組織細胞間緊密連接破壞以及炎癥因子釋放,降低肺血管通透性,減輕肺組織損傷。

