血管內皮生長因子與單側輸尿管梗阻大鼠腎間質纖維化程度的相關性研究1
謝 敏,周建華,朱國琴,張 瑜
(1.電子科技大學醫學院附屬婦女兒童醫院·成都市婦女兒童中心醫院小兒腎臟科,四川成都 611731;2.華中科技大學同濟醫學院附屬同濟醫院小兒腎臟科,湖北武漢 430060;3.無錫市兒童醫院兒童腎臟科,江蘇無錫 214000)
腎間質纖維化是慢性腎臟疾病(CKD)發展為終末期腎臟病(ESRD)的最后通路[1],其發病機制非常復雜,與蛋白激酶通路的激活、氧化應激、炎性反應等多因素相互作用相關。既往研究證實,腎小管周圍血管內皮結構的損傷和改變可以導致腎臟濾過功能下降最終發展為腎間質纖維化[2]。血管內皮生長因子(VEGF)由腎小管上皮細胞分泌,具有營養、活化、促進血管生成的功能,對于維持腎小管周毛細血管正常結構與功能有著重要作用,推測VEGF可能與腎間質纖維化有較為密切的關系[3]。本研究以單側輸尿管梗阻大鼠為實驗模型,觀察不同時間點腎組織VEGF的表達情況,分析其與腎功能、24 h尿蛋白、腎間質纖維化程度的相關性,探究其在腎間質纖維化發生發展中所起的作用,進而為腎臟疾病早期藥物治療的研究提供實驗依據 。
1 材料與方法
1.1實驗動物與模型制作 普通級SD雄性成年大鼠42只,體質量160~200 g,由華中科技大學同濟醫學院動物實驗中心提供。運用隨機方法分為假手術組和單側輸尿管梗阻模型組(UUO組),每組21只大鼠。動物模型制備:大鼠以10%水合氯醛300 mg/kg,腹腔注射,行左側腹部切口,逐層分離暴露左側輸尿管,用0#絲線上下結扎2處,上一處結扎點位于左腎下極水平,然后于結扎點間剪斷輸尿管,縫合肌肉、皮膚層制備大鼠單側輸尿管梗阻模型。假手術組大鼠開腹后不結扎輸尿管,直接縫合腹腔,作為對照[4]。2組分別于手術后第5、15、25天處死大鼠,每個時間點處死7只,留取腎組織常規石蠟包埋切片,經HE+Masson染色證實大鼠單側輸尿管梗阻造模成功。
1.2主要試劑 兔抗大鼠VEGF多克隆抗體(美國Peprotech公司),生物素化山羊抗兔IgG(美國Peprotech公司),SABC試劑盒(美國Peprotech公司),H2O2-氨基聯苯胺(美國Peprotech公司)。
1.3免疫組織化學染色 采用鏈霉素親和素-生物素復合物(SABC)技術檢測VEGF的表達,操作步驟按說明書進行。
1.4實驗結果分析方法
1.4.124 h尿液標本采集 各組大鼠分別于第5、15和25天處死,每次7只。處死前將各組大鼠放入代謝籠中收集24 h尿液,尿蛋白測定使用尿蛋白雙縮脲試劑盒完成。
1.4.2腎功能檢測 血肌酐及尿素氮檢測按血肌酐檢測試劑盒及血尿素氮檢測試劑盒操作步驟完成。
1.4.3腎臟組織病理學 將組織切片進行HE、Masson染色,在光學顯微鏡下進行腎間質纖維化程度半定量評分,采取雙盲法,取各組平均值。每張切片至少觀察40個皮質區200倍視野,測定間質纖維化面積占同視野小管間質總面積的百分比,積分如下:0分為正常無病變;1分為腎小管上皮細胞輕度萎縮、變性,病變范圍<15%;2分為腎小管上皮細胞中度萎縮,纖維組織少量增生,病變范圍15%~25%;3分為腎小管變性、壞死輕,纖維組織中度增生,病變范圍26%~50%;4分為腎小管變性、壞死中度,纖維組織多灶狀增生,病變范圍51%~75%;5分為腎小管上皮細胞萎縮,成片壞死,纖維組織增生呈片狀,病變范圍>75%[5-6]。
1.4.4VEGF表達半定量評分 腎臟皮質觀察40個連續不重疊的200倍視野,細胞胞質呈現棕黃色顆粒為陽性信號,光鏡下觀察陽性染色的分布,分為0~3分:0分為無染色,1分為局部染色,2分為輕度至中度彌散染色,3分為重度彌散染色。計算 20個腎皮質高倍視野(×200)分值、求和、取均值,3人盲法同時進行,取平均值,得VEGF表達分值[7]。
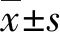
2 結 果
2.12組大鼠24 h尿蛋白定量及大鼠腎功能改變 UUO組術后第5、15天,血肌酐和尿素氮均升高,提示腎功能損傷,且明顯高于同期假手術組,差異有統計學意義(P<0.05)。但術后第25天增高的尿素氮值較前下降,分析可能與健側腎臟代償有關。術后第5天,UUO組與假手術組比較,24 h尿蛋白定量差異無統計學意義(P>0.05),術后第15、25天,UUO組24 h尿蛋白逐漸升高,均高于假手術組,差異有統計學意義(P<0.05)。見表1。

表1 2組大鼠血尿素氮、血肌酐、24 h尿蛋白定量檢測結果
注:與假手術組比較,aP<0.01,bP<0.05。
2.2腎小管間質病理改變 假手術組各期腎小管形態正常,無明顯萎縮,腎間質無炎癥細胞浸潤。UUO組,術后第5天,腎間質小灶狀炎癥細胞浸潤,部分腎小管管腔擴張;術后第15天,腎小管間質見較多炎癥細胞浸潤,較多腎小管管腔擴張,少數腎小管萎縮,腎間質開始出現纖維化改變;術后第25天,腎間質大片炎癥細胞浸潤,腎小管片狀萎縮,腎間質明顯纖維化。見圖1、2。

注:A表示假手術組第5天;B表示假手術組第15天;C表示假手術組第25天;D表達UUO組第5天;E表示UUO組第15天;F表示UUO組第25天。
圖1 2組腎小管間質纖維化病理圖

注:與假手術組相比,aP<0.01 。
圖2 2組腎小管間質纖維化評分
2.3VEGF的表達水平 假手術組:各時期幾乎所有腎小管均表達VEGF。UUO組:術后第5天,可見部分腎小管基底膜有VEGF表達,其表達量低于假手術組;術后第15天,VEGF表達量明顯下降,腎間質炎癥細胞浸潤及腎小管擴張明顯區域,可見少許VEGF表達;術后第25天,VEGF表達持續降低,部分腎小管萎縮區域呈弱陽性表達,腎間質纖維化嚴重的區域VEGF無表達。UUO組在第5、15、25天VEGF的表達量均低于同期假手術組,差異有統計學意義(P<0.05)。見圖3、4。

注:A表示術后第25天假手術組VEGF廣泛表達于所有腎小管;B表示術后第25天UUO組腎小管萎縮處VEGF弱表達。
圖3術后第25天VEGF表達(免疫組織化學×200)

注:與假手術組相比,aP<0.01。
圖4各組VEGF表達評分
2.4UUO組VEGF在腎小管間質的表達與24 h蛋白尿定量、血肌酐及尿素氮的關系 在第5天時,VEGF的表達和24 h尿蛋白定量呈正相關(P<0.05),第15、25天VEGF的表達和24 h尿蛋白定量無明顯相關性(P>0.05);各個時間點VEGF的表達與血肌酐及尿素氮的水平無明顯相關性(P>0.05)。見表2。

表2 UUO組中VEGF與24 h蛋白尿定量、血肌酐及尿素氮的相關系數
注:表示相關性,aP<0.05。
3 討 論
腎間質纖維化是各種CKD進展到終末期的共同途徑,嚴重危害人類健康。因此,關于腎間質纖維化的研究逐漸成為慢性病的研究熱點。腎間質纖維化的機制較為復雜,炎癥細胞浸潤致腎小管上皮細胞激活,釋放細胞因子,刷狀緣損傷、凋亡或壞死的腎小管上皮細胞堵塞小管導致腎功能下降[8-9]。除此之外,腎小管周毛細血管內皮細胞損傷,腎間質缺血缺氧誘導成纖維細胞轉分化,最終導致腎小管間質纖維化的發生[10]。VEGF是一種具有親肝素活性的糖基化分泌性多肽因子,可以促進血管內皮細胞增殖,增強血管通透性,有利于新生血管的生成[11]。有研究證實,VEGF可以使腎小管內皮依賴性血管擴張,幫助維持腎小管完整性,在急性腎損傷治療領域發揮重要作用[12]。有實驗發現通過抑制血管緊張素Ⅱ調節VEGF的表達抑制腎小球毛細血管功能的完整性可以保護腎臟功能[13]。
單側輸尿管梗阻模型通過結扎單側輸尿管致梗阻性腎病,是研究腎間質纖維化的經典模型,有文獻報道,單側輸尿管梗阻模型建立的成功率高于常規背側入腹行輸尿管上段結扎的術式,且明顯地降低了腎積膿的發生率[14]。本研究通過制作單側輸尿管梗阻大鼠模型,經HE和Masson染色,觀察到隨梗阻時間延長,UUO組大鼠腎小管間質彌散性炎性細胞浸潤,腎小管萎縮,腎間質大面積纖維化,證明單側輸尿管梗阻模型造模成功。在本實驗中通過測定不同時間點腎小管間質VEGF的表達水平,探討其與腎小管間質纖維化的關系。實驗結果發現UUO組術后第5天VEGF表達量開始下降,與假手術組比較差異有統計學意義(P<0.05),第15天VEGR表達量進行性下降,僅在少許的腎小管上皮細胞中有表達。第25天VEGR表達量顯著下降,腎間質纖維化嚴重的區域幾乎無表達。實驗證實UUO組隨著梗阻時間延長,腎小管間質缺血缺氧加重,大量的炎性細胞浸潤到腎間質,進一步加重了腎臟的纖維化程度。本研究發現VEGF的表達量與腎功能無明顯相關性,可能與健側腎功能代償有關,在第5天時,VEGF的表達與24 h尿蛋白定量呈正相關(P<0.05),第15、25天VEGF的表達和24 h尿蛋白定量無明顯相關性(P>0.05)。實驗結果證實VEGF表達與腎間質纖維化病變活動相關,早期監測VEGF在腎間質中的表達可以判斷腎間質纖維化活動性病變。
4 結 論
VEGF與腎間質纖維化進展密切相關,其在調節細胞外基質合成與分解及調控腎小管周毛細血管生長中起關鍵作用[15]。研究VEGF參與早期腎間質纖維化毛細血管新生的機理,有助于對腎間質纖維化機制的進一步認識,為抑制腎纖維化的進展,改善腎功能提供理論依據[16]。通過監測腎間質纖維化過程中VEGF的表達,實現對腎間質纖維化的早期干預有待筆者進一步研究。

