胰腺原發性鱗狀細胞癌一例
孫尚國,丁振,王向陽,安東,肖大樹
(安徽醫科大學附屬巢湖醫院 肝膽外科,安徽 合肥 238000)
胰腺癌有“癌中之王”之稱,預后差,且臨床病理分型以腺癌最常見。但近年來,隨著臨床科研、診療水平的提高,一些罕見的胰腺鱗癌的病例逐漸被報道,并得到該領域醫務人員的關注。本文回顧性分析安徽醫科大學附屬巢湖醫院2018年11月5日收治的一例胰腺原發性鱗狀細胞癌患者資料,就其臨床表現、影像學表現及治療方法進行總結,以期加強臨床工作中對此病的認識。
1 病例資料
患者男性,67歲,因“反復右上腹部脹痛不適3月余”入院,體質量下降約3 kg。腹部CT示(圖1):胰腺體尾部厚壁囊性占位,考慮MT(腫瘤)可能伴脾靜脈受侵,肝左葉稍低密度,考慮轉移瘤可能,腹腔輕度腫大淋巴結,擬“胰腺體尾部囊性占位”于2018年11月5日收入院。入院后查體無明顯陽性體征,血清腫瘤標志物:AFP 8.79 ng/mL,CEA 39.47 ng/mL↑,CA19-9 39.60 U/mL↑,CA125 66.21 U/mL↑;余檢(-)。術前診斷為:胰腺占位性病變(體尾部囊性癌?),肝左外葉占位性病變(轉移性病灶?)。
于2018年11月8日行手術治療。探查發現:腹腔內無腹水,肝臟呈暗紅色,質軟,無硬化。打開橫結腸系膜,見胰腺體尾部有一腫塊約直徑4 cm,侵犯脾靜脈,與胃后壁粘連緊密,肝臟左外葉近第二肝門部有一腫塊約直徑2 cm,探查后決定行胰體尾切除術+脾切除+肝左外葉切除術。
術后病理(圖2):(胰體尾)形態學符合中分化鱗狀細胞癌,浸潤或轉移,胰腺切緣未見癌累及;(肝臟)符合中分化鱗狀細胞癌;(脾臟)未見癌累及;胰腺脾門周圍淋巴結(0/6)及網膜組織未見癌轉移。
對于本例患者,結合病史、術前輔助檢查(胃鏡、CT等)及術后病理、術后免疫組化(腫瘤組織表達細胞角蛋白及p63,不表達甲狀腺轉錄因子-1,見圖3)、術后再次胃鏡檢查(反流性食管炎、膽汁反流性胃炎、慢性非萎縮性胃炎),排除消化道等其他鱗狀細胞癌轉移到胰腺的可能,診斷為胰腺原發性鱗狀細胞癌。
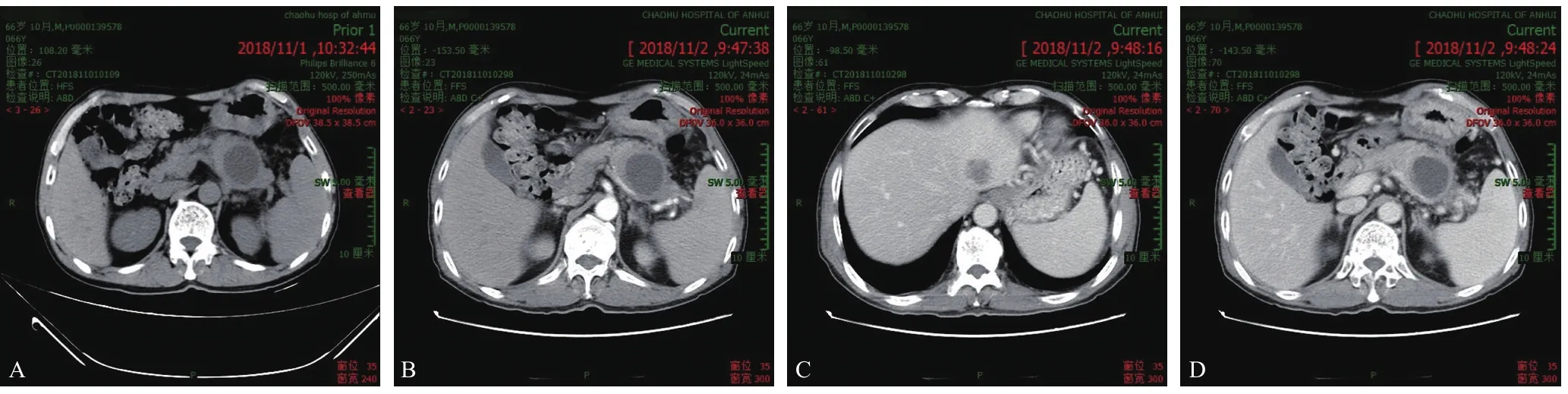
圖1 術前腹部CT檢查

圖2 術后病理:腫瘤細胞呈巢狀排列,圓形或多角形,角化珠易見,細胞異型,浸潤性生長(HE,×40)
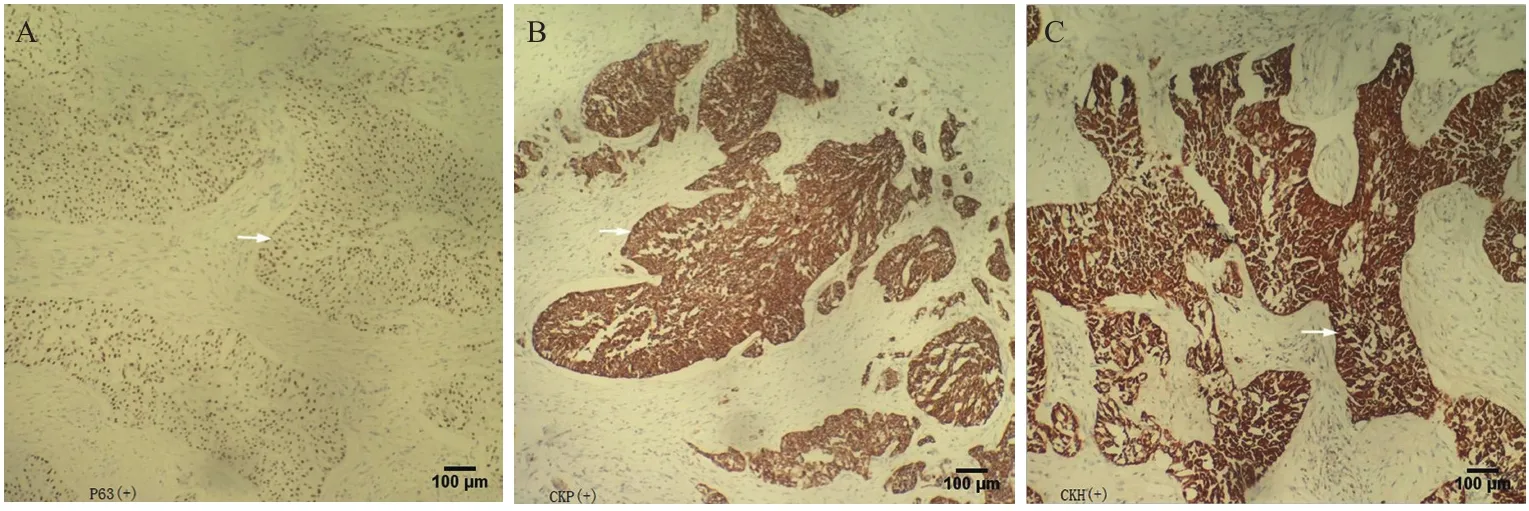
圖3 術后免疫組化:腫瘤組織表達細胞角蛋白(廣譜、高分子)及P63,不表達甲狀腺轉錄因子-1(×100)
2 分析討論
胰腺癌的遺傳演變從組織學正常上皮到低級別胰腺上皮內瘤變(panIN1、panIN2)、高級別胰腺上皮內瘤變(panIN3)和浸潤性癌,伴隨特異性遺傳改變的積累,其中90%以上為胰腺導管腺癌[1]。因為胰腺缺乏鱗狀細胞,所以胰腺原發性鱗狀細胞癌是一種罕見的腫瘤,約占胰腺外分泌腺體腫瘤的0.5%~5%,與胰腺癌最常見的類型——腺癌相比,具有相似的流行病學特點及低的生存率[2-3]。國外文獻曾闡述一些關于胰腺原發性鱗狀細胞癌的組織起源,如慢性炎癥導致的鱗狀化生的惡性轉化、雙潛能原始細胞的分化或先前存在的腺癌的鱗狀轉化[4-5]。
據報道,胰腺鱗癌的病灶在胰頭、胰體、胰尾的發生幾率是均等的[6-7],較腺癌更富血供,且腫瘤內部常有壞死,確診需手術或EUS下細針穿刺活檢[8]。對于可切除的患者,治愈性切除術是最有效的治療方法,平均生存期約7個月,5年存活率不到1%[1,9];80%以上的患者在診斷時已不可切除,對于不能切除的患者,姑息治療不能降低死亡率[1,3]。PET/CT可以及時、準確地評估治療反應,從而確保更好的生存和生活狀態[3]。有文獻報道,胰腺癌肝轉移在所有的胰腺外轉移中占大多數比例,轉移途徑可能是癌細胞通過靜脈流入門靜脈系統[10];同時胰腺癌細胞顯示出明顯的肝臟轉移的傾向,臨床研究表明胰腺癌細胞與肝臟相互作用影響著胰腺癌肝轉移的過程,該過程分為三個相互關聯的階段:(1)彌漫性胰腺癌細胞的趨化性和血小板或中性粒細胞的同時防御性的形成,有助于癌細胞向肝臟轉移;(2)肝小葉細胞外基質和間質細胞的重塑以及血管生成因子誘導的血管生成,使無血管的亞臨床微轉移轉變成有血管的臨床轉移灶,并可在肝臟定植、存活和生長;(3)肝臟免疫系統的雙峰作用(即腫瘤誘導前的免疫抑制及癌細胞在免疫系統中廣泛存在而引起的免疫抑制)促進轉移性腫瘤的生長,使胰腺癌癌細胞肝轉移順利地從微小肝轉移向大轉移灶進展[11]。
該患者手術探查發現在第二肝門處有直徑約2 cm的腫物,且AFP正常,考慮為胰腺鱗癌沿門靜脈轉移到肝臟,行胰體尾切除術+脾切除+肝左外葉切除術。對于本例患者,截止2019年4月29日,已完成6個療程的化療,化療方案為GEMOX(吉西他濱聯合奧沙利鉑),患者一般狀況好,復查CT未見明顯腫大淋巴結及其他轉移灶,繼續予以隨訪研究。
綜上所述,胰腺腫瘤雖以腺癌最常見,但也不能忽略原發性鱗癌的可能,且胰腺原發性鱗狀細胞癌多為排他性診斷以及病理診斷,這就要求臨床醫生有全面、縝密的臨床思維。