維持性血液透析患者血清Klotho蛋白水平與血管鈣化的關系
周春婭,邢繼成,張曉娟,邢昌贏
(1南京醫科大學第一附屬醫院,南京210029;2中國人民解放軍第八一醫院)
血管鈣化是維持性血液透析(MHD)患者常見并發癥[1],可導致MHD患者心血管事件增加,是終末期腎臟病患者死亡的獨立危險因素。血管鈣化的發生機制復雜,可能與骨軟骨分化、血管平滑肌細胞的凋亡、鈣磷不平衡釋放以及血管彈性蛋白退化有關[2]。血磷水平的增高與血管鈣化密切相關,但是通過減少飲食中磷攝入量或者通過服藥磷結合劑降低血磷濃度效果不佳[3]。成纖維細胞生長因子-23(FGF-23)是成纖維細胞由骨細胞、骨成纖維細胞分泌的細胞因子,可通過增強近端腎小管鈉磷共轉運蛋白胞吞作用增強磷酸外分泌,從而促進尿磷排泄。Klotho蛋白是一種主要存在于腎臟的抗衰老蛋白[4],與腎臟損傷及預后相關[5]。研究發現,膜型Klotho蛋白與FGF-23在腎臟近端小管上皮細胞與成纖維細胞生長因子受體結合形成 FGF-23-Klotho蛋白復合物,調節鈣磷重吸收。可溶型Klotho蛋白可通過血液循環作用于全身,與血清鈣磷水平及血管鈣化相關[6]。目前,關于血管鈣化的發生機理尚不清楚,其治療亦無良好方法。為此,本文對血清可溶型Klotho蛋白與MHD患者血管鈣化的關系進行了探討。
1 資料與方法
1.1 臨床資料 選取2015年3月~2017年3月在中國人民解放軍第八一醫院腎臟內科接受MHD治療﹥6個月且病情穩定的患者143例,男78例、女65例,年齡(57.14±12.58)歲。納入標準:①透析時間﹥6個月;②透析頻率為每周2~3次,透析過程順利,2周內干體質量穩定;③患者知曉并簽署同意書。剔除標準:①近1年來有大量失血患者;②1年內有嚴重感染史、骨折、心衰史;③惡性腫瘤患者;④本研究3個月內使用皮質類固醇激素治療;⑤有原發性甲狀旁腺、骨代謝等可能影響鈣、磷的代謝疾病;⑥嚴重肝膽實質性病變。本研究經我院倫理委員會審核通過。
1.2 透析方案 采用德國森尤斯F80透析器,標準碳酸氫鹽血液透析,Ca2+濃度1.25 mmol/L,血流量200~350 mL/min,透析液流量500 mL/min,4 h/次,每周2~3次,每次透析超濾均可達到臨床估算目標干體質量標準。
1.3 血管鈣化評分 采用簡易血管鈣化評分方法。患者進行骨盆平片、雙手正位及腰椎側位X線檢查,骨盆平片以水平線位于股骨頭切面、垂直線位于脊柱位置分為4部分,雙手正位片雙手分別以掌骨上方做水平分隔分為4部分,腰椎側位片以L2、L3椎間隙分界將腹主動脈分為上下2部分,共計10部分。由2位放射科醫師盲法、單獨進行評分,每個部分根據有無血管鈣化分別計為1、0分,最終取其平均值。總分0分為無鈣化,1~3分為輕度鈣化,4~6分為中度鈣化,7~10分為重度鈣化。
1.4 血液生化指標檢測 采集患者清晨空腹血樣10 mL,低速離心機離心15 min,3 000 r/min,放置-80 ℃環境下待測。采用全自動生化分析儀檢測患者血紅蛋白、血清白蛋白、血鈣、血磷、全段甲狀旁腺激素(iPTH);酶聯免疫吸附(ELISA)試劑盒檢測患者血清FGF-23(美國密蘇里州EMD Millipore公司)、可溶性Klotho蛋白(日本IBL公司)。

2 結果
2.1 MHD患者血管鈣化情況 143例患者,血管鈣化評分顯示無鈣化35例(24.5%);發生血管鈣化108例(75.5%),其中輕度鈣化為41例、中度鈣化為36例、重度鈣化為31例。
2.2 不同程度血管鈣化患者臨床參數比較 不同程度血管鈣化患者年齡、透析齡、血清白蛋白、血紅蛋白水平差異無統計學意義(P均>0.05)。不同程度鈣化患者血清Klotho蛋白、FGF-23、鈣、磷、iPTH水平比較差異有統計學意義(P均<0.05)。見表1。
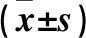
表1 不同程度血管鈣化患者血清Klotho蛋白、FGF-23等臨床參數比較
2.3 MHD患者血管鈣化影響因素 Spearman相關分析結果顯示,MHD患者血管鈣化程度與血清鈣、磷、iPTH 、FGF-23水平呈正相關(r分別為0.352、0.456、0.384、0.332,P均<0.05),與血清Klotho蛋白水平呈負相關(r=-0.462,P<0.05)。Logistic回歸分析顯示,血清Kloth蛋白水平下降是血管鈣化的獨立危險因素(P<0.05)。見表2。

表2 MHD患者血管鈣化危險因素Logistic回歸分析
3 討論
血管鈣化是鈣磷在血管、瓣膜、心臟等組織異常沉積的病理過程,在糖尿病以及腎臟病患者中普遍存在,也是MHD患者發生心血管事件和死亡的危險因素。根據鈣鹽沉積的部位不同,血管鈣化多發生在血管內膜及中膜,部分也可發生在心臟瓣膜[7]。本研究MHD患者143例,發生血管鈣化108例,發生率高達75.5%,說明血管鈣化在MHD患者中普遍存在。因此,探討血管鈣化的發生機制和治療方法對于減少MHD患者心血管事件的發生及降低病死率十分必要。
過去一直認為,血管鈣化是脈管系統由于人體衰老所產生的一種被動鈣鹽沉積的過程。但是目前研究已經明確,此過程有機體細胞的主動參與[3]。血管鈣化的發生機制十分復雜,包括骨軟骨分化、血管平滑肌細胞凋亡、鈣磷不平衡釋放以及血管彈性蛋白退化等[2],其中血磷、鈣水平的升高最為關鍵[8,9]。本研究發現,血管鈣化程度越重,血鈣、磷水平也越高,血鈣、磷水平與血管鈣化程度呈正相關。血鈣水平升高可從多個方面激活血管鈣化的進程[10,11],防治血管鈣化控制血鈣水平與于血磷水平同樣重要。
最近研究發現,Klotho與FGF-23是調節血磷水平的兩個重要的因子。FGF-23由骨細胞和骨成纖維細胞分泌,可通過作用腎臟近端腎小管、甲狀旁腺以及改變維生素D水平來調節血磷水平。FGF-23與受體結合時需要Klotho的協同才能發揮作用[12]。由于膜型Klotho器官特異性,因此FGF-23主要作用機制僅局限于腎臟等特定器官。慢性腎功能不全(CKD)患者血清FGF-23水平升高,且此變化與CKD患者骨礦物質代謝紊亂相關已取得共識;但是,FGF-23與維持性血液透析患者血管鈣化的關系尚存在爭議[2]。有研究表明,無論是否有高磷存在,額外增加FGF-23并沒有促進人類血管平滑肌細胞鈣化。動物實驗也證實,無論Klotho如何變化,FGF-23的增加也并沒有觀察到小鼠主動脈瓣環鈣化的發生。甚至有文獻報道FGF-23對體外培養的血管平滑肌細胞鈣化具有保護作用[13]。本文研究顯示,不同程度血管鈣化患者血清FGF-23水平存在差異,但是Logistic回歸分析結果表明FGF-23不是血管鈣化的獨立因素。此結果有可能與研究樣本量過小有關,同時也表明FGF-23對MHD患者血管鈣化的作用仍待進一步研究。
Klotho蛋白可由腎臟、甲狀旁腺、腦脈絡叢等器官產生,但是主要分布在腎臟[14,15]。研究發現,敲除腎臟產生Klotho蛋白的基因可使得外周血中Klotho蛋白水平下降約80%;且敲除腎臟產生Klotho基因的動物表現出與系統性Klotho基因敲除一樣的典型衰老現象,證明腎臟Klotho蛋白是決定外周Klotho蛋白水平及其功能的主要因素[4]。Klotho蛋白可分為兩種類型,即膜型Klotho和可溶型Klotho。膜型Klotho蛋白與FGF-23受體形成共受體,使得FGF-23發揮其功能[6]。可溶型Klotho蛋白是由膜型Klotho細胞外片段產生,通過血液循環作用于全身。本研究探討血清可溶型Klotho蛋白水平與血管鈣化的關系,表明血清Klotho蛋白水平下降是血管鈣化的獨立危險因素。大量的體內外研究都表明,Klotho蛋白對于血管鈣化具有保護作用。Klotho蛋白缺乏的小鼠表現出高水平的血磷,這與FGF-23基因敲除小鼠表現的一致,說明Klotho蛋白對于鈣磷水平有重要調節作用。進一步研究發現,外源性增加血清Klotho蛋白水平可降低CKD患者血磷水平,減輕患者血管鈣化程度[6]。
綜上所述,血管鈣化在維持性血液透析患者中患病率較高,血清Klotho蛋白及FGF-23與血管鈣化密切相關,血清Klotho蛋白水平下降是血管鈣化的獨立影響因素,有可能成為血管鈣化治療的新靶點。

