子宮內膜癌患者血清LncRNA ROR、miR-29a表達變化及臨床意義
李欣,孟靜,任瑞,管翠平,馮超林,陳曼曼
(1 山東大學第二醫院,濟南 250000;2 山東省胸科醫院)
關鍵字:子宮內膜癌;長鏈非編碼RNA重編程調節物;微小RNA-29a;臨床分期
子宮內膜癌是最常見的婦科惡性腫瘤之一,美國癌癥協會報道美國2015年約有5.5萬例新發病例,死亡例數達1.1萬例,且發病率和病死率有逐漸增加的趨勢,嚴重危害女性患者的健康[1]。目前子宮內膜癌的治療包括手術治療、放化療及內分泌治療等方式,但對晚期患者,術后仍有復發轉移的風險,患者5年生存率低于30%[2]。因此需深入研究子宮內膜癌的發病和疾病發展的機制,尋找新的關鍵的診斷治療靶點。長鏈非編碼RNA(LncRNA)是長度大于200個核苷酸的RNA分子,具有結合靶基因啟動子區調控基因轉錄、介導染色質重構及結合mRNA抑制翻譯過程等生物學功能[3]。近年來研究發現,LncRNA在炎癥、腫瘤、心血管疾病及自身免疫等多種疾病中均發揮重要的調控作用,有望成為疾病診斷治療的生物學標志物[4]。研究表明,腫瘤細胞中LncRNA重編程調節物(ROR)表達升高,能促進MYC等癌基因的表達,促進腫瘤細胞的增殖并抑制凋亡[5]。miRNA長度為18~25個核苷酸,成熟的具有頸環結構miRNA參與構成RNA誘導的沉默復合物(RISC),調控靶基因mRNA翻譯。miR-29家族包括miR-29a、miR-29b、miR-29c三個成員,miR-29a在卵巢癌、腎癌及膀胱癌等多種腫瘤中表達下降,導致對Bcl-2等抑癌基因表達抑制減弱,促進腫瘤的增殖、遷移及浸潤等[6]。miR-29a受轉錄后水平精細調控,如LncRNA-MIAT能與miR-29a相互作用,影響下游癌基因如組蛋白去乙酰化酶4(HDAC4)的表達,影響腫瘤細胞的生物學行為[7]。國內有學者亦報道LncRNA ROR表達與miR-29a表達之間存在一定相關性[8]。本研究通過檢測85例子宮內膜癌患者血清中LncRNA ROR與miR-29a的表達水平,初步探討兩者的臨床意義。
1 資料與方法
1.1 臨床資料 選擇2017年3月~2019年3月在山東大學第二醫院診治的85例子宮內膜癌患者(癌癥組)。納入標準:①子宮內膜癌患者均經病理學檢查明確確診為子宮內膜癌;②患者的臨床病理資料及隨訪資料完整;③患者均為初次診治,既往未接受過放化療等抗腫瘤治療。排除標準:①伴有嚴重的心肝腎等臟器功能不全;②合并其他器官系統的惡性腫瘤;③患者處于孕期或者哺乳期。癌癥組患者年齡29~72(49.1±10.1)歲;病理類型:子宮內膜樣腺癌62例,黏液/漿液性腺癌23例;腫瘤直徑:≤5 cm者49例,>5 cm者36例;分化程度:高分化25例,中分化27例,低分化33例;參考2009年國際婦產科聯盟FIGO標準進行分期[9],Ⅰ~Ⅱ期57例,Ⅲ~Ⅳ期28例;肌層浸潤深度:淺肌層60例,深肌層25例;伴淋巴結轉移20例,不伴淋巴結轉移65例。以同期診治的40例子宮肌瘤患者作為對照組,年齡28~69(49.3±9.3)歲。納入標準:①經病理檢查明確診斷為子宮肌瘤;②既往未接受過其他治療。癌癥組與對照組年齡比較差異無統計學意義。
1.2 血清中LncRNA ROR與miR-29a相對表達量檢測 采用qRT-PCR法檢測所有研究對象術前血清中的LncRNA ROR、miR-29a。抽取研究對象清晨空腹靜脈血標本5 mL,置于枸櫞酸鈉抗凝管中,4 ℃下3 000 r/min離心10 min,取上清血清-80 ℃保存待測。提取血漿中總RNA:取約300 μL樣品,按TRIzol和樣品體積比例3∶1加入TRIzol,混勻后靜置5 min,加入200 μL氯仿沉淀蛋白,混勻后靜置10 min,4 ℃下12 000 r/min離心10 min,取上層水相加入異丙醇500 μL沉淀RNA,4 ℃下12 000 r/min離心10 min,去上清保留底部白色沉淀RNA,75%乙醇洗滌RNA,4 ℃下7 500 r/min離心5 min,吸棄上清,室溫下干燥RNA,50 μL的DEPC水溶解,并鑒定RNA的濃度及純度。以1 μg RNA為模板反轉錄為cDNA,實驗步驟嚴格按照TaKaRa反轉錄試劑盒進行。反轉錄條件:37 ℃ 15 min,85 ℃ 5 s,得到的cDNA 4 ℃保存。qRT-PCR反應體系為cDNA 0.2 μL,2×SYBR 5 μL,ROXⅡ 0.2 μL,上游和下游引物各0.5 μL,RNA-free水3.6 μL。反應條件為:95 ℃預變性5 min,95 ℃變性30 s,62 ℃退火30 s,70 ℃延伸30 s,變性退火延伸共40個循環。LncRNA ROR正向引物序列:5′-CCAGGACAATGAAACCAC-3′,反向引物序列:5′-AGGAGCCCAAAGTAACAG-3′;內參基因GAPDH正向引物序列:5′-GGTGAAGGTCGGAGTCAACG-3′,反向引物序列:5′-CAAAGTTGTCATGGATGHACC-3′。miR-29a正向引物序列:5′-CTGAGTTTCTATTTAGACACTACAACA-3′,反向引物序列:5′-ACAATTTGACATGTGGCATTAACG-3′;內參基因U6正向引物序列:5′-CTCGCTTCGGCAGCACA-3′,反向引物序列:5′-AACGCTTCACGAATTTGCGT-3′。采用2-ΔΔCt法計算目的基因相對表達量。

2 結果
2.1 兩組血清LncRNA ROR、miR-29a表達比較 癌癥組血清中LncRNA ROR、miR-29a的相對表達量分別為1.86±0.23、0.60±0.14,對照組分別為1.09±0.17、1.27±0.22,癌癥組血清中LncRNA ROR的相對表達量高于對照組(t=18.870,P=0.000),癌癥組血清中miR-29a的相對表達量低于對照組(t=20.615,P=0.000)。癌癥組血清中LncRNA ROR、miR-29a的表達呈明顯負相關(r=-0.634,P=0.001)。
2.2 癌癥組患者血清中LncRNA ROR、miR-29a表達與臨床病理參數的關系 癌癥組患者血清中LncRNA ROR、miR-29a表達與腫瘤臨床分期有關(P均<0.05),而與年齡、病理類型、腫瘤大小、分化程度、肌層浸潤深度、是否伴淋巴結轉移無關(P均>0.05)。見表1。
2.3 血清LncRNA ROR、miR-29a單獨及聯合檢測對子宮內膜癌的診斷價值 血清LncRNA ROR診斷子宮內膜癌的ROC曲線下面積為0.762(95%CI:0.676~0.859),截斷值為1.4時,診斷子宮內膜癌的敏感度為0.753,特異度為0.701,約登指數為0.454;血清miR-29a診斷子宮內膜癌的ROC曲線下面積為0.805(95%CI:0.794~0.917),截斷值為1.0時,診斷子宮內膜癌的敏感度為0.780,特異度為0.748,約登指數為0.528。采用臨床實用的綜合聯合診斷模式:仍使用兩指標各自的診斷閾值,兩指標同為陽性或陰性時做陽性或陰性診斷,否則進行復測。若復測結果不變,則結合專業實踐及醫師觀點進行診斷并側重考慮miR-29a指標(其敏感度和特異度均較高)。兩者聯合診斷的敏感度為0.824,特異度為0.800,約登指數為0.624。
3 討論
子宮內膜癌是起源于子宮內膜上皮組織的惡性腫瘤。隨著我國社會經濟的發展、人民生活水平的提高,子宮內膜癌發病率亦有逐漸增加的趨勢。子宮內膜癌的病因尚不清楚,肥胖、糖尿病及高血壓是子宮內膜癌重要的危險因素。子宮內膜癌發病機制是學者研究的熱點,子宮內膜癌的發生發展是遺傳因素和環境因素共同作用的結果,而癌基因的激活、抑癌基因的失活、染色體雜合性缺失、染色質構象的改變等機制均參與子宮內膜癌的發生發展的過程[10]。近年來新的放化療等輔助治療的發展改善了子宮內膜癌的治療效果,但部分患者術后仍有復發轉移的風險。因此,有必要深入研究子宮內膜癌發生發展的關鍵分子生物標志,尋找具有臨床意義診斷治療靶點。
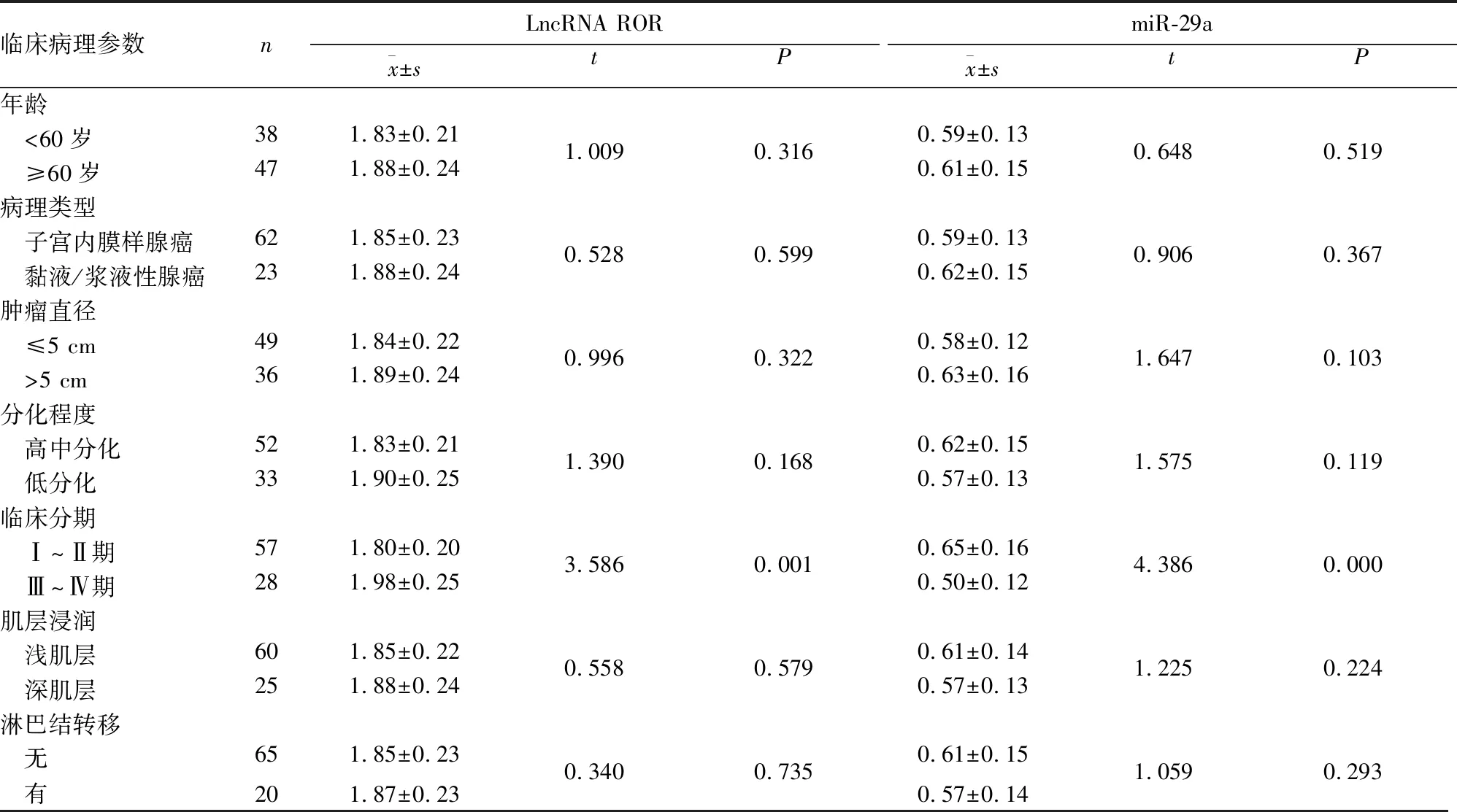
表1 癌癥組患者血清中LncRNA ROR、miR-29a表達與臨床病理參數的關系
隨著高分辨率微陣列和大規模平行測序技術的發展,lncRNA在人類腫瘤發生和發展過程中發揮重要作用。LncRNA ROR最早在誘導性多能干細胞(iPSCs)中被發現,在多種生物過程中起調節分子的作用。LncRNA ROR在許多類型的癌癥(包括乳腺癌、胰腺癌、肝細胞癌、子宮內膜癌和鼻咽癌等[11])中表達失調。然而,LncRNA ROR在腫瘤中的潛在機制及其臨床意義仍有待闡明。本研究中,癌癥組患者血清中LncRNA ROR的相對表達量高于對照組,目前具體機制尚不清楚。LncRNA ROR基因位于18q21.31,其基因啟動子序列含LINE、SINE和LTR元件,腫瘤發生時細胞內多能轉錄因子如Oct4、Sox2和Nanog結合LncRNA ROR基因啟動子區域,促進LncRNA ROR表達[12]。此外,子宮內膜癌血清中LncRNA ROR的表達與腫瘤分期有關,Ⅲ~Ⅳ期血清中LncRNA ROR的表達明顯較高。結果表明子宮內膜癌血清中LncRNA ROR表達參與子宮內膜癌的發生發展。其機制一方面是LncRNA ROR能夠直接抑制P53蛋白功能,阻斷P53的DNA損傷修復作用,過度激活下游癌基因,導致腫瘤細胞無限增殖,腫瘤分期增高[13]。另一方面,LncRNA ROR可作為內源競爭性RNA(ceRNA)抑制miR-205活性,導致miR-205對上皮間質轉化基因如ZEB1、ZEB2表達抑制作用減弱,促進腫瘤的惡性增殖[14]。
miRNA是一種短的非編碼RNA調控分子,miRNA基因經RNA聚合酶Ⅱ轉錄后形成前體miRNA,在Dicer核糖核酸酶剪切下形成成熟miRNA,參與構成RISC后,以堿基互補配對的方式結合靶基因mRNA的3′UTR,改變靶基因mRNA的穩定性調控基因表達。研究表明,miR-29a作為一種潛在的腫瘤抑制性miRNA,在喉癌等多種腫瘤中起調節作用,miR-29a可通過靶向抑制PROM1基因的表達抑制腫瘤細胞的增殖[15]。本研究中,癌癥組患者血清中miR-29a的表達低于對照組,表明子宮內膜癌患者血清中miR-29a表達下降。其原因與c-myc、核因子-κB對miR-29a基因表達調控作用有關。研究表明,腫瘤發生時細胞內c-myc、核因子-κB表達升高,Hedgehog信號通路激活,通過結合miR-29a基因啟動子區,抑制miR-29a基因的表達[16]。本研究中,Ⅲ~Ⅳ期子宮內膜癌患者血清中miR-29a表達明顯較低,表明miR-29a表達與腫瘤分期有關。其原因可能是miR-29a能夠直接結合并抑制微管成核因子2(TPX2)的表達,而TPX2表達具有抑制腫瘤細胞惡性增殖的能力,miR-29a表達降低后對TPX2抑制作用減弱,結果腫瘤細胞的增殖明顯增強[17]。本研究中子宮內膜癌患者血清中LncRNA ROR與miR-29a表達呈顯著負相關,其原因可能是LncRNA ROR表達升高后,可作為內源競爭性RNA結合并抑制miR-29a的腫瘤抑制功能,發揮促進腫瘤進展的作用[18],但其二者具體作用機制有待進一步深入研究。
臨床上腫瘤多為散發性,尋找無創或微創并且具有較高敏感性和器官特異性的血清診斷標志物,有助于子宮內膜癌的早期診斷,從而早期治療,對提高患者的生存預后具有重要意義。本研究進一步分析血清LncRNA ROR、miR-29a及兩者聯合檢測在子宮內膜癌中的診斷價值,結果血清LncRNA ROR、miR-29a聯合檢測的敏感度、特異度均高于單一指標,表明聯合檢測的診斷效能較高,兩者聯合檢測診斷的敏感性高于任一單一指標,表明聯合檢測血清LncRNA ROR、miR-29a對于子宮內膜癌患者具有較高的診斷價值,可能有助于提高子宮內膜癌診斷的準確性。但由于損傷、感染及免疫等因素均可能影響血清非編碼RNA的水平[19],并且本研究樣本含量較小,聯合檢測血清LncRNA ROR、miR-29a對子宮內膜癌的診斷價值,尚需大樣本、多中心的隨機對照試驗深入研究。
綜上所述,子宮內膜癌患者血清中LncRNA ROR表達上調,而miR-29a表達下調,兩者表達與腫瘤分期有關,聯合檢測血清LncRNA ROR、miR-29a對子宮內膜癌具有較高的診斷價值,有望成為新的診斷子宮內膜癌的腫瘤標志物。

