環介導恒溫擴增法快速檢測曲霉菌的研究
章白苓 ,徐軼 ,杭亞平 ,張楠 ,鄒珊
(1.南昌大學第二附屬醫院檢驗科,江西 南昌 330006;2.江西省人民醫院,江西 南昌 330006)
曲霉菌屬 (Aspergillus)是侵襲性曲霉菌病等的嚴重條件致病菌,部分患者病死率高達90%[1,2],目前,臨床曲霉菌感染均依據臨床癥狀,培養分離等方法。近年來PCR技術被應用于曲霉菌的鑒定,但需要核酸擴增儀等昂貴儀器和專業操作人員,檢測時間還是比較長,并且反應過程容易受污染的影響。本研究采用環介導恒溫擴增 (Loop-mediated Isothermal Amplification LAMP)技術,設計 2對引物來識別目標基因的6個不同區域,建立一種快速,簡便,經濟檢測曲霉菌的方法,通過肉眼直接觀察顏色變化來判斷結果,并初步應用于臨床。現報告如下。
1 材料與方法
1.1 材料
1.1.1 臨床標本和標準菌株來源 臨床標本(痰液)來自南昌大學第二附屬醫院臨床微生物室,煙曲霉ATCC96918、黃曲霉 ATCC11492,來自上海復祥生物科技有限公司,白念珠菌ATCC 90029、熱帶念珠菌 ATCC66029、大腸埃希菌 ATCC 25922、金黃色葡萄球菌ATCC25923、銅綠假單胞菌ATCC27853、肺炎鏈球菌ATCC49619為本室保存。
1.1.2 儀器和試劑 Vitek-2全自動微生物分析儀(法國生物梅里埃)、PCR擴增儀(美國ABI公司),Bst聚合酶(美國NEB公司),DNA marker(上海生工技術有限公司),試劑盒和熒光染料購自日本榮妍化學株式會社。DNA提取試劑盒購自廣州達安基因公司。曲霉菌提取液:100mmol/L KCL,20mmol/lTris-HCL(PH8.3),5mmol/L Mgcl2,0.2g/L 明 膠 ,0.9%吐溫20。煙曲霉、黃曲霉等臨床常見曲霉菌感染菌,選取保守區域設計LAMP引物,外引物為F3和B3,內引物為FIP和BIP。序列分別為F3(5'-GAGGATGCTTCGGGTGC-3'),B3 (5'-CTCTACTTG TGCGCTATCGG-3'),FIP(5'-ACCCCATCCCAGAC GGGATTCTGTCTAAGTGCCCTGGAAC-3'),BIP(B1 C-B2)(5'-TTCGACGAGTCGAGTTGTTTGGGTCTCCGGCCAGTATTTAGCT-3')由上海生工生物工程有限公司合成。
1.2 方法
1.2.1 純菌DNA提取 曲霉菌DNA提取參照文獻[3-5],將沙保平板純菌落用無菌水洗滌,15000r/min離心5min,取200mg左右濕潤菌落加100μl曲霉菌提取緩沖液,50μl溶細胞酶,37℃1h,再加入100μg蛋白質酶K,55℃ 1h,然后95℃滅活10min,最后15000r/min,4℃離心10min。上清液即為核酸擴增模板。
1.2.2 臨床標本處理 痰液標本加入1~3倍痰液體積的胰蛋白酶(0.25%),置37℃水浴1h,2000r/min離心 3min,取上清夜 1ml,15000r/min 離心 5min,棄上清,在沉淀中加入100μl曲霉菌提取緩沖液,制成懸液,再按上述純菌DNA提取方法操作。
1.2.3 LAMP檢測 LAMP反應條件按照試劑盒說明書操作。LAMP反應體系:1.6μmol/l的引物FIP和 BIP,0.2μmol/l引物 F3 和 B3,1X LAMP 反應緩沖液 12.5μl,8U BstDNA 酶 1μl,熒光染料 1μl,2.5μl DNA 模板,純水至 25μl。 64℃恒溫 1.5h,最后80℃5min滅活,BstDNA酶終止反應。模板先進行95℃ 4min,然后冰上冷卻處理,再加入2.5μl于上述反應體中,最后以肉眼觀察顏色變化。
1.2.4 PCR檢測 PCR反應體積為25ul,分別以兩條 引 物 F3 (5'-GAGGATGCTTCGGGTGC-3'),B3(5'CTCTACTTGTGGGCTATCGG-3')。 其中引物各0.4umol/l,PCR 緩沖液 12.5μl,DNA 模板 2.5μl,超純水至 25μl。 94℃預變性 5min,94℃ 30s, 退火55℃30s,72℃延伸 30s,共 30 個循環,最后 72℃延伸10min產物在含熒光染料的1.5%瓊脂糖電泳,用凝膠成像系統觀察結果。
1.2.5 敏感性試驗 煙曲霉菌株按上述方法提取DNA 模板,純化,制備系列分別含 100、50、5、0.5、0.05pg模板進行LAMP和PCR檢測。
1.2.6 特異性實驗 將煙曲霉菌、黃曲霉菌及各對照菌提取DNA分別進行LAMP擴增,觀察特異性。
2 結果
2.1 特異性試驗 LAMP法對煙曲霉、黃曲霉菌擴增后,呈現典型的梯型條帶,肉眼觀察,陽性擴增小管中呈現綠色混濁,而其他非曲霉菌,均未擴增出產物,肉眼觀察小管呈陰性為橙紅色,見圖1、圖2和表1。
2.2 敏感性試驗 LAMP法檢測煙曲霉菌最低濃度在0.05pg,PCR法檢測則最低濃度為0.5pg,LAMP法比PCR法敏感性高10倍。在最低檢測濃度時也能進行肉眼直接觀察,見圖3和表2。
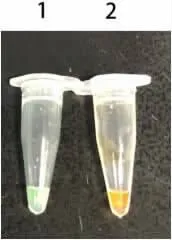
圖1 LAMP反應檢出結果
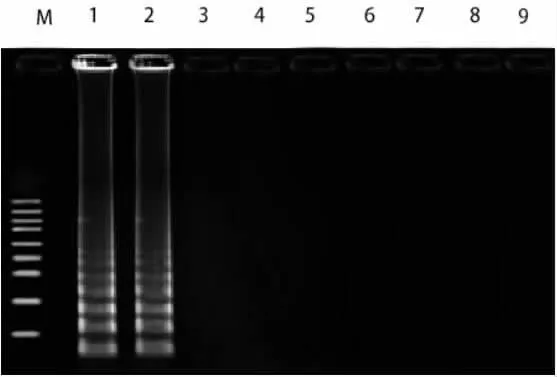
圖2 LAMP特異性檢測結果
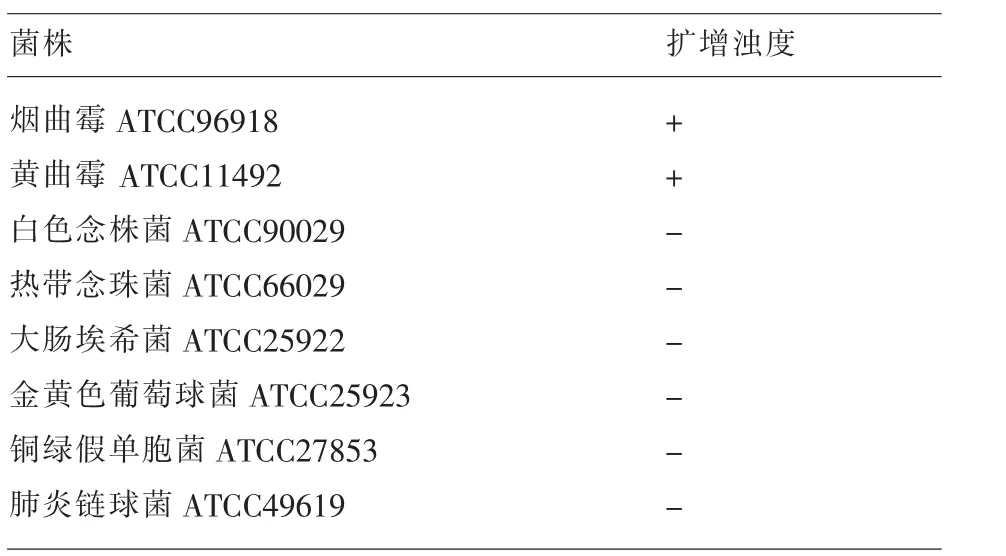
表1 LAMP擴增特異性試驗檢測結果
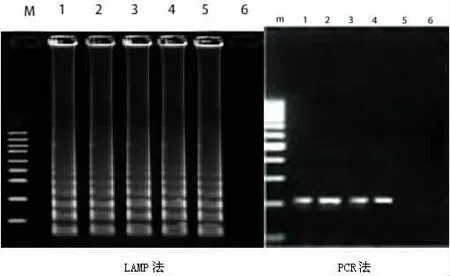
圖3 煙曲霉菌LAMP法與PCR法敏感性檢測結果比較

表2 LAMP法和PCR法敏感性的比較
2.3 臨床標本檢測 經涂片鏡檢、分離培養和PCR檢測確診的10例臨床痰液標本,經處理和提取DNA,經LAMP擴增后,均為陽性。
3 討論
LAMP技術是Notomi[6]等提出的一種新的核酸擴增技術,由于采取了2對引物來識別目標基因6個不同區段,而具有高度特異性,只需將反應混合液在恒溫65℃條件下保持1h左右。反應過程快捷,檢測結果直觀可見,檢測靈敏度比PCR方法高[7]。
侵襲性曲霉病是發生在免疫力低下人群中的一種機會性致病菌感染,IA)發生率逐年增加。此病進展快,早期診斷困難,病死率高,其死亡率在部分患者中可達70%~90%[8,9],其早基因診斷是抗菌治療的關鍵,該病的臨床癥狀不特異,影像學檢查缺乏特異性,實驗室診斷方法主要是分離培養,其培養陽性率低且耗時長。而分子生物學方法是曲霉菌感染診斷中最具有應用前景的一種方法[10]。
本研究采用LAMP技術應用于曲霉菌的診斷、簡便快速。通過梯度稀釋方法進行敏感性試驗,發現LAMP和PCR檢測最低濃度分別為0.05pg和0.5pg,相差10倍,與相關報道相似[5,11],比PCR法有更高的敏感性。除曲霉菌陽性外,其余對照菌株均為陰性,特異性好。在10例確診臨床痰液標本檢測中均為陽性。分子生物學方法,LAMP方法與傳統PCR法相比,有著操作簡單、經濟、快速、敏感性和特異性好等特點[12-15],值得在臨床推廣應用。

