缺氧環境對宮頸腺癌細胞增殖和遷移的影響及其作用機制
劉艷,李月潔,黃小環,龔莉,周鐵軍
(1 西南醫科大學附屬醫院,四川瀘州646000;2 重慶三峽醫藥高等專科學校)
在全球范圍內,宮頸癌的發病率和病死率均居女性惡性腫瘤的第四位,是嚴重威脅女性健康的常見惡性腫瘤之一[1]。宮頸癌的發病機制非常復雜,目前尚不完全清楚。缺氧是實體腫瘤微環境的基本特征之一,在腫瘤的生長、轉移和治療抵抗等方面發揮重要作用[2~4]。腫瘤的缺氧適應主要通過缺氧誘導因子(HIF)調節來實現。HIF主要有3種亞型,分別為HIF-1、HIF-2、HIF-3,其中參與調節細胞適應性缺氧的主要是HIF-1、HIF-2[5]。這3種HIF均是由一個α亞基和一個β亞基構成的異源二聚體蛋白復合物[6]。但迄今為止,關于HIF-2的研究較少。本課題組前期研究發現,在宮頸腺癌組織中HIF-2α表達明顯升高,表明HIF-2α可能在宮頸腺癌的發生、發展中具有一定作用。血管內皮鈣黏蛋白(VE-cadherin)是血管內皮細胞黏附連接的主要分子,是維持血管內皮細胞極性和完整性必不可少的內皮細胞特異性鈣黏蛋白。有研究發現,HIF-2α可通過與VE-cadherin相互作用,促進腫瘤血管生成,繼而促進胰腺癌進展[7]。但在缺氧環境中HIF-2α是否通過與VE-cadherin相互作用來促進宮頸腺癌進展尚不清楚。2014年9月~2015年4月,本研究通過氯化鈷(CoCl2)干預建立宮頸腺癌細胞缺氧模型,觀察了缺氧環境對宮頸腺癌細胞增殖和遷移的影響并初步探討其可能的作用機制。現報告如下。
1 材料與方法
1.1 材料 人宮頸腺癌細胞株HeLa(以下稱HeLa細胞),由西南醫科大學醫學基礎研究中心惠贈。TC-512型PCR擴增儀,英國Techne公司。所有引物序列由上海生工生物工程股份有限公司設計合成。總RNA提取試劑盒、2×Taq PCR Master Mix,北京天根生化科技有限公司。逆轉錄試劑盒,成都博瑞克生物技術有限公司。兔源性HIF-2α、VE-cadherin多克隆抗體,英國Abcam公司;內參β-actin抗體、辣根過氧化物酶(HRP)標記的羊抗兔IgG二抗,北京博奧森生物技術有限公司。
1.2 細胞缺氧模型構建的CoCl2最佳濃度篩選 取HeLa細胞接種于含10% FBS、100 U/mL青霉素和100 μg/mL鏈霉素的DMEM高糖培養基中,置于37 ℃、5% CO2、飽和濕度的細胞培養箱中培養。待細胞鋪滿瓶底75%左右時,胰蛋白酶消化后傳代。取傳3代、對數生長期、生長狀態良好的HeLa細胞,以3 000個/孔接種于96孔板,隨機將細胞分為觀察組和對照組,然后置于37 ℃、5% CO2、飽和濕度的細胞培養箱中培養。待細胞貼壁后,更換為含50、100、150、200、250 μmol/L CoCl2的細胞培養液繼續培養。另設對照孔,不予CoCl2干預。培養24、48、72 h,每孔加入MTT溶液10 μL,37 ℃孵育4 h,小心吸棄孔內培養上清液,然后每孔加入DMSO 100 μL,室溫振蕩10 min,使結晶物充分溶解。酶標儀于490 nm波長處檢測各孔的吸光度(OD)值,計算細胞增殖抑制率。細胞增殖抑制率=(1-觀察孔OD490值/對照孔OD490值)×100%。每個濃度設6個復孔,實驗重復3次,取平均值。選取細胞增殖抑制率最低的CoCl2濃度作為細胞缺氧模型構建的最佳濃度。
1.3 細胞遷移能力檢測 采用細胞劃痕實驗。取傳3代、對數生長期、生長狀態良好的HeLa細胞,以1×105個/孔接種于6孔板,隨機分為觀察組和對照組,然后置于37 ℃、5% CO2、飽和濕度的細胞培養箱中培養。待細胞貼壁后,觀察組加入含CoCl2、10% FBS的DMEM高糖培養基2 mL,對照組僅加入等量含10% FBS的DMEM高糖培養基,CoCl2濃度為細胞缺氧模型構建中篩選出的最佳濃度。然后置于37 ℃、5% CO2、飽和濕度的細胞培養箱中培養,當細胞融合70%~80%時,用10 μL槍頭垂直于孔底劃5條平行劃痕,PBS沖洗去除懸浮細胞,加入無血清的DMEM高糖培養基繼續培養。顯微鏡下觀察繼續培養0、48 h劃痕距離,計算細胞遷移率。細胞遷移率=(0 h劃痕距離-48 h劃痕距離)/0 h劃痕距離×100%。每組設2個復孔。實驗重復3次,取平均值。
1.4 HIF-2α、VE-cadherin表達檢測 將HeLa細胞按3×105個/mL接種于6孔板中,每孔2 mL,待細胞融合70%~80%時,將其培養基更換為含CoCl2、10% FBS的DMEM高糖培養基3~4 mL,CoCl2濃度為細胞缺氧模型構建中篩選出的最佳濃度,繼續培養0、24、48、72 h時,收集各孔細胞,檢測HIF-2α、VE-cadherin表達。①HIF-2α、VE-cadherin mRNA表達:采用RT-PCR法。采用TRIzol法提取細胞總RNA,經紫外分光光度計鑒定提取的總RNA濃度和純度合格。按PrimeScriptTMRT Reagent Kit with gDNA Eraser說明將總RNA逆轉錄為cDNA。以cDNA為模板,按2×Taq PCR Master Mix說明進行PCR擴增。引物序列:HIF-2α上游引物5′-AGCCTTGGAGGGTTTCATT-3′,下游引物5′-GGTGGCTGACTTGAGGTTGA-3′,擴增片段長度123 bp;VE-cadherin上游引物5′-TTTTCCAGCAGCCTTTCTAC-3′,下游引物5′-GTGTTATCGTGATTATCCGTGA-3′,擴增片段長度487 bp;β-actin上游引物5′-GCCAGTTGGACCTAACCTTAA-3′,下游引物5′-GGCCCACAGCACAGGTGAGTA-3′,擴增片段長度234 bp。PCR反應體系共20 μL:cDNA模板2 μL,上下游引物各1 μL,2×Taq PCR Master Mix 10 μL,0.1% DEPC水6 μL;反應條件:94 ℃預變性3 min,94 ℃變性30 s、57 ℃退火30 s、72 ℃延伸1 min共30個循環,最后72 ℃延伸5 min。以β-actin為內參,采用2-ΔΔCt法計算目的基因相對表達量。實驗重復3次,取平均值。②HIF-2α、VE-cadherin蛋白表達:采用Western blotting法。采用含PMSF的RIPA裂解液提取細胞總蛋白,經紫外分光光度計鑒定蛋白濃度合格。然后加入5×SDS上樣緩沖液,煮沸變性。取變性蛋白10 μg,SDS-PAGE分離蛋白(5%濃縮膠、10%分離膠),電泳結束,采用濕轉法將蛋白電泳產物轉印至PVDF膜上。加入含5%脫脂牛奶、3%BSA的封閉液,37 ℃封閉2 h,然后加入HIF-2α、VE-cadherin、β-actin特異性一抗,4 ℃孵育過夜,次日加入HRP標記的羊抗兔IgG二抗,室溫孵育45 min,ECL發光,暗室中曝光、顯影,采用Quality One軟件分析各蛋白電泳條帶灰度值。以β-actin為內參,以目的蛋白電泳條帶灰度值與內參蛋白電泳條帶灰度值的比值作為目的蛋白相對表達量。實驗重復3次,取平均值。
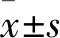
2 結果
2.1 細胞缺氧模型構建的CoCl2最佳濃度確定 各濃度CoCl2干預不同時間HeLa細胞增殖抑制率比較見表1。50、100 μmol/L CoCl2干預24 h時能夠促進HeLa細胞增殖,且以100 μmol/L時效果更強。因此,以100 μmol/L CoCl2進行后續實驗。

表1 各濃度CoCl2干預不同時間HeLa細胞增殖抑制率比較
注:與50 μmol/L CoCl2同時間比較,*P<0.05;與100 μmol/L CoCl2同時間比較,#P<0.05;與150 μmol/L CoCl2同時間比較,△P<0.05;與200 μmol/L CoCl2同時間比較,▲P<0.05;與同濃度CoCl2培養24 h比較,▽P<0.05;與同濃度CoCl2培養48 h比較,▼P<0.05。
2.2 兩組細胞遷移能力比較 觀察組與對照組細胞遷移率分別為(61.4±4.8)%、(37.9±3.6)%,兩組比較P<0.01。
2.3 缺氧環境下HeLa細胞HIF-2α表達與VE-cadherin表達的關系 CoCl2干預不同時間HeLa細胞HIF-2α、VE-cadherin mRNA和蛋白相對表達量比較見表2。Pearson直線相關分析顯示,缺氧環境下HeLa細胞HIF-2α mRNA相對表達量與VE-cadherin mRNA相對表達量呈正相關關系(r=0.987,P<0.05),HIF-2α蛋白相對表達量與VE-cadherin蛋白相對表達量亦呈正相關關系(r=0.869,P<0.05)。

表2 CoCl2干預不同時間HeLa細胞HIF-2α、VE-cadherin mRNA和蛋白相對表達量比較
注:與干預0 h比較,*P<0.05;與干預24 h比較,#P<0.05;與干預48 h比較,△P<0.05。
3 討論
宮頸癌是女性常見的惡性腫瘤之一。據世界衛生組織統計,2018年全球宮頸癌新發病例約57萬例,死亡約31.1萬例[1]。近年來,由于宮頸細胞學檢查的推廣和普及,很多宮頸癌得以早發現、早治療,其發病率和病死率已有明顯下降。但年輕婦女宮頸癌的發病率卻呈上升趨勢,尤其是宮頸腺癌。宮頸腺癌較宮頸鱗癌發病隱匿,對放化療的敏感性較低,故患者預后也相對較差。因此,宮頸腺癌的防治已經成為保護年輕女性健康全球共同關注的話題。
缺氧是實體腫瘤微環境的基本特征之一,在腫瘤的生長、轉移和治療抵抗等方面發揮重要作用[2~4]。有研究表明,在缺氧環境中,HIF可通過多種途徑促進腫瘤細胞增殖、侵襲和遷移[8,9]。HIF-2是HIF家族中重要的一員,也是調節細胞適應性缺氧的重要因子,由功能性α亞基及組成性β亞基構成。HIF-2α又稱內皮PAS結構域蛋白,缺氧環境可影響其穩定性,從而調節腫瘤細胞生長、增殖過程。有研究證實,在宮頸癌、乳腺癌、肺癌等腫瘤細胞中HIF-2α異常高表達[6,10~12],降低HIF-2α表達可逆轉腫瘤細胞耐藥并抑制其侵襲和遷移[13,14]。VE-cadherin是維系血管內皮細胞間黏附的主要蛋白,可提供細胞骨架的物理連接,能夠調節血管通透性[15]。有研究表明,VE-cadherin在高侵襲性黑色素瘤和乳腺癌中高表達,且其高表達與腫瘤高侵襲和遷移能力有關[16]。在急性淋巴細胞白血病中發現,VE-cadherin還能增強腫瘤細胞對化療藥物的耐受性[17,18]。而缺氧能夠影響肝癌、喉癌、膠質母細胞瘤等腫瘤細胞內多種基因的表達,從而促進腫瘤細胞的增殖、遷移和耐藥。該過程受多種因子的精確調控,如HIF、VE-cadherin、MMPs、PI3K等,但他們之間具體的調控機制仍不十分清楚。
Co2+可導致亞鐵螯合酶失活,阻礙氧和血紅蛋白結合,從而誘發缺氧[19],故本研究采用CoCl2處理宮頸腺癌細胞模擬缺氧環境。本研究觀察了50、100、150、200、250 μmol/L CoCl2分別干預24、48、72 h時HeLa細胞增殖抑制率,結果發現50、100 μmol/L CoCl2干預24 h能夠促進HeLa細胞增殖,且以100 μmol/L時效果更強,故后續選擇100 μmol/L CoCl2構建細胞缺氧模型。本研究還發現,150、200、250 μmol/L CoCl2干預24 h即可表現出對HeLa細胞增殖的抑制作用,且隨著干預時間延長,細胞增殖抑制作用越來越明顯。表明一定程度缺氧可促進HeLa細胞增殖,但腫瘤細胞對缺氧的耐受有限,當缺氧超過腫瘤細胞的耐受程度時,則會抑制腫瘤細胞增殖。
細胞遷移是活細胞普遍存在的一種運動形式。腫瘤細胞的遷移能力在血管生成和腫瘤的侵襲、轉移等方面具有重要作用。本研究觀察了缺氧環境對腫瘤細胞遷移能力的影響,結果發現100 μmol/L CoCl2干預的HeLa細胞遷移率明顯增加,表明缺氧環境可促進HeLa細胞遷移能力。
腫瘤新生血管形成途徑是一種不依賴于內皮細胞的全新腫瘤血管模式,即管壁沒有血管內皮細胞,腫瘤細胞排列在管壁外表面,管腔內可見紅細胞存在,又稱之為血管生成擬態。血管生成擬態是腫瘤生長過程的一種微循環系統,與內皮依賴性血管、馬賽克血管共同負責腫瘤生長。常氧狀態下,HIF-2α不能穩定存在,缺氧時HIF-2α穩定存在并能夠轉入細胞核[3],從而參與腫瘤血管生成與重建、上皮間質轉化、細胞周期和免疫調節因子的調節,繼而影響腫瘤細胞增殖、侵襲和遷移[20,21]。Tang等[22]研究認為,VE-cadherin是缺氧條件下血管生成擬態形成的關鍵因子。但在缺氧環境中HIF-2α是否通過與VE-cadherin相互作用來促進宮頸腺癌進展尚不清楚。本研究結果發現,缺氧環境下HeLa細胞HIF-2α、VE-cadherin表達增加,但后者表達隨著缺氧時間延長有所降低。表明在缺氧過程中,HIF-2α能夠持續發揮作用,而VE-cadherin在缺氧初期作用較大,晚期作用有所減弱。Pearson直線相關分析顯示,缺氧環境下HeLa細胞HIF-2α表達與VE-cadherin表達呈正相關關系,表明在HeLa細胞中二者可能存在一定調控關系。缺氧后期VE-cadherin表達降低,提示HIF-2α可能通過其他通路調節HeLa細胞增殖。
綜上所述,一定程度缺氧能夠促進宮頸腺癌細胞增殖和遷移能力,其機制可能與缺氧環境能夠增強HIF-2α、VE-cadherin表達有關。

