藍激光內鏡結合JNET分型對早期結直腸癌及癌前病變的診斷價值
刁文秀 沈磊
結直腸癌是全世界最常見的惡性腫瘤之一,其發病率位于惡性腫瘤第3位,死亡率位于惡性腫瘤第5位[1]。根據腺瘤-癌的序貫學說,大部分結直腸癌是由腺瘤演變而來[2]。因此,內鏡下準確判斷結直腸病灶病理性質具有重要的臨床意義。隨著電子染色內鏡放大技術的不斷發展,內鏡對病灶黏膜微血管與微腺管的精準觀察得以實現,可有效判斷病灶浸潤深度、預測病理性質,電子染色內鏡逐漸廣泛應用于臨床。本研究通過應用JNET分型[3]分析藍激光成像(blue laser imaging,BLI)結合放大內鏡下觀察到的結直腸病變,旨在探討BLI結合JNET分型在判斷結直腸病灶病理性質中的應用價值。
資料與方法
一、研究對象
本研究為前瞻性研究,2016年8月至2018年7月在武漢大學人民醫院消化內鏡中心行BLI放大內鏡(ME-BLI)檢查檢出的479名患者,本因腹痛(129例),腹瀉(120例),便秘(125例),血便(67例)以及其他癥狀(38例)等于本院行ME-BLI檢查。其中男性287例,女性192例,年齡40~76歲,平均年齡為(62.0±4.2)歲。將檢出的結直腸病灶共694處納為研究對象,納入標準:(1)自愿參加本項研究,且簽署知情同意書;(2)進一步行ME-BLI檢查;(3)病變均行病理檢查(內鏡下治療或外科手術治療)。排除標準:(1)有家族史的大腸腺瘤病患者;(2)有炎癥性腸病病史者;(3)進展期結直腸癌;(4)腸道準備不佳,影響內鏡觀察者;(5)直徑大于5 cm的結直腸腫瘤,因為在這種病變中很難實施準確的BLI觀察;(6)圖像質量差,影響判斷結果[4]。
本研究經武漢大學人民醫院倫理審查委員會批準,按照世界醫學會赫爾辛基宣言進行。研究中納入的患者均簽署知情同意書。
二、研究設備
Fujifilm PROCESSOR VP-4450HD 圖像處理器(日本,富士公司),Fujifilm EG-L590ZW系列激光內鏡(日本,富士公司),Olympus CV-260 圖像處理器(日本,奧林巴斯公司),OLYMPUS GIFQ260J腸鏡(日本,奧林巴斯公司),NM-4L-1注射針(日本,奧林巴斯公司),Olympus鉤型電刀(日本,奧林巴斯公司),IT刀(日本,奧林巴斯公司),FD-IU-1熱活檢鉗(日本,奧林巴斯公司),HX-600-135止血夾(日本,奧林巴斯公司),ERBE ICC-200高頻電切裝置(德國,愛爾博公司),APC 300氬離子凝固器(德國,愛爾博公司),透明帽(日本,奧林巴斯公司),MAJ-1990黑帽(日本,奧林巴斯公司),外科手術器械等。
三、研究方法
患者于檢查前均按常規行腸道清潔準備。所有病例的內鏡檢查均由具備BLI豐富應用經驗的2名內鏡醫師完成。每一處病灶至少采取了6張最具有代表性的圖片,包括1張BLI白光模式(WL)下,1張BLI不伴有放大模式下,2張BLI高亮度(BLI-bright)模式下,2張BLI放大內鏡高對比度(BLI-contrast)模式下。由完成操作的2名醫生按照JNET分型通過觀察病灶黏膜的微血管與微腺管,診斷結直腸病灶的性質及浸潤深度。所有入選的病灶均行內鏡下或外科手術完整切除,標本均由2名經驗豐富的病理科醫生根據世界衛生組織標準進行了病理診斷。
四、診斷標準
采用BLI高對比度模式結合放大內鏡對結直腸病變的診斷標準。JNET分型[3]:根據病灶黏膜的微血管及微腺管結構分為4型:
1 型:微血管不可見,表面微結構在內鏡下表現為黑點或者白點,與周圍正常黏膜微結構內鏡下表現一致,對應的病理診斷最可能是增生性息肉(hyperplastic polyp,HP)及無蒂鋸齒狀息肉(sessile serrated polyp,SSP)(見圖1);2A 型:病灶黏膜微血管可見,形狀及分布規則,可呈網格狀、螺旋狀等;表面微結構形狀規則,可呈管狀、分支狀、乳頭狀等;對應的病理診斷最可能是低級別上皮內瘤變(low-grade intramucosal neoplasia,LGIN)(見圖2);2B 型:病灶黏膜微血管結構形狀及分布不規則,表面微結構不規則或模糊不清,對應的病理診斷最可能是高級上皮內瘤變(high-grade intramucosal neoplasia/Superfcial,HGIN)或黏膜下淺層浸潤癌(submucosal invasive cancer,SM-s癌)(<1 000 mm)(見圖3);3型:病灶黏膜微血管呈泛血管區域或粗大血管中斷,表面微結構呈無定形區域,對應的病理診斷最可能是黏膜下深層浸潤癌(deep submucosal invasive cancer,SM-d 癌)(≥1 000 mm)(見圖4)。
五、統計學分析

圖1 BLI下考慮診斷為JNET1型結腸病灶。1A:BLI白光模式下可見無蒂扁平息肉樣隆起,表面充血;1B:LCI模式下病灶黏膜更紅,周圍正常黏膜更白,病灶界限清楚;1C:BLI-bright模式下病灶與周圍正常黏膜界限明顯;1D:BLI-contrast放大模式下病灶微血管不可見,表面微結構在內鏡下表現為白點,與周圍正常黏膜微結構內鏡下表現一致;1E:內鏡下ESD手術完整切除病灶;1F:病理結果(HE染色×100)提示SSP

圖2 BLI下考慮診斷為JNET2A型結腸病灶。2A:BLI白光模式下可見帶蒂息肉樣隆起,表面充血;2B:LCI模式下病灶黏膜更紅,周圍正常黏膜更白,病灶界限清楚;2C:BLI-bright模式下病灶呈棕色,與周圍正常黏膜界限明顯,可見管狀微結構;2D:BLI-contrast放大模式下病灶黏膜微血管可見,形狀及分布尚規則,呈螺旋狀;微腺管形狀規則,呈管狀;2E:內鏡下ESD術切除的完整病灶;2F:病理結果(HE染色×100)提示管狀-絨毛管狀腺瘤伴低級別上皮內瘤變
采用SPSS統計軟件處理數據,計數資料以樣本量或率(%)表示。計算JNET分型中每種類型診斷結直腸病灶的敏感度、特異度、陽性預測值、陰性預測值及準確率。進一步分析病灶形態學分類對ME-BLI內鏡下JNET分型診斷結直腸病灶準確性的影響。計數資料比較行Fisher精確檢驗以及卡方檢驗,P<0.05為差異有統計學意義。

圖3 BLI下考慮診斷為JNET2B型結腸病灶。3A:BLI白光模式下可見粗蒂,基底寬;3B:BLI-bright模式下病灶周圍正常黏膜界限明顯,可見微結構形狀及分布不規則;3C:BLI-bright放大模式下病灶黏膜微血管形狀及分布尚不規則;表面微結構不規則,部分模糊不清;3D:化學染色結合放大內鏡觀察微腺管的變化,微腺管不規則;3E:內鏡ESD術切下完整病灶;3F:病理結果(HE染色×100)提示:病變為鋸齒狀腺瘤伴局灶腺體高級別上皮內瘤變(M1)
結 果
一、BLI內鏡下分型對結直腸病灶的診斷結果
本研究中,共納入694處病灶,根據巴黎分類,包括息肉樣病灶500例,平坦型病灶194處,其中344例患者(71.8%)有1處病灶,79例(16.5%)有2處病灶,32例(6.7%)有3處病灶,24名患者(5.0%)有4處或更多處病灶。為了統計分析的目的,所有病變都是獨立的觀察結果。在所有病變中,290處位于直腸,170處位于乙狀結腸,56處位于降結腸,48處位于橫結腸,103處位于升結腸,27處位于回盲區。243處病灶的直徑≤0.5 cm,104處病灶的直徑為0.5~1 cm,347處病灶的直徑>1.0 cm。
二、組織病理學檢查結果
本研究中,共納入病灶694例。所有病灶BLI結合JNET分型內鏡下診斷與病理診斷的結果詳見表1。結合病理學診斷結果,在Type1型中,93.1%(27/29)病灶為HP/SSP,6.9%(2/29)病灶為LGIN;在Type2A型中,0.9%(4/446)病灶為HP/SSP,86.1%(384/446)病灶為LGIN,12.1%(54/446) 病 灶 為 HGIN,0.9%(4/446)病灶為SM-s;在Type2B型中,37.0%(70/189)病灶為LGIN,42.3%(80/189)病灶為HGIN,8.5%(16/189)病灶為SM-s,12.2%(23/189)病灶為SM-d;在Type3型中,6.7%(2/30)病灶為SM-s,93.3%(28/30)病灶被診斷為SM-d。
息肉樣病灶BLI結合JNET分型內鏡下診斷與病理診斷的結果詳見表2。結合病理學診斷結果,在Type1型中,91.0%(10/11)病灶被診斷為HP/SSP,9.0%(1/11)病灶被診斷為LGIN;在Type2A型中,0.9%(3/345)病灶被診斷為HP/SSP,85.8%(296/345)病灶被診斷為 LGIN,12.5%(43/345)病灶被診斷為HGIN,0.9%(3/345)病灶被診斷為SM-s;在Type2B型中,34.1%(43/126)病灶被診斷為LGIN,46.8%(59/126)病灶被診斷為HGIN,7.1%(9/126)病灶被診斷為SM-s,12.7%(16/126)病灶被診斷為SM-d;在Type3型中,5.6%(1/18)病灶被診斷為SM-s,94.4%(17/18)病灶被診斷為SM-d。
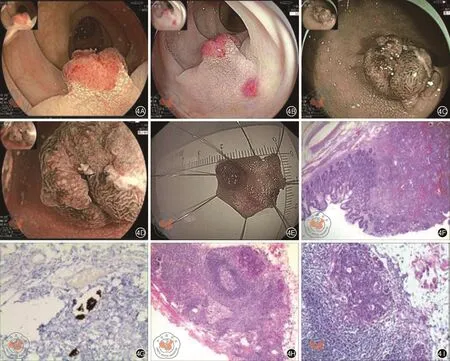
圖4 BLI下考慮診斷為JNET3型結腸病灶。4A:BLI白光模式下可見粗蒂,基底寬息肉樣隆起;4B:LCI模式下病灶黏膜更紅,周圍正常黏膜更白,病灶界限清楚;4C:BLI-bright模式下病灶周圍正常黏膜界限明顯,部分病灶微結構消失;4D:BLI-bright放大模式下部分病灶黏膜血管呈泛血管區;表面微結構模糊不清,呈無定型區域;4E:內鏡ESD術完整切下病灶;4F、4G:病理結果(HE染色及免疫組化×100)提示:病變為(乙狀結腸)中分化腺癌,腫瘤大小1 cm×0.8 cm×0.6 cm,浸潤至黏膜下層(sm2),可見脈管內有癌栓,腫瘤出芽分級為G3;4H、4I:外科手術病理結果(HE染色×100)提示:送檢(腸管)組織呈慢性炎伴肉芽組織形成,未見腫瘤,原腫塊已經切除,腸系膜淋巴結可見癌轉移,淋巴管內可見癌栓
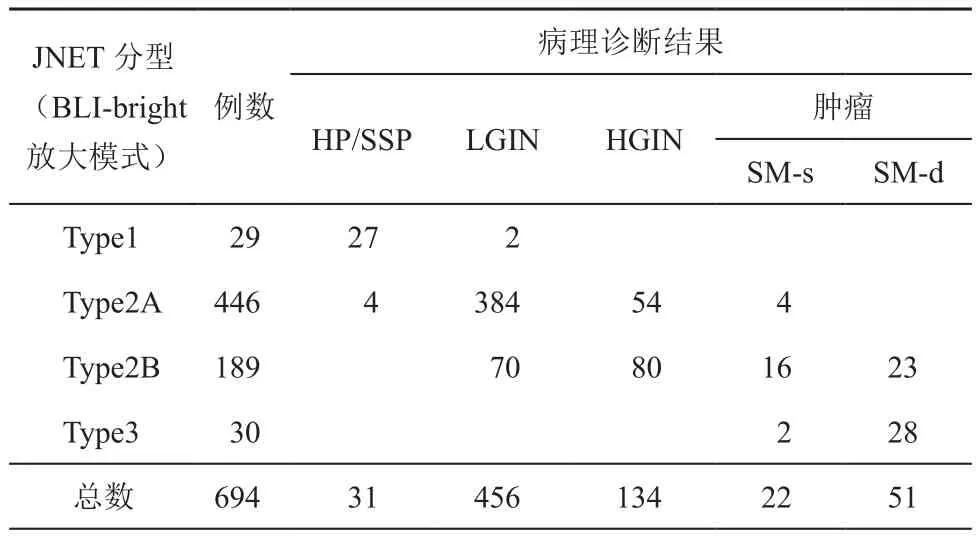
表1 694處病灶BLI結合JNET分型內鏡下診斷與病理診斷的結果(處)

表2 500處息肉樣病灶BLI結合JNET分型內鏡下診斷與病理診斷的結果(處)

表3 194處病灶平坦型BLI結合JNET分型內鏡下診斷與病理診斷的結果(處)
平坦型病灶BLI結合JNET分型內鏡下診斷與病理診斷的結果詳見表3。結合病理學診斷結果,在Type1型中,94.4%(17/18)病灶被診斷為HP/SSP,5.6%(1/18)病灶被診斷為LGIN;在Type2A型中,1%(1/101)病灶被診斷為HP/SSP,87.1%(88/101)病灶被診斷為LGIN,10.9%(11/101)病灶被診斷為HGIN,1%(1/101)病灶被診斷為SM-s;在Type2B型中,42.9%(27/63)病灶被診斷為LGIN,34.9%(22/63)病灶被診斷為HGIN,11.1%(7/63)病灶被診斷為SM-s,11.1%(7/63)病灶被診斷為SM-d;在Type3型中,8.3%(1/12)病灶被診斷為SM-s,91.7%(11/12)病灶被診斷為SM-d。
三、BLI-contrast放大內鏡下分型與病理診斷的一致性
息肉樣病灶與平坦型病灶的JNET分型與相對應的最可能的病理診斷結果可詳見表4。兩種形態學在JNET各分型中差異無統計學意義(P>0.05),結直腸病灶的形態學分類對JNET分型的準確率沒有顯著性影響。
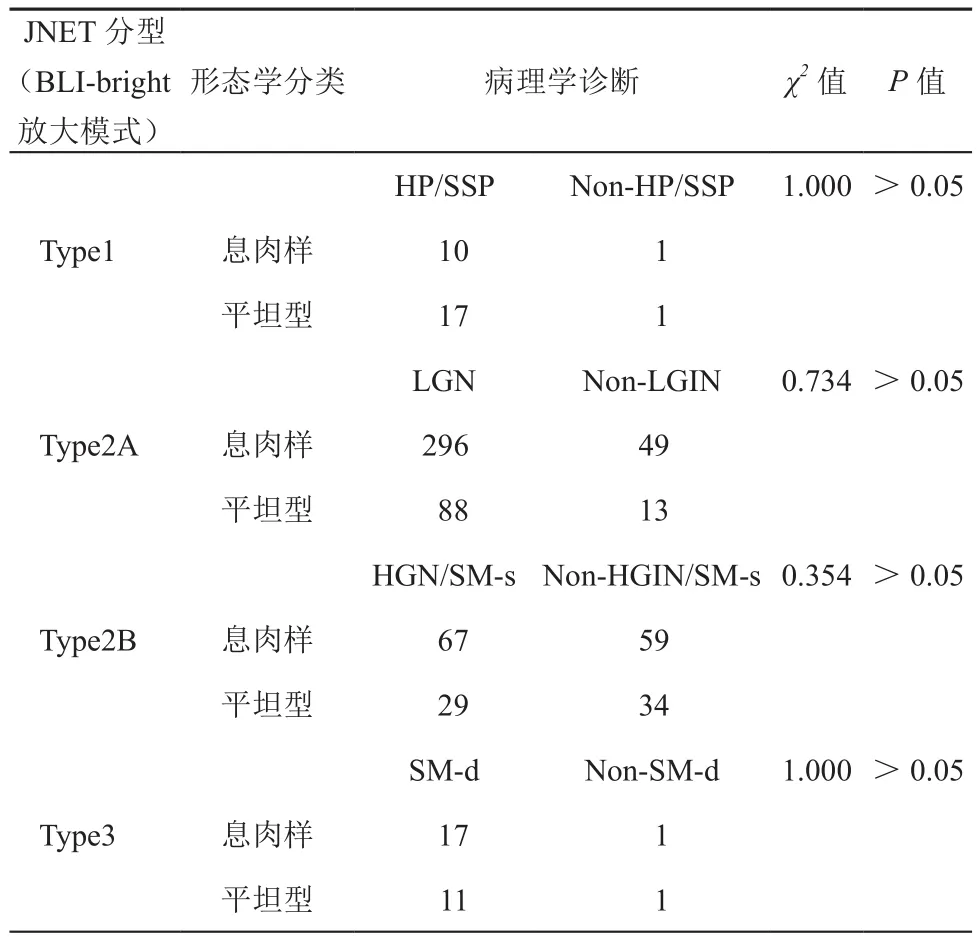
表4 息肉樣病灶與平坦型病灶的JNET分型與病理診斷的一致性
JNET各分型的靈敏度、特異度、陽性預測值、陰性預測值、準確率等可詳見表5。在所有的分型中,靈敏度、特異度等均與NBI放大內鏡(ME-NBI)下對JNET各分型相似[4],故BLI放大內鏡結合JNET分型是判斷結直腸病灶浸潤深度、判斷病理性質的有效手段。

表5 JNET分型在息肉樣病灶及平坦型病灶的準確性(%)
討 論
多數早期結直腸癌可以治愈,5年生存率可達 90%[5],而晚期則不足 10%[5]。通常認為LGIN、HGIN、SM-s可以內鏡下切除,由于SM-d可能有淋巴結轉移的風險,多行外科手術治療[6],故早期內鏡下判斷病灶的病理結果及浸潤深度可以指導臨床醫生選擇恰當的治療方式。結直腸鏡檢查是診斷結直腸病灶性質的主要方法,化學染色內鏡的出現提高了結直腸病灶診斷的準確性,但其操作復雜,并且不能排除化學染料可能帶來的副作用,因此以NBI為帶代表的電子染色內鏡憑借其操作簡便等優點廣泛應用于臨床。但內鏡下結直腸腫瘤診斷標準紛繁復雜,比較常用的有Pit分型、Showa分型,Jikei分型、廣島分型等,每一種分型都有不同的觀察標準,都有各自獨特的術語等,這無疑給內鏡醫生帶來了極大的困擾。除此之外,仍有相關的問題亟待解決:(1)在不同的分型中,診斷SM-d的最可靠的觀察標準不同,使其無法做出最準確的診斷;(2)無法確定在內鏡下做出診斷時,是否需要觀察微腺管的結構(Jikei分型等只觀察微血管,但是廣島分型等卻同時觀察微腺管及微血管);(3)尚未確定形態學的變化是否會影響內鏡下的診斷[3]。為解決存在的問題,日本消化內鏡專家團隊應用NBI于2014年推出了可通用的結直腸腫瘤內鏡下分型—JNET分型。JNET分型以病灶處黏膜微血管及微腺管的結構作為分型標準,包括JNET1、2A、2B、3四種分型。近年來新型的窄帶光內鏡BLI應運而生,BLI采用2種不同的激光作為光源,其中短波長的窄帶激光(410±10)nm能夠獲取病灶黏膜深層微血管的信息,進行窄帶光的觀察。而另一長波長的激光(450±10)nm則能通過熒光刺激產生白光圖像,從而進行白光觀察。
在本研究中,Type1、Type3診斷為HP/SSP、SM-d的準確率(99.1%,96.4%)很高,提示在這兩種病灶中,用JNET分型即可對HP/SSP、SM-d做出準確診斷。有研究[4]認為JNET分型Type2A診斷與LGN有較高一致性,但在本研究中,Type2A的靈敏度(84.2%)、特異度(73.9%)、準確率(80.7%)較之前研究[3-4]低,可能的原因是本研究納入的樣本量較少,且有的病灶的微腺管與微血管的形態變化不規則,介于Type2A與Type2B之間,無法做出準確判斷。在本研究中,Type2B靈敏度(61.5%)、特異度(82.7%)、準確率(78.0%)較低,與之前的研究[3]一致,可能是因為Type2B型病灶對應的病理診斷可包括LGIN、HGIN、SM-s、SM-d,且內鏡下病灶微血管與微腺管的形態變化多樣,增加了內鏡下的診斷難度,面對Type2B內鏡下診斷的困難,相關研究提出[3-4,8]在考慮診斷此型時,為進一步明確診斷,可加用色素染色內鏡放大觀察病灶黏膜處腺管的結構,因為色素染色內觀察SM-d時更靈敏且更準確,可以區分SM-s和SM-d。在Type3型中,對特異度的要求高于靈敏度,這可以指導內鏡醫生避免選擇不必要的外科手術治療,在本研究中,特異度要高,故JNET分型是診斷Type3的有效工具。
不同病灶根據其病理結果特點需要選擇不同的治療方案,LGIN可以內鏡下整塊切除或片狀切除,但HGIN和SM-s病灶最好內鏡下整塊切除,且完整切除后送病理檢查的結果可以明確病灶切除是否完整以及是否需要追加外科手術,故治療之前內鏡下對病灶的診斷及浸潤深度的判斷極為重要。在本研究中,JNET分型是準確判斷HP/SSP、LGIN、SM-d的有效工具,指導臨床醫生選擇合適的治療方案。而對于內鏡下考慮診斷Type2B分型的病灶,有研究認為80%的病灶可以以內鏡下完整切除為第一選擇[9]。通常認為JNET1型病灶可以選擇隨訪,但有研究認為SSP是結直腸腫瘤的癌前病變,與HP相比具有較高的癌變率,與右半結腸癌的發生密切相關,目前國內尚無其治療的規范化指導,國外一般認為應完整地切除,故對于內鏡下診斷為JNET1型,病理活檢提示SSP的病灶,建議行內鏡下完整切除[10-11]。
在本研究中,BLI對病灶的診斷準確率與NBI結合JNET分型對結直腸腫瘤的診斷準確率[4,6]無明顯差異,故BLI結合JNET分型是診斷結直腸腫瘤的有效工具。尤其BLI-bright模式和BLI-contrast模式,前者在保留了高對比度的前提下,在觀察遠處的病灶時可以提供更明亮的視野,后者可觀察病灶微血管的詳細特點,二者均有助于提高診斷準確率。Iwatate等[3]認為,在便用JNET分型判斷結直腸病灶時,作為評價標準,微血管的必要性可達90%,高于微腺管的必要性,后者大約為60%,而相較于NBI,BLI觀察微血管更加清楚[6],故可能進一步提高結直腸腫瘤的診斷率,有待于更進一步的研究。
通常認為不同形態學的結直腸腫瘤具有不同的病理學及分子生物學特點,而在本研究中,息肉樣病灶與平坦型病灶的內鏡下表現差異無統計學意義(P>0.05),所以形態學的差異并不是影響JNET分型在結直腸病灶中應用的因素,這與之前的研究一致[3,6]。
從上述研究可以看出M-BLI憑借其獨特的窄帶激光結合白光光源系統,JNET分型中Type1、Type2A、Type3分別與HP/SSP、LGIN、SM-d有較好的一致性,可以指導內鏡醫生選擇合適的治療方式,但是在判斷Type2B病灶時,仍需要結合色素染色內鏡放大觀察微腺管變化。本研究仍存在不足,研究對象均是之前采取的圖像,所有的圖像均由一名內鏡醫生采集,數據來自于單一中心,研究的樣本量相對較小,且缺乏隨訪觀察等,因此研究結果還需今后多中心大樣本的研究進一步證實。

