重組果聚糖蔗糖酶的發酵優化及應用
唐 煜 ,陳 晟 ,段緒果 ,吳 敬 , 吳 丹 *
(1.食品科學與技術國家重點實驗室,江南大學,江蘇 無錫 214122;2.江南大學,江蘇 無錫 214122;3.江南大學工業生物技術教育部重點實驗室,江蘇 無錫214122)
果聚糖蔗糖酶是一種果糖基蔗糖轉移酶,屬于糖苷酶家族GH68。果聚糖蔗糖酶具有轉糖基和水解活性,大部分果聚糖蔗糖酶具有廣泛的受體專一性,在轉糖基過程中是以蔗糖作為其優先選擇的底物供體,以木糖、蔗糖、乳糖等為受體,催化來自于蔗糖的果糖殘基到受體上從而生成木蔗糖、低聚乳果糖和低聚果糖等產物。由于低聚果糖、低聚乳果糖等低聚糖對人體健康有益[1],因此,果糖基轉移酶的生產越來越受到人們的關注。目前已經發現多種細菌可以產果聚糖蔗糖酶,如丁香假單胞桿菌(Pseudomonassyringae)[2]、多黏芽孢桿菌(Bacillus polymyxa)[3]、枯草芽孢桿菌(Bacillus subtilis)[4]、運動發酵單胞菌(Zymomonasmobilis)[5-6]、淀粉液化芽孢桿菌(Bacillus amyloliquefaciens)[7]、地衣芽孢桿菌(Bacilluslicheniformis)[8]、粘性放線菌(Actinomycesviscosus)[9]、腸膜明串珠菌(Leuconostocmesenteroides)[10]等。不同的細菌產果聚糖蔗糖酶的能力也各有差異,所產果聚糖蔗糖酶對受體的專一性及酶轉化獲得的產物性質也有較大區別。
低聚乳果糖(lactosucrose,LS)是一種三糖(見圖1),由β-D-半乳糖苷、α-D-葡萄糖苷和 β-D-呋喃果糖苷殘基組成,可以被看作是一分子乳糖與一分子果糖的縮合物,或者是一分子半乳糖與一分子蔗糖的縮合物,其化學名稱應為β-D-半乳糖基蔗糖,但習慣上,人們將其稱為低聚乳果糖。低聚乳果糖是一種功能性低聚糖,易溶于水,甜度約為蔗糖的70%,幾乎不被生物體消化和吸收,是雙歧桿菌的有效增殖因子,其增值效果比其他功能性低聚糖如低聚果糖、低聚半乳糖等更好[11-12]。低聚乳果糖同時具有低熱量、低齲齒、降低血液中的膽固醇、改善血脂、促進鈣吸收等特殊的生理功能,可作為一種功能保健食品。國內對低聚乳果糖做了初步研究[13],還沒有工業化生產的報道,而在日本低聚乳果糖已經進入市場多年。由于其具有廣闊的應用前景,近年來低聚乳果糖的研究開發受到了極大的重視。
利用微生物來源的酶制備低聚乳果糖具有成本低、穩定性高、提取方便等特點。使用果糖基轉移酶將蔗糖分解產生的果糖基轉移至乳糖還原性末端的C1羥基上從而合成低聚乳果糖的方法,目前應用比較廣泛的是節桿菌產的β-呋喃果糖苷酶以及納豆芽孢桿菌產的果聚糖蔗糖酶(levansucrase)[14]。目前,國內外尚少見利用Bacillus flexus來源的果聚糖蔗糖酶生產低聚乳果糖的報道。本文主要針對前期構建的一株重組短小芽孢桿菌進行研究,摸索出不同條件對制備果聚糖蔗糖酶的影響,并對不同條件下其生產低聚乳果糖的能力進行探索。
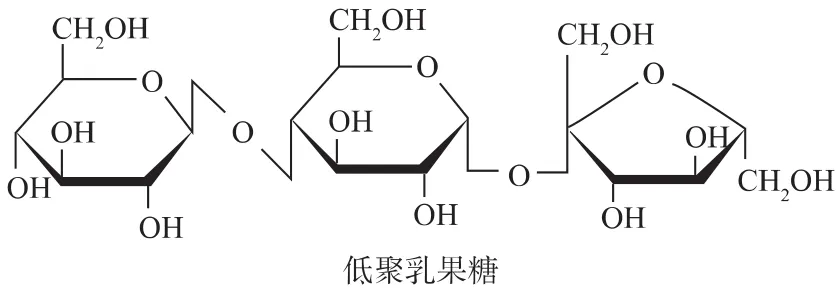
圖1 低聚乳果糖結構Fig.1 Structure chart of lactosucrose
1 材料與方法
1.1 菌株
帶有源自于彎曲芽孢桿菌Bacillus flexus果聚糖蔗糖酶基因lsc的重組短小芽孢桿菌B.brevis/pNCMO2-lsc為本實驗室保藏。
1.2 培養基以及主要試劑
TM液體種子培養基(g/L):葡萄糖 10,多聚蛋白胨10,牛肉浸粉5,酵母粉2,微量元素液10 mL/L。其 中 微 量 元 素 液 組 成 為(g/L):FeSO4·7H2O 1,MnSO4·4H2O 1,ZnSO4·7H2O 0.1。卡那霉素的終質量濃度為 30 μg/mL。
發酵基礎培養基(g/L):同種子培養基。
試劑:蛋白胨、酵母粉購自英國Oxoid公司,新霉素購自上海生工生物工程有限公司,α-乳糖、蔗糖等試劑購自國藥集團化學試劑有限公司。
1.3 搖瓶發酵產果聚糖蔗糖酶
將保存在-80℃冰箱中的菌種以體積分數2%的接種量接種至種子培養基,37℃、200 r/min培養10 h。然后,以體積分數5%接種量轉接至已加入基礎發酵培養基,37℃、200 r/min培養至48 h。將發酵液離心取上清,獲得重組酶的粗酶液。
1.4 酶活力測定方法
首先將粗酶液使用pH 7.0、濃度為20 mmol/L的磷酸鹽緩沖液稀釋一定倍數,取1 mL已稀釋的酶液滴入1 mL 40 g/dL質量濃度的蔗糖溶液并震蕩均勻,置于30℃水浴鍋中催化反應20 min,最后煮沸30 min滅酶。反應后的溶液經適當處理使用高效液相色譜測定酶活。采用Agilent 1200高效液相色譜儀,示差檢測器為安捷倫G1362A,色譜條件為流動相:純水;流速:0.5 mL/min;色譜柱:Hi-Plex Ca 8 μm 300 mm×7.7;柱溫:80 ℃。
一個果聚糖蔗糖酶活力單位(U)定義:在pH 7.0,溫度30℃時每分鐘轉移1 μmol的葡萄糖所使用的酶量。
1.5 菌濃(OD600)的測定
取適量新鮮發酵液,稀釋至適宜濃度,使用分光光度計在600 nm波長處測定吸光值,OD600=稀釋倍數×OD600讀數。空白為去離子水所測得的OD600值。
1.6 單因素實驗
分別使用不同的氮源、碳源和金屬離子作為唯一變量配制發酵培養基進行發酵產酶,其次研究不同溫度對發酵產酶的影響,根據菌體生物量和果聚糖蔗糖酶產量分析最優產酶條件。
1.7 正交試驗
選取4個因素分別為氮源(工業酵母粉∶棉籽粉=2∶1),碳源(葡萄糖∶蔗糖=1∶1),鈣離子和溫度,各取3個水平,其中碳源氮源皆為質量比,進行L9(34)正交實驗,研究最優產酶條件。
1.8 果聚糖蔗糖酶制備低聚乳果糖工藝優化
1.8.1 加酶量和反應時間對低聚乳果糖轉化率的影響 在初始反應溫度35℃,起始pH 7.0,蔗糖和乳糖質量濃度均為200 g/L的情況下,加酶量分別控制為 0.5、1、2、3、4、5 U/g 底物, 設置水浴搖床溫度為30℃、轉速150 r/min,從第2小時開始每隔2 h取樣煮沸終止反應,直至反應達到平衡。產物用HPLC進行檢測。
1.8.2 溫度對低聚乳果糖轉化率的影響 在起始pH 7.0,蔗糖和乳糖質量濃度均為200 g/L的情況下,加酶量為2 U/g底物,轉速150 r/min,使反應溫度分別為 25、30、35、40、45、50 ℃,在反應進行到 8 h時取樣煮沸終止反應,直至反應達到平衡。產物用HPLC進行檢測。
1.8.3 pH對低聚乳果糖轉化率的影響 在起始溫度為35℃時,蔗糖和乳糖質量濃度均為200 g/L的情況下,加酶量為2 U/g底物,轉速150 r/min,使反應 pH 分別為 5.0、5.5、6.0、6.5、7.0、7.5、8.0,在反應進行到8 h時取樣煮沸終止反應,直至反應達到平衡。產物用HPLC進行檢測。
1.9 低聚乳果糖測定方法以及產率的計算
1.9.1 低聚乳果糖測定方法 低聚乳果糖產物中的低聚乳果糖、蔗糖、乳糖以及單糖的量采用HPLC來確定。采用Agilent 1200高效液相色譜儀,示差檢測器為安捷倫G1362A,色譜條件為流動相:純水;流速:0.5 mL/min; 色譜柱:Hi-Plex Ca 8 μm 300 mm×7.7;柱溫:80℃。采用外標法,根據保留時間和峰面積確定相應低聚乳果糖的濃度。示差檢測確定樣品中低聚乳果糖等糖的峰面積,確定他們的含量并計算獲得轉化率。
1.9.2 低聚乳果糖轉化率的計算

式(1)中,R為轉化率;m0為底物總質量;m1為生成低聚乳果糖的質量。
2 結果與分析
2.1 氮源對B.brevis產果聚糖蔗糖酶的影響
2.1.1 氮源種類對B.brevis產果聚糖蔗糖酶的影響 由于B.brevis幾乎不利用無機氮源,使用無機氮源會導致菌體生長緩慢以及酶產量很低[15],故采用有機氮源來研究氮源對菌體產酶的影響,以TM培養基為起始培養基,分別以17 g/L的工業酵母粉、工業蛋白胨、魚粉蛋白胨、大豆蛋白胨、牛肉浸膏、酪蛋白、棉籽粉、多聚蛋白胨、玉米漿粉等取代TM中的氮源,配制發酵培養基,在32℃下進行發酵產酶。實驗結果如圖2所示,采用工業酵母粉和棉籽粉時菌體生長較旺盛且重組酶的產量也達到較大值,故使用工業酵母粉和棉籽粉作為復合氮源進行下一步實驗。
2.1.2 不同氮源配比對B.brevis產果聚糖蔗糖酶的影響 將總氮源質量濃度定為17 g/L,分別以工業酵母粉、棉籽粉、不同質量配比的工業酵母粉與棉籽粉(1∶1、1∶2、2∶1) 作為唯一氮源在發酵培養基中進行發酵產酶培養。如圖3所示,在所用不同比例的工業酵母粉和棉籽粉的復合氮源時,以工業酵母粉∶棉籽粉質量比例為2∶1時產酶能力最強,且菌體生物量也較高。故選擇總氮源含量17 g/L,工業酵母粉與棉籽粉比例為2∶1的復合氮源做進一步研究。

圖2 不同氮源對B.brevis生長和產酶的影響Fig.2 Effect of different nitrogen source on cell growth and enzyme production of B.brevis

圖3 不同氮源配比對B.brevis生長和產酶的影響Fig.3 Effect of different nitrogen proportion on cell growth and enzyme production of B.brevis
2.1.3 復配氮源質量濃度對B.brevis產果聚糖蔗糖酶的影響 將工業酵母粉:棉籽粉比例定為2∶1,研究不同總氮源濃度(5、10、20、30、40 g/L)對果聚糖蔗糖酶產量的影響(圖4),當質量濃度在5~30 g/L時,氮源濃度增加,生物量和酶活也上升,并在質量濃度為30 g/L時酶活達到最大值。當質量濃度為40 g/L時酶活開始減小。產生這種現象可能的原因是較高的氮源濃度會抑制重組酶的表達。因此,選擇30 g/L質量濃度的工業酵母粉與棉籽粉質量比例為2∶1的復合氮源做進一步研究。
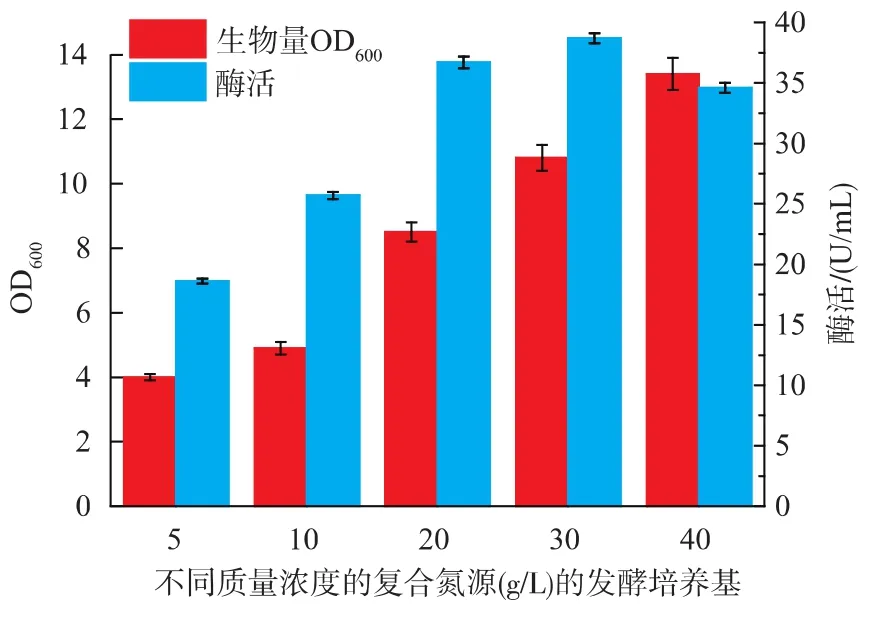
圖4 不同質量濃度的復合氮源對B.brevis生長和產酶的影響Fig.4 Effect of different nitrogen concentration on cell growth and enzyme production of B.brevis
2.2 碳源對B.brevis產果聚糖蔗糖酶的影響
2.2.1 碳源種類對B.brevis產果聚糖蔗糖酶的影響 以上述優化好的復合氮源為唯一氮源,10 g/L的葡萄糖、果糖、蔗糖、淀粉、甘油、和糊精作為唯一的碳源配制培養基并于32℃下發酵產酶。由圖5可知,以蔗糖和葡萄糖為唯一碳源時,培養基中菌體的生物量最高,且對產酶的促進最明顯。故選用蔗糖和葡萄糖作為碳源做進一步研究。
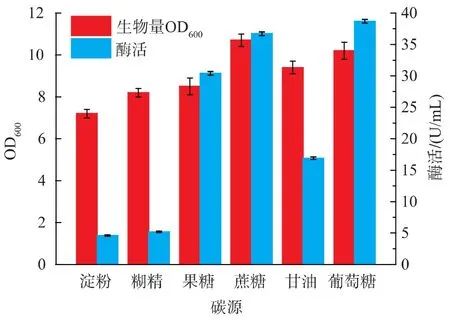
圖5 不同碳源對B.brevis生長和產酶的影響Fig.5 Effect of different carbon source on cell growth and enzyme production of B.brevis
2.2.2 碳源質量濃度對B.brevis產果聚糖蔗糖酶的影響 選取單一碳源發酵中效果較好的蔗糖和葡萄糖進行濃度和復配優化。將種子液分別接種于5、10、20、30 g/L 葡萄糖,5、10、15、20 g/L 蔗糖以及10 g/L葡萄糖+10 g/L蔗糖的復配培養基中進行發酵產酶培養。如圖6所示,在10~30 g/L葡萄糖質量濃度和在10 g/L葡萄糖+10 g/L蔗糖的復配碳源中菌體的生物量都較高,而10 g/L葡萄糖+10 g/L蔗糖的復配碳源產酶能力最強,考慮到實際應用中的經濟因素,故選擇20 g/L葡萄糖做進一步研究。
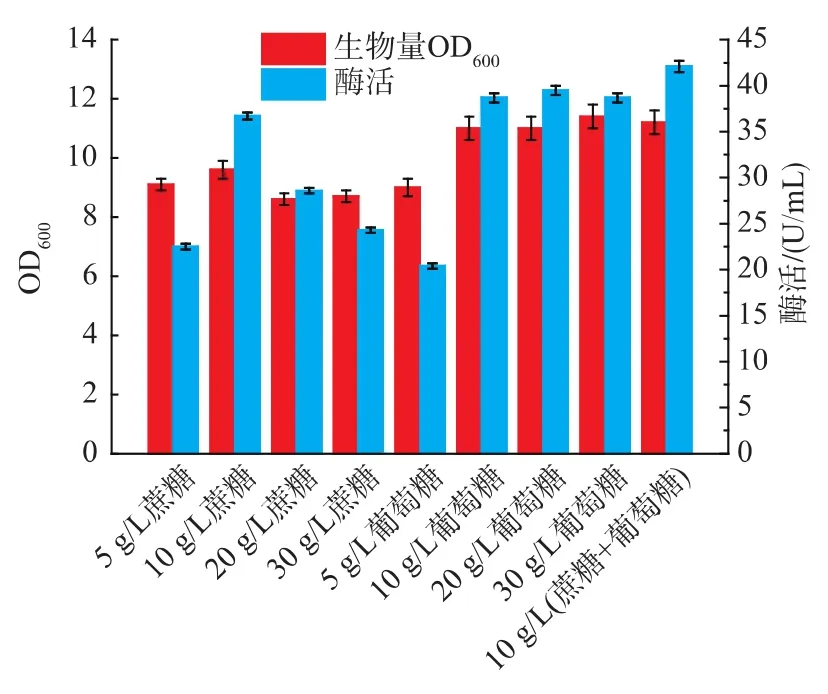
圖6 不同葡萄糖和蔗糖質量濃度以及配比對B.brevis生長和產酶的影響Fig.6 Effect of different concentration and proportion of sucrose and glucose on cell growth and enzyme production of B.brevis
2.3 金屬離子對B.brevis產果聚糖蔗糖酶的影響
由于金屬離子是生理活性物質的重要組成成分,且可以調節生理活性,因此它會對重組菌產果聚糖蔗糖酶產生較大的影響。一般在濃度較低時,這些金屬離子對菌的生長和酶的表達具有促進作用,相反,濃度較高時則表現出抑制作用。為了考察不同金屬離子對重組B.brevis外生產果聚糖蔗糖酶的影響,本實驗在發酵培養基中添加了終濃度為1 mmol/L的不同種類的金屬離子取代TM中的金屬離子混合液進行發酵產酶。由圖7可知,Cu2+不僅不能提高酶活,反而使菌體生長受到抑制,酶活更是受到嚴重抑制,而Mg2+、Co2+和Fe2+作為金屬離子添加劑時,菌體生長也受到一定程度抑制,且酶活也受到一定程度的抑制;只有Ca2+不但可以促進菌體的生長,且酶活有較明顯的提高。而BELGHITH等[16]的研究的芽孢桿菌研究表明Fe2+對酶活有較大的提高,可知微生物來源不同的果聚糖蔗糖酶受金屬離子的種類和濃度的影響也不同。因此選擇Ca2+做進一步研究。
2.4 培養溫度對B.brevis產果聚糖蔗糖酶的影響
溫度通常是間接的影響微生物的代謝活動,但是其影響程度通常也較為明顯。在適宜的溫度范圍內,微生物的代謝活動會較為旺盛。為考察培養溫度對菌體的影響,接種后將發酵培養基置于23、25、27、30、33、37℃溫度下進行搖瓶發酵。由圖8所示,溫度在23~33℃時,菌體量隨溫度的升高而增大,而酶活在27℃時果聚糖蔗糖酶的產量達到最大值61.7 U/mL,27℃即為最適產酶溫度。
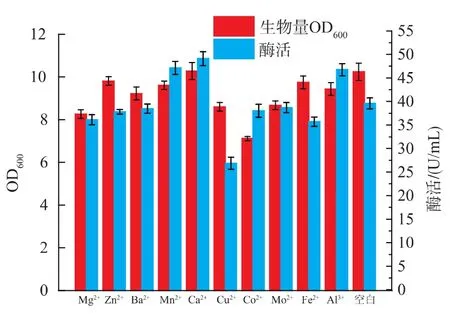
圖7 不同金屬離子對B.brevis生長和產酶的影響Fig.7 Effect of different metal ions on cell growth and enzyme production of B.brevis
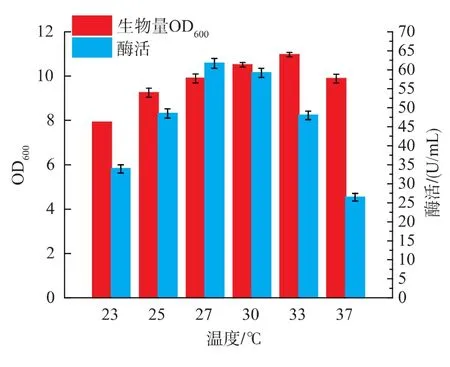
圖8 培養溫度對B.brevis生長和產酶的影響Fig.8 Effect of temperature on cell growth and enzyme production of B.brevis
2.5 正交試驗
根據上述實驗結果,選取對B.brevis產果聚糖蔗糖酶影響較大的4個因素氮源(工業酵母粉∶棉籽粉=2∶1),葡萄糖,鈣離子和溫度,各取 3 個水平,進行L9(34)正交實驗,實驗設計如表1所示,得出的實驗結果如表2。
由表2中正交實驗結果中極差R值得出:4個因素對B.brevis產果聚糖蔗糖酶的影響大小依次是A(氮源)>D(葡萄糖)>C(鈣離子)>B(溫度),根據直觀分析得到最優組合為A3B2C1D3。即氮源總質量濃度為40 g/L,葡萄糖質量濃度為20 g/L,鈣離子濃度為0.5 mmol/L,溫度為30℃,在此條件下酶活可達62.1 U/mL。

表1 正交試驗因素水平設計Table1 Factors and levels of orthogonal test
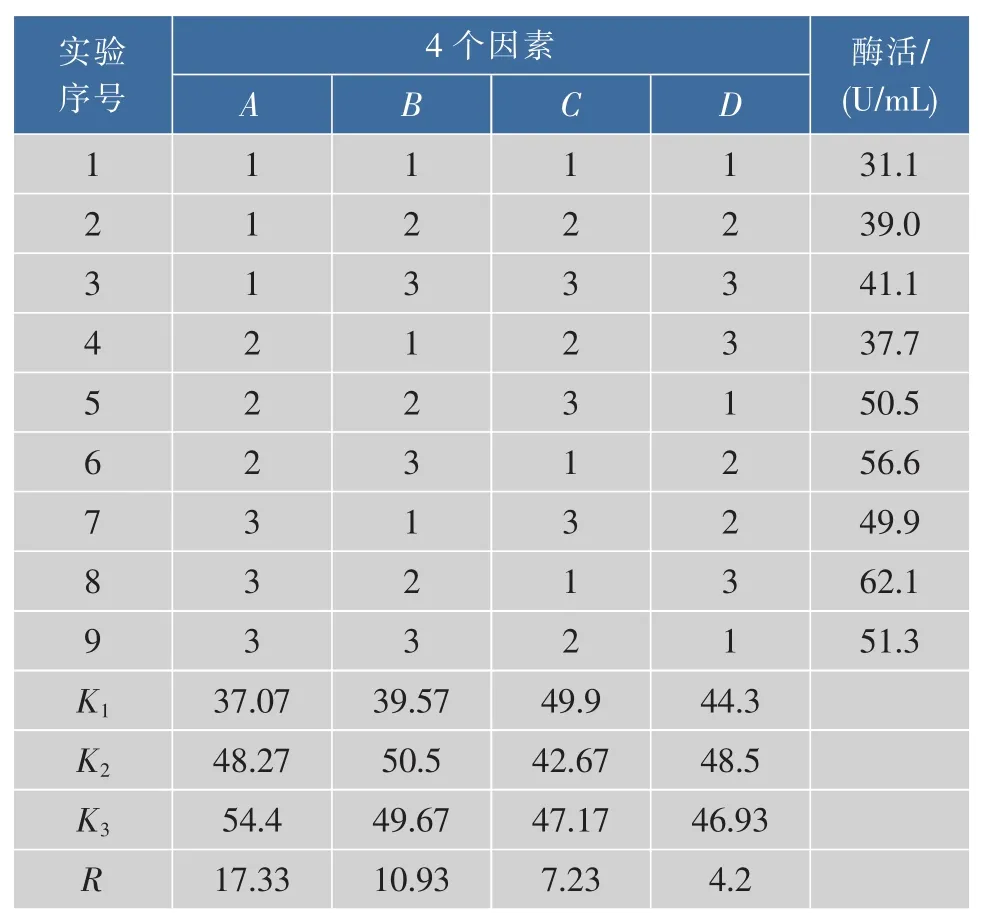
表2 正交實驗結果與分析Table2 Results and analyze of the orthogonal
2.6 果聚糖蔗糖酶制備低聚乳果糖的初步研究
2.6.1 加酶量和反應時間對低聚乳果糖轉化率的影響 酶轉化過程中加酶量不僅影響最終的低聚乳果糖產量,還會影響反應達到平衡的時間。本研究在轉化過程中特定時間點取樣,測定反應體系中低聚乳果糖的含量并繪制低聚乳果糖轉化率變化的曲線。結果如圖9所示,加酶量為0.5 U/g底物時,前期反應速率較低,反應進行10 h達到平衡,低聚乳果糖轉化率為 31.89%。而加酶量為 1、2、3、4、5 U/g底物時,在2~6 h時,他們的轉化率比較接近,在24.41%~29.98%之間。在6 h之后,加酶量為3、4、5 U/g底物的樣品中,低聚乳果糖的轉化率緩慢增加,并接近平衡點,而加酶量為1、2 U/g底物的樣品在6 h之后低聚乳果糖的轉化率仍然繼續增加,在反應進行到8 h時可達到平衡。其中加酶量為2 U/g底物的樣品中低聚乳果糖的轉化率可達到37%。產生上述現象的原因可能是由于加酶量過低時導致其催化能力不足,酶反應速率較低。而加酶量過高時,酶的水解活性大于其轉糖基活性,并且水解產物葡萄糖對低聚乳果糖的合成產生抑制作用,從而降低低聚乳果糖的最終轉化率。在對不同加酶量的產物檢測中,發現隨著反應時間的推移,轉化率有下降的趨勢,此時可檢測到少量蔗果三糖的生成。因此,為了在盡可能短的反應時間內達到最高的轉化率,選用2 U/g底物的加酶量為最佳。
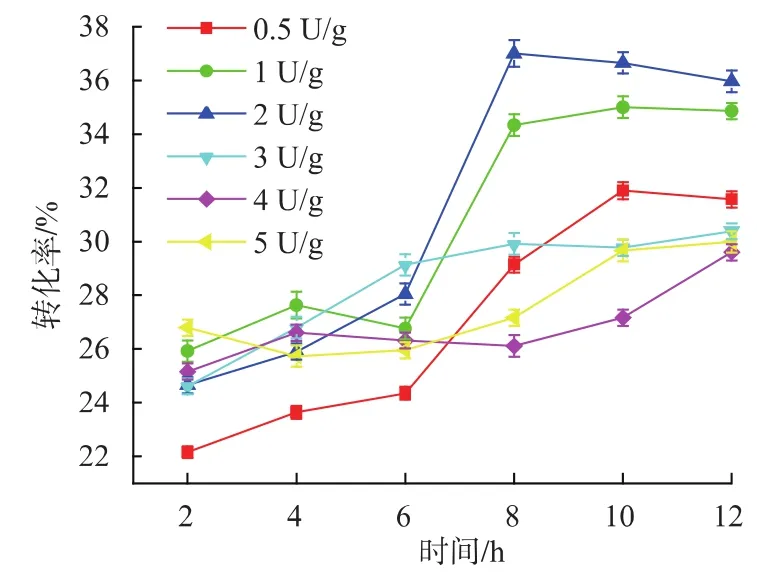
圖9 加酶量和反應時間對低聚乳果糖轉化率的影響Fig.9 Effect of enzyme concentration and reaction time on the yield of lactosucrose
2.6.2 溫度對低聚乳果糖轉化率的影響 見圖10,在不同溫度下低聚乳果糖的轉化率差別較大。在35℃時,低聚乳果糖的轉化率最高,可達到38.3%。在低于35℃時,轉化率隨著溫度的升高而升高,溫度過低時,酶活會受到抑制。而溫度高于35℃之后,轉化率隨著溫度升高開始下降,可能是由于溫度升高,有部分果聚糖蔗糖酶失活。故選擇最適反應溫度為35℃。
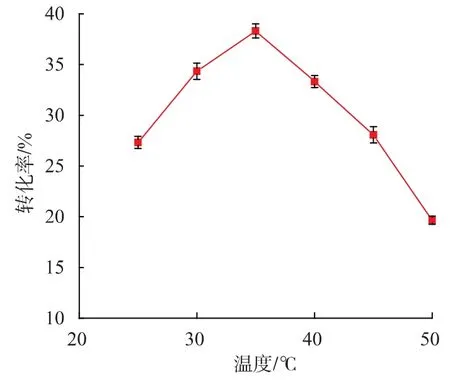
圖10 溫度對低聚乳果糖轉化率的影響Fig.10 Effect of temperature on the conversion rate of lactosucrose
2.6.3 pH對低聚乳果糖轉化率的影響 pH會影響酶的生理活性從而影響到低聚乳果糖的轉化率。見圖11,在pH 6.0時低聚乳果糖的轉化率為39.1%,為不同pH情況下的最高值。此外,在pH 6.0~7.0這個范圍內時,轉化率都維持在較高值。
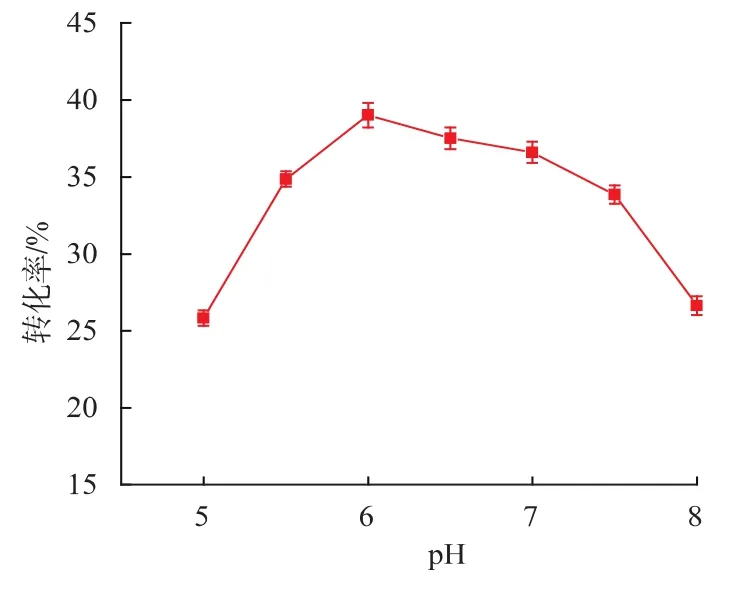
圖11 pH對低聚乳果糖轉化率的影響Fig.11 Effect of pH on the conversion rate of lactosucrose
3 結語
綜上所述,對重組菌產果聚糖蔗糖酶的發酵條件進行優化,確定其發酵產酶的最適培養基為:氮源(工業酵母粉∶棉籽粉=2∶1,質量比)為 40 g/L、葡萄糖為20 g/L、CaCl20.5 mmol/L,最適產酶溫度30℃。在最優條件下發酵培養,果聚糖蔗糖酶的酶活可達62.1 U/mL,是國內外報道的最高水平。利用該重組果聚糖蔗糖酶轉化蔗糖-乳糖制備低聚乳果糖,在蔗糖和乳糖質量濃度均為200 g/L情況下,確定其最適轉化條件:反應溫度35℃,pH 6.0,加酶量為2 U/g底物,低聚乳果糖轉化率可達39.1%,為國內外報道的較高水平。

