生物轉化合成N-乙酰神經氨酸的關鍵因素
朱德強,詹曉北,吳劍榮,鄭志永,趙忠勝,王永遠
(江南大學,糖化學與生物技術教育部重點實驗室,江蘇 無錫 214122)
唾液酸(Sialic acid)是一類含有9個碳原子并具有吡喃糖結構的酸性氨基糖,又稱為神經氨酸,系統名為5-氨基-3,5-二脫氧-D-甘油-D-半乳壬酮糖。唾液酸最初是由Blix和KlenK從頜下腺粘蛋白和腦糖脂中提取出來的,隨著3-脫氧-D-甘油-D-半乳壬酮糖(KDN)的發現,唾液酸的定義得到拓展,迄今為止已經發現了50多種[1]。唾液酸在自然界中分布廣泛,多發現于后口動物及某些細菌中。唾液酸常常占據細胞膜表面糖鏈的末端,在細胞粘附、信號傳導和細胞分化等生理活動中起到重要作用[2]。N-乙酰神經氨酸(Neu5Ac)是最常見的一種唾液酸,也是多種唾液酸合成的前體物質,與人類健康關系密切[3];Neu5Ac還是抗病毒藥物的潛在前體物質,用于治療H1N1和H5N1流感。此外,Neu5Ac也有很大的營養價值,它能促進嬰兒的大腦發育,對維持早產兒腦功能和健康有積極作用[4]。
在前期的研究中,我們構建了一株重組大腸桿菌(E.coliSA-04/pDTrc-AB),通過將GlcNAc-2-epimerase(bAGE)[5-6]和 sialic acid synthase(cNeuB)[7-8]的共表達、GlcNAc跨膜運輸系統的修飾以及Neu5Ac分解代謝途徑的敲除,使得該重組大腸桿菌能夠以胞內磷酸烯醇式丙酮酸(PEP)為能量來源,以GlcNAc為單一底物,生物轉化合成Neu5Ac;同時,避免了傳統細胞催化合成Neu5Ac需要大量丙酮酸(pyruvate)的缺陷,具有很大經濟和環境友好優勢。
在該重組大腸桿菌的培養過程中,我們發現菌體大量生長,胞內酶活性保持較高水平,而Neu5Ac合成產率卻較低。因此,本研究以重組大腸桿菌E.coliSA-04/pDTrc-AB為對象,考察生物轉化環境中的碳源和氮源對重組大腸桿菌生理和Neu5Ac合成的影響,探討Neu5Ac合成過程中的內在關鍵限制性因素,以期實現重組大腸桿菌高效快速合成Neu5Ac。
1 材料與方法
1.1 菌株和試劑
重組大腸桿菌E.coliSA-04/pDTrc-AB由本實驗室在前期工作中構建:以E.coliK-12 MG1655為出發菌株,敲除其基因組中的nagE基因和manXYZ、nanATEK基因簇,并將來源于Campylobacter jejuniNCTC 11168中的neuB基因(cneuB)和源于Anabaenasp.CH1的 AGE基因(bage)克隆到pTrcc99a載體,分別加上trc啟動子實現了2個基因在大腸桿菌中的共表達。
Neu5Ac標準品購自Sigma-Aldrich公司;其他試劑購自上海國藥。
1.2 生物轉化合成Neu5Ac流程
雙階段生物轉化合成Neu5Ac流程見圖1。菌體生長階段,待細胞濃度上升后添加誘導劑IPTG,誘導胞內酶的表達;生物轉化階段,將菌體收集濃縮后懸浮于添加了底物GlcNAc的轉化培養基,同時轉化培養基中含有必要的營養物質以維持細胞活性。
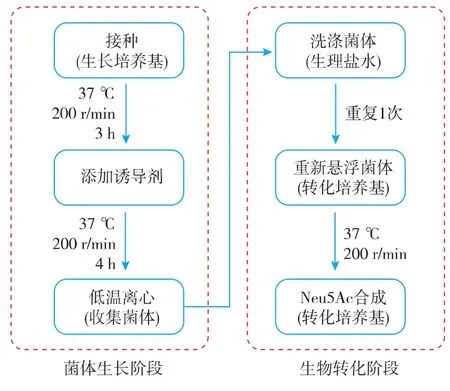
圖1 全細胞生物轉化合成Neu5Ac流程圖Fig.1 Flow chart of whole-cell synthesis of Neu5Ac
1.2.1 菌體生長階段 在菌體生長階段,所用培養基為LB培養基(胰蛋白胨10 g/L,酵母5 g/L,氯化鈉 10 g/L,pH 7.0),添加氨芐青霉素(終質量濃度 100 mg/L),接種于500 mL搖瓶中,置于37℃搖床(200 r/min)中培養大約3 h,當OD600達到1.2時,添加異丙基硫代半乳糖苷(IPTG)至終濃度0.2 mmol/L。繼續震蕩培養4 h后,將菌液收集于冰浴中靜置10 min,然后低溫(4 ℃)8000×g離心 15 min,棄掉上清液,用預冷的生理鹽水洗滌菌體2次,待用。
1.2.2 生物轉化階段 將收集到的菌體重新懸浮于50 mL轉化培養基(OD600=15),轉移至500 mL擋板搖瓶,補加IPTG至終濃度0.2 mmol/L,于37℃搖床200 r/min培養。轉化培養基成分為葡萄糖70 g/L或 甘 油 15 g/L,GlcNAc 80 g/L,MgSO41.2 g/L,K2HPO4·3H2O 25.0 g/L,氮源見表 1,pH 7.0。
1.3 分析方法
1.3.1 生物量測定方法 通過測定600 nm波長下的吸光度值來測定生物量。重組大腸桿菌的干質量與吸光度值的換算關系是:1.0 OD600=0.382 g/L細胞干質量。
1.3.2 蛋白質測定方法 采用考馬斯亮藍G250染色法[9]測定,以牛血清白蛋白(BSA)為標準蛋白質繪制擬合曲線。
1.3.3 Neu5Ac測定方法 Neu5Ac通過高效液相色譜(島津LC2010a)測定。所用色譜柱為伯樂公司的 Aminex HPX-87H column(300 mm × 7.8 mm),柱溫為35℃,流動相為5.0 mmol/L硫酸溶液,流速為0.6 mL/min,使用UV檢測器,檢測波長是196 nm。1.3.4 NeuB活性測定方法 在前期的實驗中,我們發現AGE的活性遠高于NeuB,因此NeuB的活性大小對Neu5Ac的合成具有更大的影響;于是在后續的實驗中,我們重點關注NeuB的活性,其測定方法如下:將發酵液樣品低溫(4℃)離心(10000g,5 min),棄掉上清液后,用預冷的生理鹽水洗滌2次,重新懸浮于生理鹽水中,超聲波破碎(破碎時間:4 s;暫停時間:10 s;共計時間:20 min),低溫離心,收集上清作為粗酶液。
NeuB活性以ManNAc向Neu5Ac的轉化速率來定義。酶活測定體系(1.0 mL)為Tris-HCl 0.1 mol/L pH 7.0,10 mmol/L MnSO4,50 mmol/L ManNAc,50 mmol/L PEP,添加20 μL酶液。將反應體系置于37℃水浴20 min后,沸水浴10 min終止反應。1 min內催化合成1 nmol Neu5Ac所需的酶量定義為1 U。
2 結果與討論
2.1 雙階段生物轉化合成Neu5Ac過程
菌體生長階段,在IPTG的誘導下,源于Anabaenasp.CH1的 AGE基因(bage)和源于C.jejuniNCTC 11168中的neuB(cneuB)在重組大腸桿菌中共表達。在生物轉化階段,外源的GlcNAc在bAGE的催化下,異構化形成ManNAc;繼而在cNeuB 的催化下,與胞內的 PEP 合成 Neu5Ac[8,10]。在此生物轉化過程中,不需過量的外源丙酮酸(pyruvate)供給;但需要消耗胞內的PEP。為提高生物轉化階段的菌體活性,以LB培養基為基礎添加GlcNAc作為生物轉化階段的培養基(標記為LB+培養基,如表 1所示),過程曲線見圖 2(a)。
在生物轉化階段的初始階段,生物量和胞內NeuB活性經歷一個短暫且迅速的下降。這可能是由于在菌體收集與洗滌過程中,在剪切力的影響下,部分細胞的細胞壁受到損傷,同時也伴隨著細胞的自然死亡;同時在經歷冰浴和低溫離心之后,細胞的活性沒有完全復蘇,因此在轉化過程的初期出現生物量下降的現象;而同時,Neu5Ac卻迅速合成。在經歷4 h的適應期后,生物量和胞內NeuB活性迅速上升;但在此時期內,Neu5Ac的合成速率較低,其積累基本停滯,在生物轉化過程結束后,產量僅為(0.38±0.08)g/L。胞內NeuB活性在4 h后顯著上升,但Neu5Ac的合成速率不升反降,且其下降的時間節點與生物量開始增加的時間節點一致。因此推測,胞內NeuB活性不是Neu5Ac合成的瓶頸,而在于底物或能量的供給,而此供給受到了細胞自身生長的抑制。
2.2 氮源對全細胞生物轉化合成Neu5Ac的影響
氮源是大腸桿菌生長不可或缺的營養物質,為探究Neu5Ac合成速率下降與細胞生長之間的內在聯系,我們通過調整轉化培養基中的氮源種類來控制菌株的生長狀態,分別考察有機氮(胰蛋白胨)和無機氮(硫酸銨)為氮源時細胞的生長和Neu5Ac的合成。轉化培養基的成分如表1所示。

表1 轉化培養基名稱與成分構成Table1 Nitrogen sources of catalysis medium
2.2.1 胰蛋白胨作為氮源對重組大腸桿菌合成Neu5Ac的影響 以Typ培養基作為轉化培養基時的轉化過程曲線見圖2(b)。與LB+培養基作為轉化培養基時類似:生物轉化過程的前4 h,生物量與胞內NeuB活性迅速下降,而Neu5Ac迅速合成,將此階段命名為生物量迅速下降期。4 h后,生物量和胞內NeuB活性停止迅速下降,轉而趨于穩定,同時Neu5Ac依然維持較高的合成速率,至12.5 h時,Neu5Ac合成量為(0.51±0.07) g/L,將此階段命名為Neu5Ac快速合成期。12.5 h后,重組大腸桿菌構建起了在轉化培養基中生長所需要的酶系,生物量開始迅速上升,到生物轉化階段結束時,生物量達到(8.17±0.18)g/L,高出初始值 40%;由于轉化培養基中添加了誘導劑IPTG,因此重組大腸桿菌能夠重新合成NeuB,使得胞內NeuB活性維持在較高水平。然而,12.5 h后,Neu5Ac的合成速率沒有隨胞內NeuB活性升高而升高,卻維持在較低水平,至生物轉化階段結束時,終質量濃度僅為(1.01±0.06)g/L。此階段時間占總轉化合成過程的80%,而Neu5Ac合成量卻僅占總量的49.5%,將此階段命名為Neu5Ac慢速合成期。
2.2.2 硫酸銨作為氮源對重組大腸桿菌合成Neu5Ac的影響 以IS培養基為轉化培養基時的合成過程曲線如圖2(c)所示。生物轉化合成Neu5Ac過程經歷了明顯的生物量迅速下降期、Neu5Ac快速合成期和Neu5Ac慢速合成期。而進入Neu5Ac快速合成期后,與有機氮作為氮源不同的是,生物量的下降趨勢雖有減弱但依然處于下降趨勢,在此階段的16 h內,生物量下降了1.30 g/L,胞內NeuB活性也同步下降。Neu5Ac以較高速率合成,在16.5 h內積累量達(0.88±0.07)g/L。相較 Typ培養基,IS培養基中重組大腸桿菌需要更長的時間構建細胞生長所需要的酶系,生物量開始回升的節點比Typ培養基中更遲,在20.5 h后,合成過程進入Neu5Ac慢速合成期:生物量停止下降,迅速回升,到生物轉化階段結束,生物量達到(7.63±0.19)g/L,高出初始值達22.9%;而Neu5Ac的積累速度迅速下降,并維持較低的合成速率直至生物轉化過程結束,Neu5Ac的終質量濃度為(1.20±0.04) g/L。
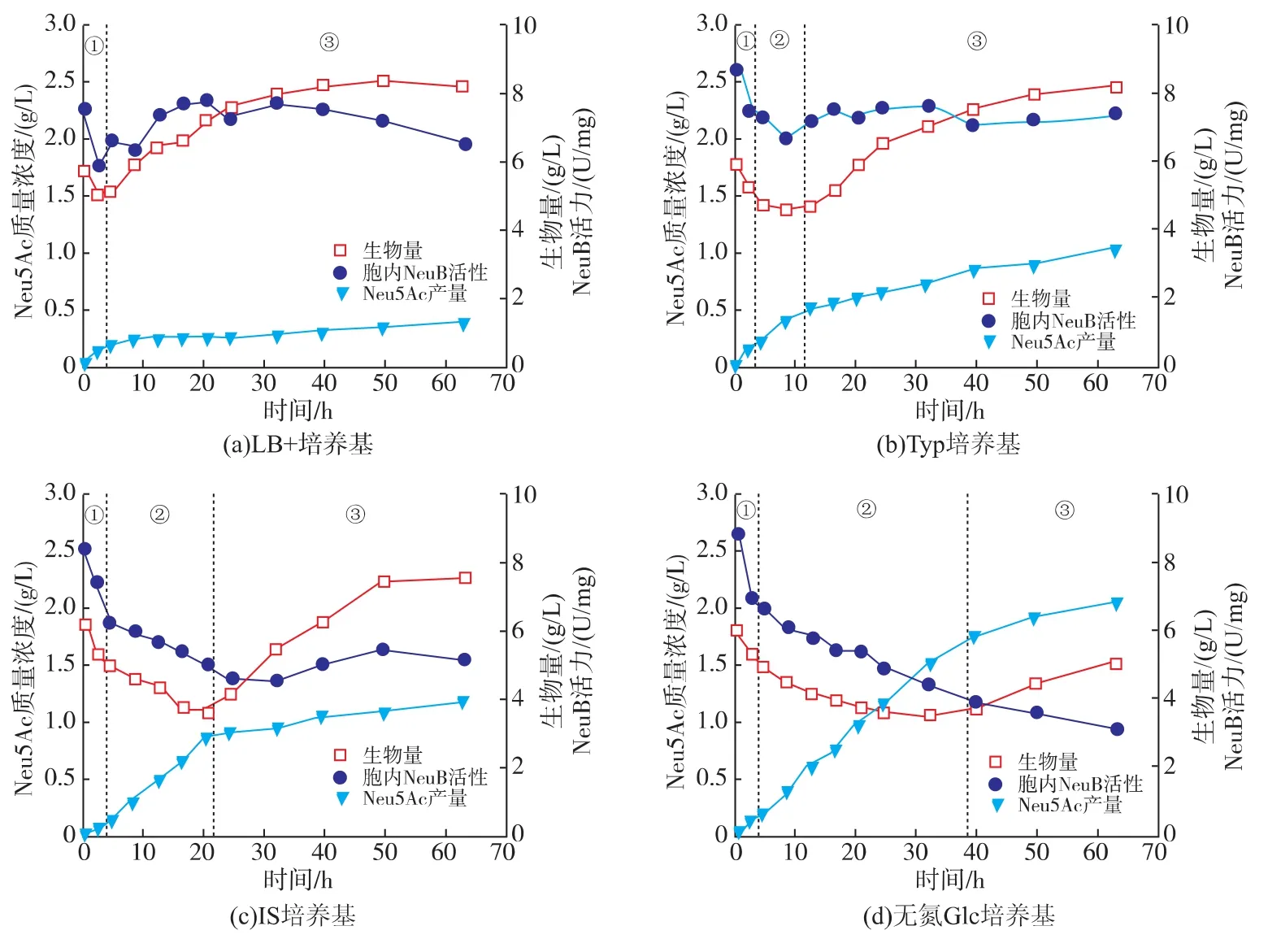
圖2 在不同轉化培養基中重組大腸桿菌生物轉化合成唾液酸Fig.2 Fermentation curve of Neu5Ac production in medium with different nitrogen sources for recombination E.coli
2.2.3 重組大腸桿菌在無氮培養基中合成Neu5Ac
Neu5Ac分子中的氨基,來源于轉化底物GlcNAc,本文所述的無氮源條件是指不添加除GlcNAc之外的氮源。無氮源條件下的Neu5Ac生物轉化合成過程也可以分成3個階段:生物量迅速下降期、Neu5Ac快速合成期和Neu5Ac慢速合成期。在3種不同氮源的轉化培養基中,無氮培養基中的Neu5Ac快速合成期持續時間更長,達到35 h,占總轉化過程時間的55.6%,分別是Typ培養基和IS培養基的8.75和2.19倍,此階段結束時,Neu5Ac質量濃度達到為(1.79±0.11)g/L。雖然不同條件下Neu5Ac快速合成期持續的時間不一致,但此時期Neu5Ac的比合成速率基本一致(如表2所示),說明即使在不同的轉化條件中,處于Neu5Ac快速合成期的重組大腸桿菌的生理狀態基本一致,處于有利于Neu5Ac合成的狀態。而進入Neu5Ac慢速合成期后,重組大腸桿菌生理狀態發生的改變,成為Neu5Ac合成的關鍵限制性因素。除Neu5Ac快速合成之外,此時期的另外一個特征便是前一時期生物量迅速下降的趨勢得到緩解甚至維持相對穩定。
在無氮培養基中,Neu5Ac合成速率下降拐點出現在39 h,轉化過程進入Neu5Ac慢速合成期,生物量開始緩慢上升,轉化過程結束時生物量僅為(4.96±0.28) g/L, 比初始值(5.93±0.08 g/L)略低;Neu5Ac合成速率的下降幅度遠小于氮源存在時的下降幅度,在生物轉化過程結束時,Neu5Ac終質量濃度達到(2.04±0.08)g/L。由于轉化培養基中除GlcNAc外不含其他氮源,而重組大腸桿菌的GlcNAc-PTS已被敲除而無法利用GlcNAc進行細胞生長[11],因此重組大腸桿菌只能依賴前期細胞衰亡破裂后釋放出的少量氮源進行微弱的生長。綜合LB+培養基、Typ培養和IS培養基中Neu5Ac合成過程曲線,可以看到,細胞的生長與Neu5Ac的合成存在緊密的負相關關系:Neu5Ac合成速率下降的拐點與生物量上升的拐點吻合;細胞生長越快,對Neu5Ac合成的抑制作用越早越明顯。在生物轉化和發酵過程中,尤其對于產物合成過程需要消耗大量能量時,細胞的生長常與產物的合成互相抑制,胞內能量供應相對不足。李晶等[12]在土壤桿菌ATCC 31749發酵產熱凝膠過程中采用了氮源限制的雙階段發酵法,在菌體生長階段提供充足的氮源,生物量迅速增加但產膠量極低;待氮源耗盡后不再流加氮源,菌體停止生長,轉而開始大量合成熱凝膠。代謝流分析實驗表明,當碳限制條件轉為氮限制后,由于碳源的補充而使得細胞經歷了短暫的快速生長期,在此時期胞內的pyruvate含量大幅增加,PEP相應減少;此后由于氮源的限制,細胞停止生長,胞內的pyruvate含量減少,PEP相應增加[13]。具體到Neu5Ac的合成過程中,細胞的生長消耗胞內PEP[14],細胞的快速生長會導致胞內PEP相對不足,流向Neu5Ac合成的PEP減少,抑制Neu5Ac的合成。因此,我們可以得出結論:氮源本身不是Neu5Ac合成的關鍵因素,通過限制生物轉化階段的氮源抑制細胞自身的生長,減少了胞內PEP的消耗使得更多的PEP流向Neu5Ac合成,促進了Neu5Ac的合成。
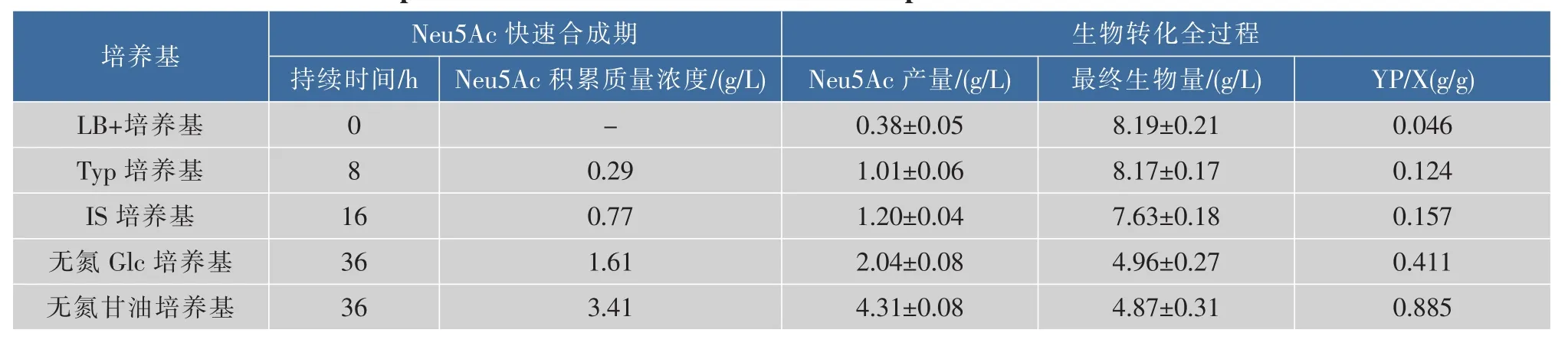
表2 重組大腸桿菌在不同轉化培養基中合成Neu5Ac的對比Table2 Comparison of different medium for Neu5Ac production in recombination E.coli
2.3 不同類型碳源對全細胞生物轉化合成Neu5Ac的影響
從第2.2節和第2.3節可以得出結論,胞內PEP供給不足是Neu5Ac高效快速合成的瓶頸,增加PEP的供給對于Neu5Ac產量的提高有重要意義。在大腸桿菌中,通過代謝轉化培養基中的葡萄糖,糖酵解和糖異生途徑產生PEP[15]。而葡萄糖的跨膜運輸主要依賴于磷酸轉運系統(PTS),在跨膜的同時會消耗PEP從而磷酸化生成葡萄糖-6-磷酸。這對于大腸桿菌的生長具有重要意義;然而由于該過程會與Neu5Ac的合成競爭胞內的PEP,因而可能對于Neu5Ac的合成具有不利影響。因此,我們選擇不依賴于PTS系統的甘油為碳源,對比分析兩種碳源對重組大腸桿菌全細胞生物轉化合成Neu5Ac的影響。
甘油培養基中生物轉化合成Neu5Ac過程曲線如圖3所示。與上述幾種條件類似,轉化過程可以分為3個不同階段。在生物量迅速下降期和Neu5Ac快速合成期,Neu5Ac比合成速率達到0.030 h-1,是其他條件的2~3倍。39 h后,重組大腸桿菌適應了轉化培養基環境后開始生長,加之胞內NeuB活性下降,導致轉化過程進入Neu5Ac慢速合成期,Neu5Ac比合成速率下降(如圖4所示)。到轉化過程結束,Neu5Ac質量濃度達到(4.42±0.08) g/L。甘油為碳源時,其跨膜運輸不依賴于PTS,因此不消耗胞內的PEP,從而使得更多的PEP流向Neu5Ac合成的方向,從而在生物量相同的條件下,提高了Neu5Ac的比合成速率,最終Neu5Ac合成量比無氮培養基中高出111.3%,比初始條件(LB+培養基)高出10.3倍。此外,培養基中甘油的存在對增強細胞膜的流動性和通透性也有促進作用,有利于底物GlcNAc進入胞內和產物Neu5Ac向胞外分泌。
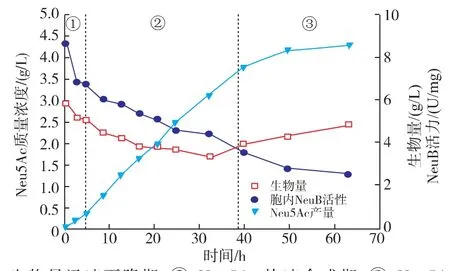
圖3 甘油培養基對重組大腸桿菌合成唾液酸的影響Fig.3 Effects of glycerol medium on Neu5Ac production in recombination E.coli
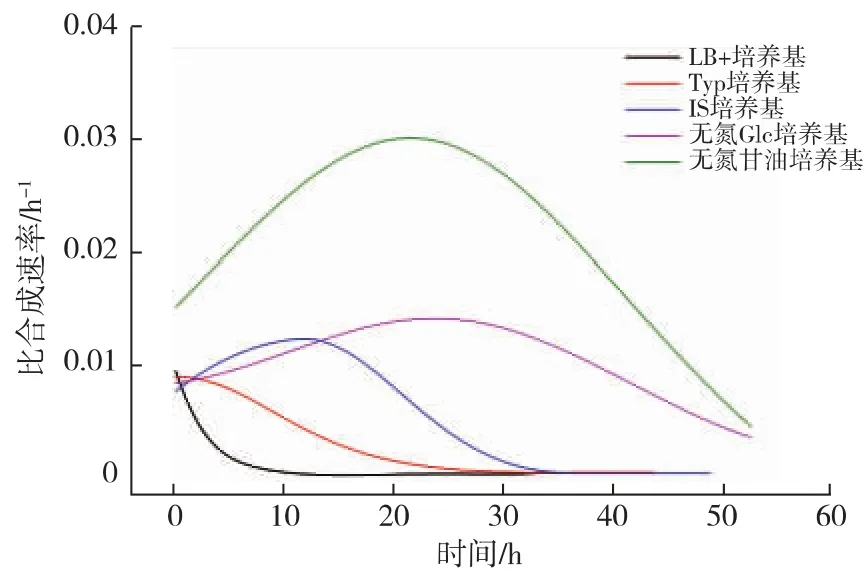
圖4 不同轉化培養基中的Neu5Ac比合成速率Fig.4 Specific production rates of Neu5Ac in different medium
目前,有多種合成Neu5Ac的方法,其中產量最高的方法,首先底物GlcNAc在GlcNAc異構酶催化下生成生成ManNAc,而后ManNAc和pyruvate在Neu5Ac醛縮酶的催化下合成Neu5Ac,該方法16 h合成Neu5Ac產量可達74.2 g/L[16]。由于Neu5Ac醛縮酶催化的可逆反應的反應平衡偏向于Neu5Ac裂解成ManNAc和pyruvate,因此在上述方法中需要添加過量的pyruvate(通常至少5倍),這也導致了pyruvate的浪費和額外的環境壓力。本研究中所用的方法雖然產量不如上述方法,但由于Neu5Ac合成酶催化合成Neu5Ac時以胞內PEP為底物,以高能磷酸鍵為推動反應進行的動力,不需要額外過量的pyruvate。該方法經過優化后,可作為一種環境友好且高效的Neu5Ac合成方法。
3 結語
我們發現,在全細胞生物轉化合成Neu5Ac過程中,胞內PEP的供給是Neu5Ac高效快速合成的瓶頸。當重組大腸桿菌自身生長時,會消耗胞內大量的PEP從而競爭性抑制Neu5Ac的合成。改用不含氮源的轉化培養基,提高了Neu5Ac的合成效率。此外,通過改用不依賴PTS轉運系統的甘油作為碳源,避免了碳源物質跨膜運輸過程中PEP的消耗,大幅提高了Neu5Ac的比合成速率,終質量濃度達到(4.42±0.08) g/L。

